-
银屑病是受遗传与环境影响[1]的由免疫介导[2]的一种慢性、炎症性皮肤病,患者症状常表现为暗红色斑块或浸润性红斑,上覆有白色、层状鳞屑,有蜡滴、薄膜、点状出血等,又称为牛皮癣、白疕。其病理组织在显微镜下呈现表皮层异常增厚、颗粒层变薄或缺失、毛细血管扩张和炎症细胞浸润等特征[3]。据统计,全球约有1.25亿人受银屑病影响[4],发病率呈逐年递增趋势,患者还常伴有心血管疾病、代谢性疾病、精神性疾病和免疫性疾病等合并共病,这些共病不仅影响患者的生活质量,还增加了治疗的难度和复杂性[5]。治疗银屑病存在周期长、易复发等难点,临床治疗主要以缓解患者症状、抑制病情复发及减少共病并发为主[6]。
目前,银屑病的治疗方法包括外用药物、口服药物、生物制剂、光疗法等。轻中度患者常单独外用润肤剂、糖皮质激素、维生素D3衍生物、维A酸类、钙调磷酸酶抑制剂和生物制剂等药物;中重度患者则多系统治疗,如联用糖皮质激素与维生素D3衍生物类等外用药物,口服甲氨蝶呤、环孢素、维A酸类、糖皮质激素等制剂,皮下注射生物制剂及结合光疗法、辅助疗法等[7]。然而,以上治疗方法疗效有限,长期使用可能诱发局部皮肤萎缩、酒渣鼻及依赖性等不良反应,因此,寻求安全、有效、延长复发的药物是治疗银屑病的难点。对此中医药具有辨证论治、副作用小、疗效显著及性价比高等优势。
近年来,多项临床研究表明,中药狼毒口服、外用均可有效治疗银屑病;其提取物可缓解疼痛、促进创面愈合,具有良好的抑菌、抗炎活性[8]。但狼毒的基源和药效物质尚不明确,阻碍了其临床应用。据记载,自西汉以来,药用狼毒以瑞香科狼毒属植物瑞香狼毒(Stellera chamaejasme L.)或大戟科大戟属植物狼毒大戟(Euphorbia fischeriana Steud.)、甘肃大戟(Euphorbia kansuensis Prokh.)的干燥根为主[9-10],上述三种基源的狼毒均有临床应用。为了探究三种狼毒在临床上的疗效差异,本研究拟通过构建 IMQ 诱导的银屑病样小鼠模型,以醇提取物的方式,探究三种狼毒对银屑病的防治作用。
-
SPF级雄性BALB/c小鼠36只,8 周龄,体质量约22~25 g,购于上海斯莱克实验动物有限责任公司,动物质量合格证号:20220004035001;实验动物生产许可证号:SCXK(沪)2022-0004。 本实验经上海中医药大学附属岳阳中西医结合医院实验动物伦理委员会批准。小鼠于上海中医药大学附属岳阳中西医结合医院动物房适应性喂养1周后开始实验。
-
瑞香狼毒(采自河北保定)、狼毒大戟(采自东北吉林)和甘肃大戟(采自甘肃兰州)经上海中医药大学朱建勇副主任药师鉴定为Stellera chamaejasme L.、Euphorbia fischeriana Steud.及Euphorbia kansuensis Prokh.);凡士林[联合利华(中国)有限公司,规格:100 g];5%咪喹莫特乳膏(四川明欣药业有限责任公司,规格:3 g/支);卡泊三醇软膏(爱尔兰利奥制药有限公司,规格:30 g:1.50 mg);95%乙醇(规格:20 kg/塑桶)、二甲苯(规格:500 ml)和30% 双氧水(H2O2,规格:500 ml),均购于国药集团化学试剂有限公司;4% 多聚甲醛固定液(上海碧云天生物技术股份有限公司,规格:100 ml);苏木素-伊红染色剂试剂盒(北京索莱宝科技有限公司,规格:100 ml);柠檬酸抗原修复液(规格:1 L,pH 6.0,即用型),Anti-Ki67 小鼠单克隆抗体(规格:50 μl)、PBS缓冲液(规格:500 ml,pH 7.4,即用型)、牛血清白蛋白(BSA,规格:100 g)和DAB显色试剂盒(规格:200 T),均购于武汉赛维尔生物科技有限公司;超纯水(实验室自制)。
-
BF-08小型高速粉碎机(河北本辰科技有限公司);HDM-500恒温电热套(上海精密仪器仪表有限公司);N-
1300 旋转蒸发仪(上海爱朗仪器有限公司);EG1150H石蜡包埋机、RM2016切片机(德国徕卡仪器有限公司);VS200全玻片扫描仪(日本奥林巴斯有限公司);Heal Force SMART-N 超纯水机(香港力康生物医疗科技控股有限公司)。 -
将适量瑞香狼毒、狼毒大戟和甘肃大戟的干燥根粉碎成粗粉,各取50 g加至回流提取装置中,用4倍量95%乙醇回流提取3次,每次1 h。将提取液过滤、合并,减压蒸馏回收乙醇,分别得瑞香狼毒、狼毒大戟和甘肃大戟浸膏5.61 g、6.41 g和7.04 g。取适量浸膏,加超纯水制成生药含量为1 g/ml的醇提取物溶液,高压灭菌后备用。
-
实验所用的BALB/c雄性小鼠,适应性喂养1周后,背部剃毛约2 cm × 3 cm面积,次日起,除空白组小鼠背部涂抹凡士林外,其余各组小鼠背部均匀涂抹 5% 咪喹莫特软膏,每次涂抹62.5 mg,每日1次,连续7 d。
-
将36只小鼠随机分为空白组、模型组、瑞香狼毒组、狼毒大戟组、甘肃大戟组和卡泊三醇组,每组6只。自造模第1 d起,除空白组和模型组外,其余各组小鼠背部在涂抹造模药4 h后,基于Selenge[11]、Wang[12]及徐[13]等人的报道及前期动物预实验结果,按0.4 ml/10 g分别涂抹浓度稀释至2.5 mg/ml的瑞香狼毒醇提取物、狼毒大戟醇提取物、甘肃大戟醇提取物溶液及62.5 mg卡泊三醇软膏,每日1次,连续7 d。
-
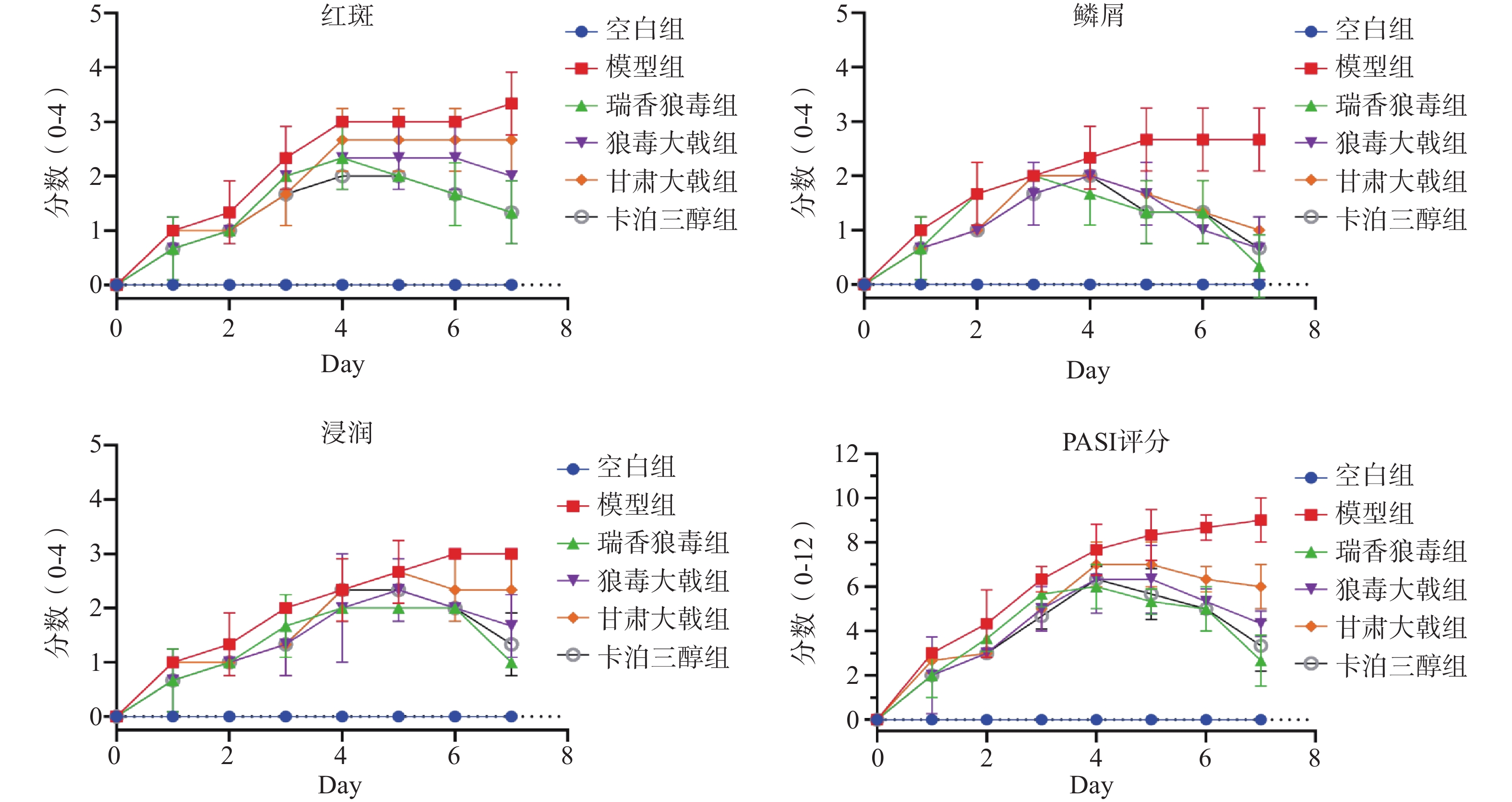
每日拍照记录小鼠背部的皮肤变化。并采用 PASI 评分,按照无(0分)、轻度(1分)、中度(2分)、重度(3分)和极度严重(4分)5个等级,对小鼠的红斑(Erythema)、鳞屑(Scales)和浸润(Tickness)程度进行评分,并将三者的评分相加为总评分,取平均分(n = 6)绘制趋势线,以反映小鼠皮损的变化情况。
-
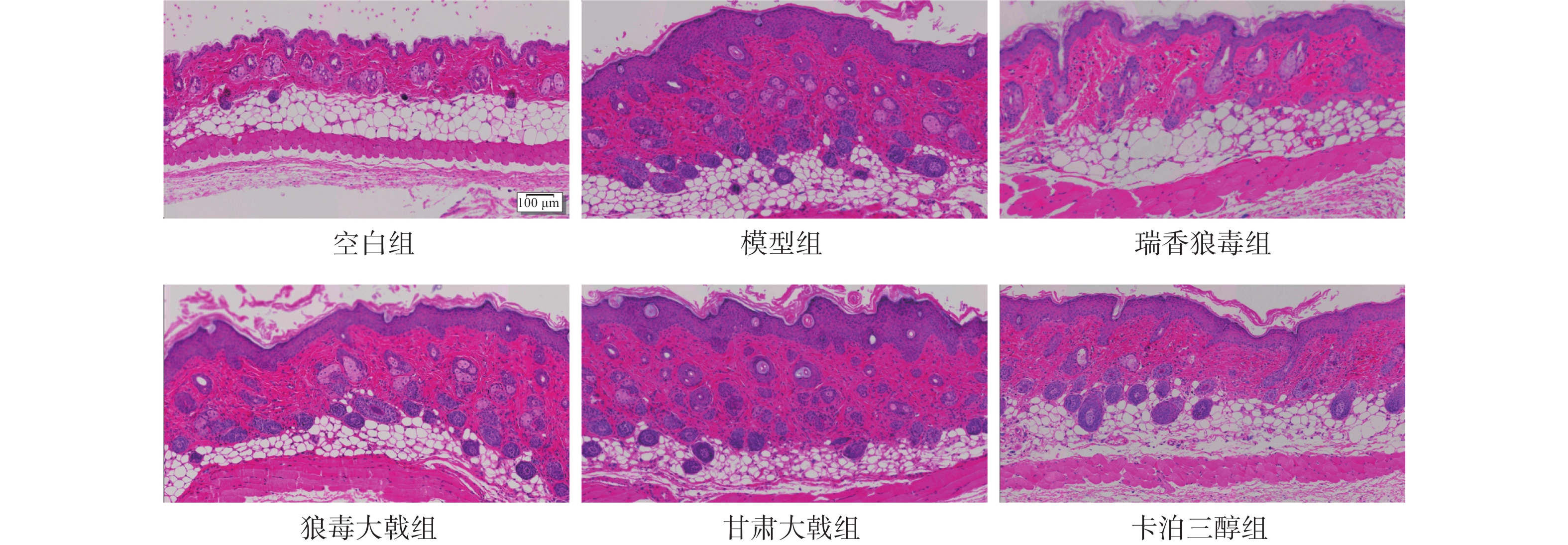
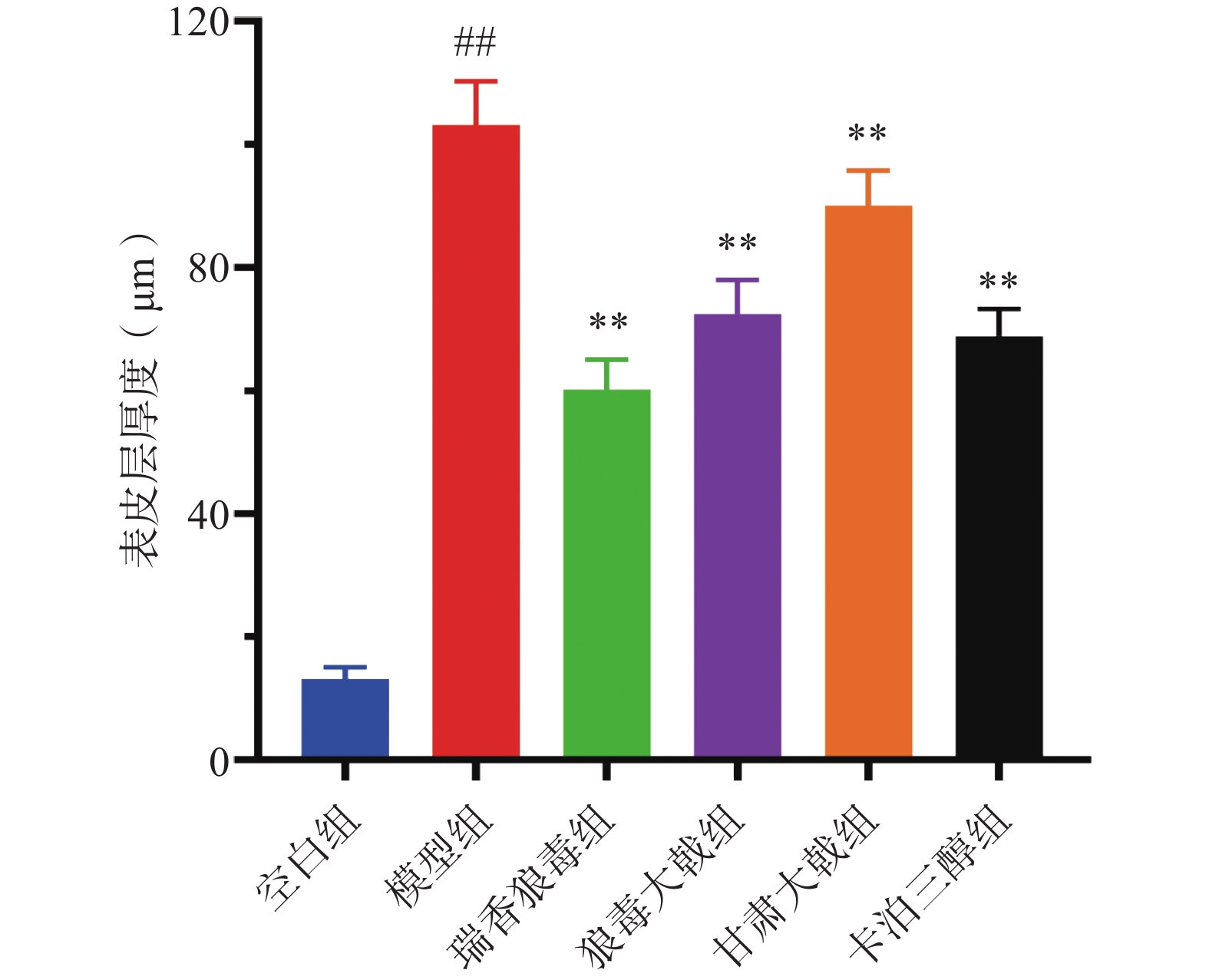
末次给药24 h后,各组小鼠经异氟烷麻醉,脱颈处死后取小鼠背部皮损组织,采用4%多聚甲醛溶液固定24 h以上;经过脱水、石蜡包埋、切片和脱蜡处理后,苏木素染色5 min后,流水冲洗;用 1% 盐酸乙醇分化 0.5 min,流水冲洗 ;用伊红染色2 min,流水冲洗;用乙醇脱水后,二甲苯透化10 min;最后滴加中性树脂封片,自然晾干后,在显微镜下观察皮损组织病理变化,并利用Image J软件测量各组小鼠背部皮损组织表皮层厚度。
-
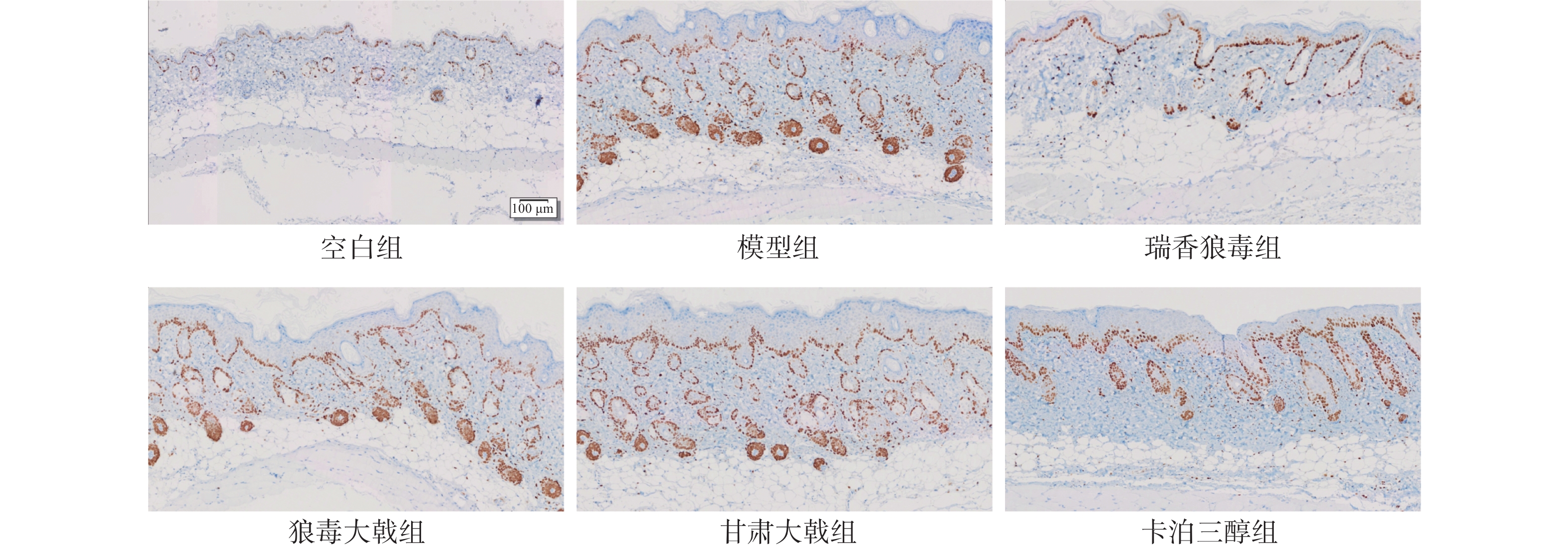
取“2.5”项下皮肤组织切片脱蜡、水化,放入柠檬酸缓冲溶液煮沸10 min进行抗原修复,3% H2O2室温阻断内源性过氧化物酶25 min,PBS冲洗3次,3% BSA室温封闭30 min后,PBS冲洗3次,Ki67抗体(1:500)4 ℃孵育过夜,PBS冲洗3次,二抗室温孵育50 min,PBS冲洗3次,DAB显色2 min,流水冲洗终止显色,苏木精复染细胞核 1 min,脱水、透明、封片。风干后置显微镜下观察,并运用Image Pro Plus 8.0 软件统计Ki67阳性细胞数,并计算Ki67阳性细胞百分率及累计光密度(IOD)。
-
采用GraphPad Prism 9统计软件进行数据分析及科研绘图;计量资料以
$ \bar x \pm s $ 表示,若满足正态分布且方差齐性,多组间比较采用单向方差分析,以P≥0.05表示无差异,P<0.05表示有差异且具统计学意义,P<0.01表示有显著差异。 -
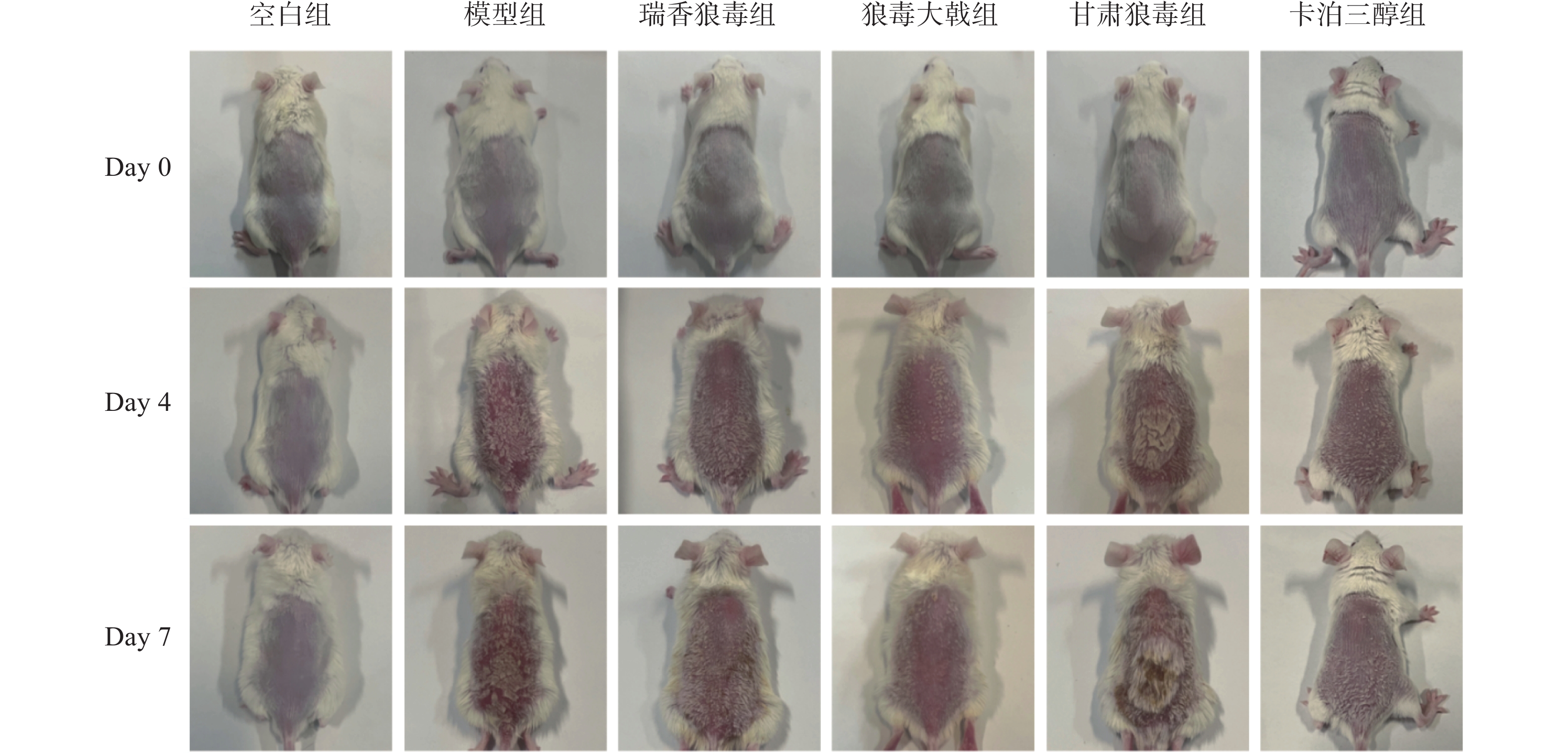
如图1所示,空白组小鼠无皮损变化。与空白组相比,模型组小鼠经IMQ诱导后,其背部剃毛区出现不同程度的皮损;造模第4 d可见小鼠皮肤上伴有大面积红斑和片状鳞屑;第7 d斑块颜色有所加深,鳞屑呈层状分布,有部分鳞屑脱落,以上症状均与寻常型银屑病相符。与模型组相比,经瑞香狼毒、狼毒大戟和甘肃大戟干预后的银屑病样小鼠的皮损程度均有所缓解,其中瑞香狼毒醇提取物的效果较为显著,小鼠皮肤上的斑块颜色变浅、鳞屑大面积脱落、浸润程度减轻。
-
PASI评分结果显示(图2),小鼠自造模第1 d开始,其红斑、鳞屑、浸润及总积分会随时间推移而升高,在第 5 ~ 7 d达到峰值;而瑞香狼毒组、狼毒大戟组、甘肃大戟组和卡泊三醇组的评分均低于同时期的模型组,且在第 4 ~ 5 d后呈下降趋势,其中以瑞香狼毒组的下降幅度最为显著。
-
皮肤组织病理结果显示(图3),空白组小鼠表皮层厚度相对其余各组明显较薄(图4),基底层细胞正常排列,真皮浅层及血管周围未见明显炎性细胞浸润;模型组小鼠表皮层厚度显著增加,角化过度伴角化不全,角质层可见微脓肿,棘层肥厚,棘突向下延伸呈棒槌状,真皮层内毛细血管扩张,且血管周围淋巴细胞浸润明显,符合银屑病样皮肤组织病理特点。瑞香狼毒组、狼毒大戟组、甘肃大戟组和卡泊三醇组小鼠的表皮层厚度均低于模型组(P<0.01),角化不全有所减轻,浸润情况有所改善。结果表明,三种狼毒醇提物均能抑制银屑病样小鼠表皮细胞的异常增殖,降低炎症细胞的浸润。与临床常见的外用药卡泊三醇相比,瑞香狼毒醇提取物的抗银屑病活性更为显著。瑞香狼毒醇提取物能显著改善IMQ诱导的寻常型银屑病小鼠皮损。
-
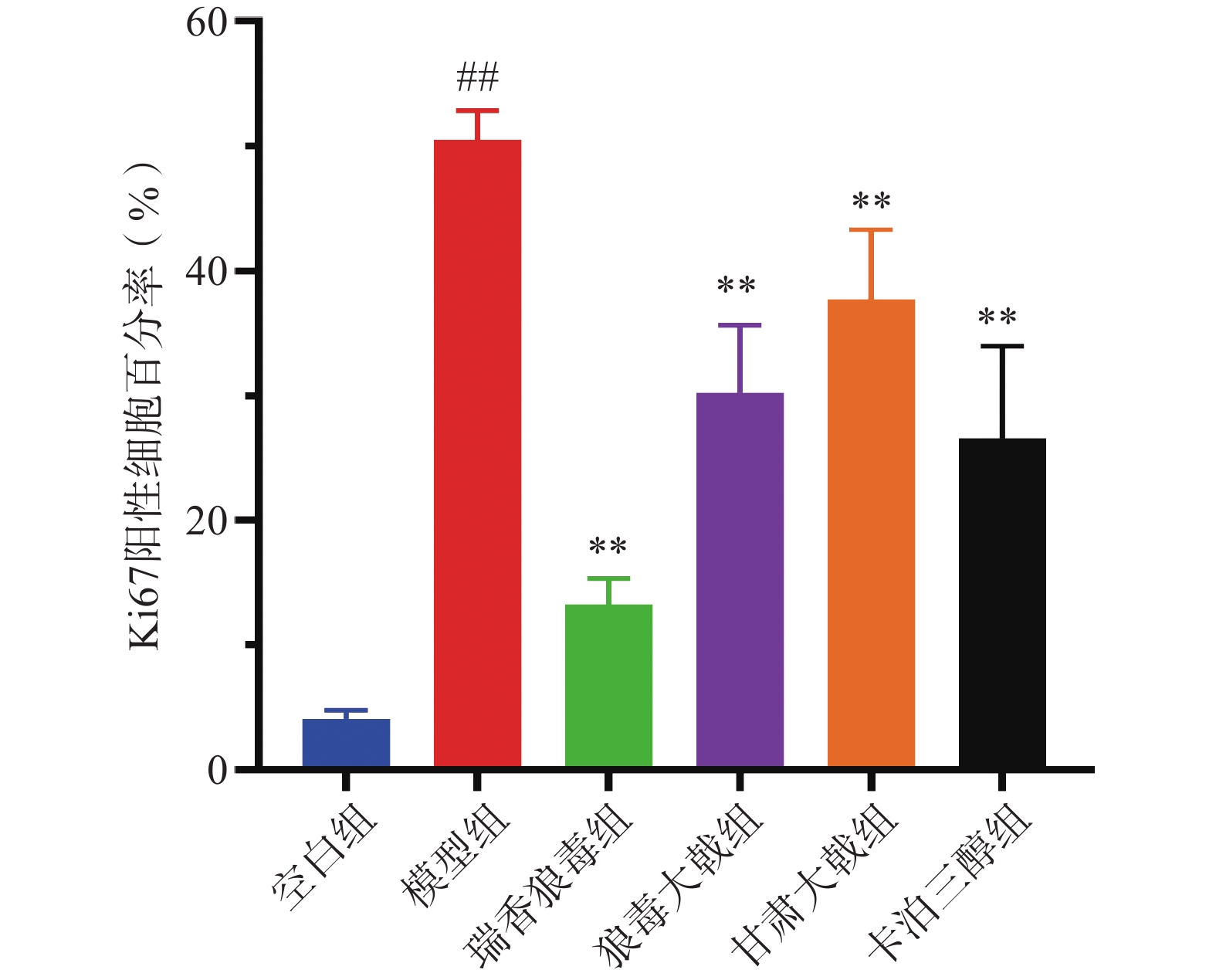
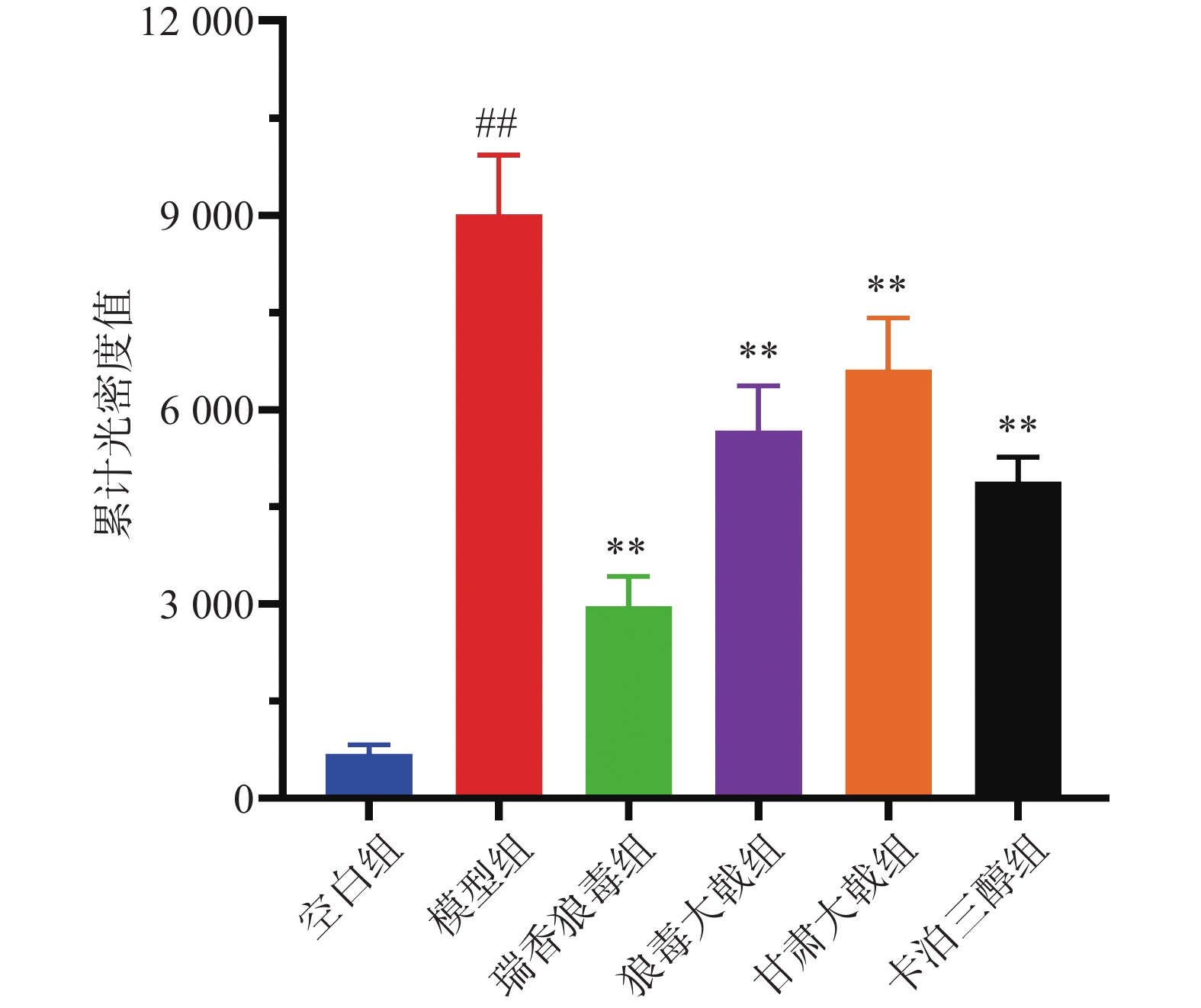
免疫组化结果显示(图5),Ki67在银屑病小鼠的皮肤组织中为椭圆形、棕黄色点状分布。各组小鼠表皮中均有Ki67阳性细胞存在,但着色深浅与面积均有差异,其中空白组小鼠的表皮基底层有极少量Ki67表达,呈单层点状分布;与空白组相比,模型组小鼠的阳性表达显著增加( P<0.01),呈多层密集分布;与模型组相比,三种狼毒均能降低Ki67的表达( P<0.01),其中瑞香狼毒组中Ki67基本呈单层线状分布,其阳性细胞百分率(图6)和累计光密度值(图7)均显著降低(P<0.01),其抑制作用优于卡泊三醇组。
-
中医认为银屑病是由于血热、湿热、风邪[14]等因素导致的,治疗时使用清热解毒、祛风止痒、活血化瘀等中药可有效改善银屑病的症状[15]。据报道,狼毒在治疗血热证银屑病、角化病等皮肤病上具有显著的疗效[11],在银屑病的治疗和预防方面具有潜在价值和应用前景。然而狼毒的同名异物品种很多,基源多达十几种,使得狼毒的质量和疗效存在一定的不确定性。据历代本草记载和近现代文献考证,瑞香科狼毒属瑞香狼毒 Stellera chamaejasme L.是药用狼毒的主流品种[16],为狼毒正品,其味苦辛、性平,入肺、脾、肝经,可用于治疗心腹冷痛、结核及疥癣等诸多病症,具有镇痛、免疫调节、抗菌、抗病毒及抗肿瘤等药理活性[17],其根含有二萜类、黄酮类和苯丙素类等多种化学成分[18-20];而大戟科大戟属狼毒大戟Euphorbia fischeriana Steud.和月腺大戟Euphorbia ebracteolata Hayata分别是䕡茹和草䕡茹[21],为狼毒的混淆品[22],且经《中国植物志》中的形态对比,月腺大戟Euphorbia ebracteolata Hayata实为甘肃大戟Euphorbia kansuensis Prokh.的异名[23]。狼毒大戟根呈圆锥形,切面可见同心环;月腺大戟根偏椭圆型,切面可见不规则的大理石样纹理或环纹[24]。两者的根含有二萜类、三萜类、酚酸类、生物碱类和蒽醌类等成分[25-27]。
为了探究上述三种基源的狼毒治疗银屑病的疗程差异,本研究对其进行了体内抗银屑病活性实验。结果表明,三个品种的狼毒均能有效改善银屑病样小鼠皮损,其中瑞香狼毒的抗银屑病活性最佳,但其作用机制暂未明确。因此,本课题组后续拟借助中药靶点钩钓技术及体内外研究方式,将进一步探讨瑞香狼毒治疗银屑病的药效成分及作用机制,为银屑病的治疗提供新的思路和方法。同时,也为狼毒的质量控制和标准化提供参考,确保其安全性和有效性。
The preventive and therapeutic effects of three ethanol extracts derived from three sources of Stellera chamaejasme L., on imiquimod-induced psoriasis in mice
-
摘要:
目的 考察三种基源的中药狼毒(瑞香狼毒Stellera chamaejasme L.、狼毒大戟Euphorbia fischeriana Steud.和甘肃大戟Euphorbia kansuensis Prokh.)乙醇提取物外用对咪喹莫特(Imiquimod,IMQ)诱导的银屑病小鼠的防治作用。 方法 将36只BALB/c 雄性小鼠随机分为空白组、模型组、瑞香狼毒组、狼毒大戟组、甘肃大戟组和卡泊三醇组,每组 6 只,通过PASI 评分记录各组小鼠的皮损变化,HE染色观察皮肤组织病理形态并测量表皮厚度,免疫组化检测小鼠皮损组织中细胞核抗原 Ki67 的表达情况。 结果 与模型组相比,三种狼毒乙醇提取物均能降低银屑病样小鼠PASI评分,抑制表皮异常增厚,减少表皮 Ki67异常表达,其中瑞香狼毒的治疗效果最为显著,且优于临床常用药卡泊三醇。 结论 瑞香狼毒乙醇提取物具有较好的抗银屑病活性作用,可抑制角质形成细胞异常增殖,减少皮损组织Ki67表达,显著改善银屑病样皮损。 Abstract:Objective To investigate the preventive and therapeutic effects of ethanol extracts derived from three sources of traditional Chinese medicine: Stellera chamaejasme L., Euphorbia fischeriana Steud., and Euphorbia kansuensis Prokh., on imiquimod (IMQ)-induced psoriasis in mice. Methods Thirty-six male BALB/c mice were randomly divided into the following 6 groups with 6 mice in each group: blank control, model, Stellera chamaejasme, Euphorbia fischeriana, Euphorbia kansuensis, and calcipotriol. PASI (Psoriasis Area and Severity Index) scores were used to record the changes of skin lesions in each group; HE (hematoxylin-eosin) staining was used to observe the pathological morphology of skin and measure the thickness of the epidermis. Immunohistochemistry was used to detect the expression of nuclear antigen Ki67 in the skin tissues of mice. Results Compared with the model group, the three kinds of ethanol extracts can reduce the PASI score, inhibit epidermal thickening, and decrease expression of Ki67 in the psoriasis mice. Among them, the therapeutic effect of Stellera chamaejasme was the most significant and it was better than the commonly used topical drug calcipotriol. Conclusion The ethanol extract of Stellera chamaejasme has good anti-psoriatic activity, can inhibit the abnormal proliferation of keratinocytes, can reduce the expression of Ki67, and can significantly improve psoriasis-like skin lesions. -
抗真菌感染尤其深部真菌感染是抗微生物感染的重要研究内容,也是全球范围医学研究中面临的严峻挑战。近年来,在免疫力低下和重症监护病房患者中[1],真菌感染发病率和病死率逐年增加,其中在侵袭性念珠菌病中,病死率约为40%[2]。白色念珠菌是真菌感染中最常见的病原体,可以在正常人体的皮肤、口腔、阴道和肠道等部位定植[3]。临床上,多烯类、棘白菌素类、唑类和烯丙胺类药物是治疗真菌感染最常用的药物[4],然而由于白色念珠菌的耐药性、形成生物被膜以及部分药物较大的毒副作用等问题,传统抗真菌药物的应用面临新的挑战[5]。因此,增加现有抗真菌药物的药效,降低其毒副作用,是抗真菌药物研发的重要方向。利用药物新剂型的研究降低其毒副作用是有效的药物研发途径。例如,成功上市的两性霉素B脂质体即可极大降低两性霉素B的肾脏毒性[6]。
醋酸卡泊芬净(CAS)是一种棘白菌素半合成类抗真菌药,作用于真菌细胞的细胞壁,能有效抑制细胞壁中β-1,3-D-葡聚糖的生物合成,是目前白色念珠菌系统性感染治疗中的一线推荐药物。然而,CAS价格昂贵,通过药物合用的方式,维持或增强CAS的治疗效果,降低其使用剂量,可以显著减少患者的用药成本。与此同时,降低药物剂量可以减少CAS的毒副作用。有研究显示,患者在接受高于批准剂量3倍的CAS作用下,高剂量组中65%的患者会出现肝毒性,包括肝酶升高和肝衰竭[7]。我们在前期研究中发现单硬脂酸甘油酯(GMS)与CAS联合用药具有良好的协同作用,增强CAS体外抑菌效果,如两者联用体外抑菌MIC由
0.0625 μg/ml降低到0.0313 μg/ml[8]。然而,GMS与CAS混合使用,由于溶解性差异和药代动力学不同,可能无法在体内同时达到作用部位,共同杀灭真菌,本研究通过制备醋酸卡泊芬净单硬脂酸甘油酯固体脂质纳米粒为上述问题解决提供思路,并发挥体内协同抗菌的效果。固体脂质纳米颗粒(SLNs)以固态天然或合成的类脂如卵磷脂、甘油三酯等为载体,将药物包裹或夹嵌于类脂核中制成的纳米给药系统[9],可以包载亲脂性或者亲水性药物,提高药物的稳定性[10]。具有毒性低生物相容性好、物理稳定性好、体循环中药物不易泄露的特点[11]。通过药物协同增加抑真菌作用,可以减少给药用量与给药次数,提高药物疗效;进而降低抗真菌药物的毒副反应;同时减少真菌耐药性的产生[12]。基于以上研究基础,本研究以单硬脂酸甘油酯作为载体材料制备卡泊芬净固体脂质纳米粒,考察纳米粒对卡泊芬净的协同增效作用。
1. 实验仪器和材料
1.1 菌株
标准菌株白色念珠菌SC5314由美国Georgetown大学William A Fonzi教授赠予。
1.2 实验试剂及仪器
醋酸卡泊芬净(上海源叶)(≥98%);单硬脂酸甘油酯、蛋白胨、葡萄糖、琼脂(上海生工);乙腈、泊洛沙姆188、磷酸、甲醇(中国国药);DMEM高糖培养基、PBS缓冲液(上海泰坦);酵母提取物、营养肉汤(BD公司);RPMI
1640 (美国Gibco)。马尔文粒度电位仪(英国Malvern);透射电子显微镜(日本JEOL);高效液相色谱仪(美国Thermo);超声波细胞粉碎机(宁波新芝生物);高速离心机(德国Hettich);涡旋混合器(日本LTS);电子天平(瑞士MettlerToledo);洁净工作台(上海力申);多功能功能酶标仪(瑞士TECAN)。
1.3 实验动物
ICR小鼠,雌性,体重20~22 g,由苏州华创信诺医药科技有限公司提供,动物许可证号:SCXK(苏)2020-0009。
2. 实验方法
2.1 白色念珠菌培养
将在SDA固体培养基上保存的白色念珠菌单克隆菌株转接到3 ml YEPD培养基,30 ℃,200 r/min,培养18 h,使白色念珠菌处于指数生长的平台期。将活化的菌株转移到离心管中,重悬、离心洗涤3次后加入1 ml pH=7.4 PBS(0.01 mol/L)重悬,备用。
2.2 CAS含量测定
2.2.1 色谱条件
色谱柱:Diamonsil Plus C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈∶0.1%磷酸(35∶65);流速:1 ml/min;检测波长:227 nm;柱温为25 ℃;进样量:20 μl。
2.2.2 方法学验证
专属性考察:取醋酸卡泊芬净标准液、空白SLNs溶液、CAS-SLNs溶液,经0.22 μm滤膜过滤后,按“2. 2. 1”项下色谱方法进样检测。
线性和范围:精密称取CAS并定量配置质量浓度为1、5、10、20、40、50 μg/ml的CAS溶液。按“2.2.1”项下色谱方法进行检测,横坐标为CAS浓度,纵坐标为峰面积,绘制标准曲线。
精密度:日内精密度取5、20、40 μg/ml 3个浓度的CAS溶液各3份,分别检测3次;日间精密度是取低、中、高3个浓度的CAS溶液各3份,每3 d进行检测。
溶液稳定性:同一样品在0、1、2、3、5、8、12 h分别按“2.2.1”项下色谱方法进行检测,计算RSD以考察样品溶液的稳定性。
回收率:取空白SLNs溶液,分别取5、20、40 μg/ml 3个浓度的CAS溶液,超声破乳后,经0.22 μm滤膜过滤后按“2. 2. 1”项下色谱方法进行检测,计算回收率。
2.3 CAS-SLNs的制备和表征
2.3.1 CAS-SLNs的制备
采用熔融法制备醋酸卡泊芬净固体脂质纳米粒(CAS-SLNs):称取处方量的CAS、GMS、卵磷脂(CAS、GMS、卵磷脂摩尔比为1∶20∶5)完全溶解于甲醇中,加热条件下磁力搅拌混合均匀作为油相。配置0.2%泊洛沙姆188溶液,加热至相同温度作为水相。在磁力搅拌条件下(500 r/min),将水相缓慢滴入油相,加热条件下持续搅拌30 min,得到初乳。取初乳超声10 min(250 W,1 S,1 S),4 ℃固化过夜,即得到CAS-SLNs。
2.3.2 CAS-SLNs的表征
马尔文粒度仪测定SLNs的粒径和Zeta电位,磷钨酸负染后透射电镜观察其表面形态。
2.3.3 CAS-SLNs包封率测定
使用低温超速离心法,取所制备的CAS-SLNs溶液于离心管内
15000 r/min下离心2 h,取上清液500 μl于5 ml量瓶内并定容至刻度。另取500 μl未经离心的CAS-SLNs溶液于5 ml量瓶内并定容至刻度,甲醇超声破乳,分别取以上各组溶液经0.22 μm滤膜进样检测并计算载药量和包封率。根据公式(1)计算包封率(EE)、公式(2)计算载药量(DL):$$ \mathrm{E}\mathrm{E}=\frac{{M}_{\text{投药量}-}{M}_{\text{上清液含药量}}}{{M}_{\text{投药量}}}\times 100\text{%} $$ (1) $$ \mathrm{D}\mathrm{L}=\frac{{M}_{\text{实际包载量}}}{{M}_{\text{载药纳米粒}}}\times 100\text{%} $$ (2) 2.4 体外抗真菌活性的测定
2.4.1 CAS-SLNs最低抑菌浓度(MIC)的测定
制备药敏实验板:取96孔板。第1列配置100 μl RPMI1640培养基做空白对照;第12列配置100 μl菌液做阳性对照;第2列加200 μl菌液,分组为CAS、CAS + GMS(CAS与GMS物理混合)、CAS+SLNs(CAS与空白SLNs物理混合)、CAS-SLNs,每组两行,每孔CAS含量浓度为0.313 μg/ml。2~11列进行倍比稀释,最终使得CAS浓度为3.13×10−2 μg/ml、1.57×10−2 μg/ml、7.83×10−3 μg/ml、3.91×10−3 μg/ml、1.96×10−3 μg/ml、9.78×10−4 μg/ml、4.89×10−4 μg/ml、2.45×10−4 μg/ml、1.23×10−4 μg/ml、6.13×10−5 μg/ml、3.06×10−5 μg/ml。30 ℃恒温孵育24 h,用酶标仪在λ=630 nm处测A值。100 μl RPMI 1640培养基做空白对照记为A空白,菌液做阳性对照记为A阳性,加入各实验组记为A实验,MIC定义为使白色念珠菌A630降低80%以上的最小药物浓度。
2.4.2 生物被膜抑制效果的测定
制备生物被膜板:1640培养基调节白色念珠菌浓度为3×106 CFU/ml。取96孔板,第1列加100 μl RPMI1640培养基做空白对照;第2至12列加100 μl菌液,37 ℃培养90 min。
制备药敏板:分组为CAS、CAS+GMS、CAS+SLNs、CAS−SLNs,每组两行,每孔CAS含量浓度为0.313 μg/ml。按“2.4.1”项下倍比稀释得到不同浓度的CAS。
生物被模板孵育90 min后,弃上清液,用PBS清洗,将药敏板中的CAS按浓度梯度分别加入第2至11列,37 ℃培养24 h。倒掉培养基,PBS清洗生物被膜,加入0.4%结晶紫水溶液染色。倒掉染液并用PBS冲洗,加入酒精脱色后,取适量上清至96孔板,用酶标仪在λ=630 nm处,测A值。生物被膜板可在显微镜下观察被膜形成情况。
2.5 体内抗真菌活性的测定
2.5.1 白色念珠菌系统性感染
选择ICR小鼠雌性,6~8 周龄,小鼠尾静脉注射SC5314。注射剂量为1×105 CFU/只。1 d后处死小鼠,收集肾脏组织进行PAS染色切片。小鼠体重检测:将实验动物分为对照组、CAS组、CAS-SLNs组,每组8只。注射白色念珠菌后,分别尾静脉注射生理盐水、CAS、CAS-SLNs,每只200 μl(0.2 mg/kg)。间隔24 h给药,连续给药3次。给药后连续观察20 d,每天记录小鼠体重(g)。
2.5.2 真菌载菌量测定
实验动物造模后随机分为3组:对照组、CAS组、CAS-SLNs组。模型建立后分别尾静脉注射生理盐水、CAS、CAS-SLNs,每只200 μl(0.2 mg/kg)。感染48 h后处死,将肾脏组织称重后置入PBS中研磨成匀浆,将组织匀浆稀释到合适的倍数,接种到SDA平板上,在30 ℃下培养48 h后进行菌落计数。
2.5.3 组织病理学观察
实验动物分为对照组、CAS组、CAS-SLNs组,模型建立后分别尾静脉注射生理盐水、CAS、CAS-SLNs。感染48 h后处死,并取其肾组织进行PAS染色切片,观察白色念珠菌在组织中的感染情况。
2.6 统计学分析
采用GraphPad Prism 8(GraphPad Software, San Diego, CA)计算。两组间数据的比较采用Unpaired Student’s t-test,多组间的数据比较采用One-way ANOVA。P>0.05表示差异不具有统计学意义,P<0.05表示差异显著,P<0.01表示差异非常显著,P<0.001表示差异极其显著。
3. 结果
3.1 CAS含量测定
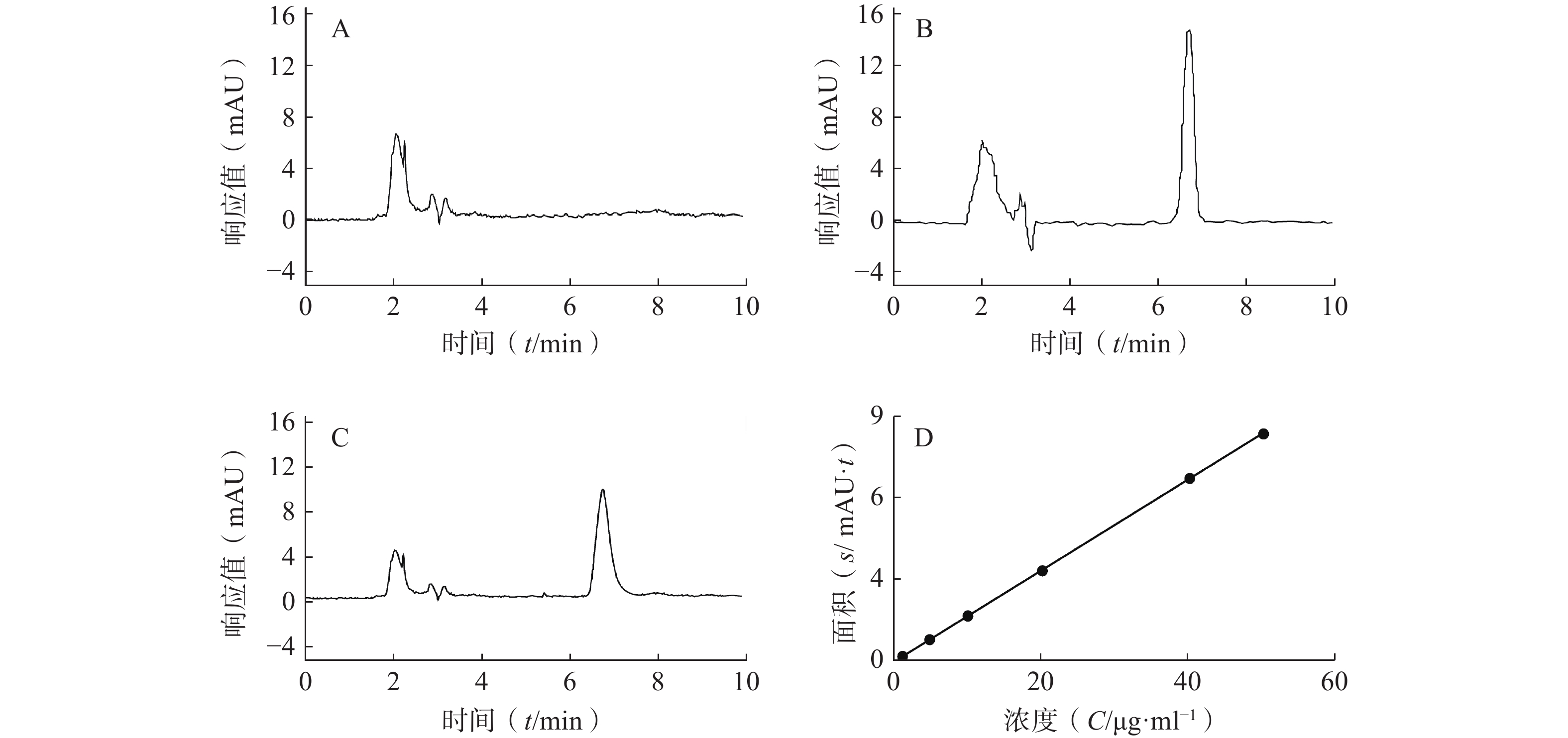
专属性:液相色谱图见图1,CAS出峰位置处无SLNs色谱法干扰,建立方法专属性良好。CAS保留时间为6.8 min,载体对CAS-SLNs测定无干扰。
线性和范围:如图1所示,方法专属性良好,以CAS浓度(C, μg/ml)为横坐标,所测得峰面积(Area)为纵坐标绘制标准曲线,回归方程为A=0.168 7C−
0.038 1 ,R2=0.999 9 ,表明CAS在1~50 μg/ml内线性关系良好。精密度:由表1可知,低、中、高浓度CAS日内精密度和日间精密度RSD值均小于5%,表明所建立方法的精密度满足要求。
表 1 CAS的HPLC方法精密度(Mean±SD, n=3)加样量(μg/ml) 日内精密度 日间精密度 测得量(μg/ml) RSD(%) 测得量(μg/ml) RSD(%) 5 4.79±0.05 1.07 4.79±0.04 0.90 20 19.64±0.17 0.87 19.90±0.26 1.32 40 38.48±0.21 0.55 38.17±0.57 1.49 稳定性:同一样品在12 h以内的RSD为1.88%,表明含量测定供试品溶液的稳定性满足要求。
回收率:由表2可知,样品在低、中、高3个浓度的回收率在95%~115%范围内,且RSD值均小于5%,表明该方法稳定可靠,可用于样品中CAS含量的测定。
表 2 CAS的HPLC方法提取回收率(Mean±SD, n=3)加样量(μg/ml) 测得量(μg/ml) 平均回收率(%) RSD(%) 5 5.29±0.12 105.78±2.41 2.28 20 20.95±0.48 104.76±2.40 2.29 40 43.39±0.59 108.48±1.47 1.35 3.2 CAS-SLNs的表征及包封率
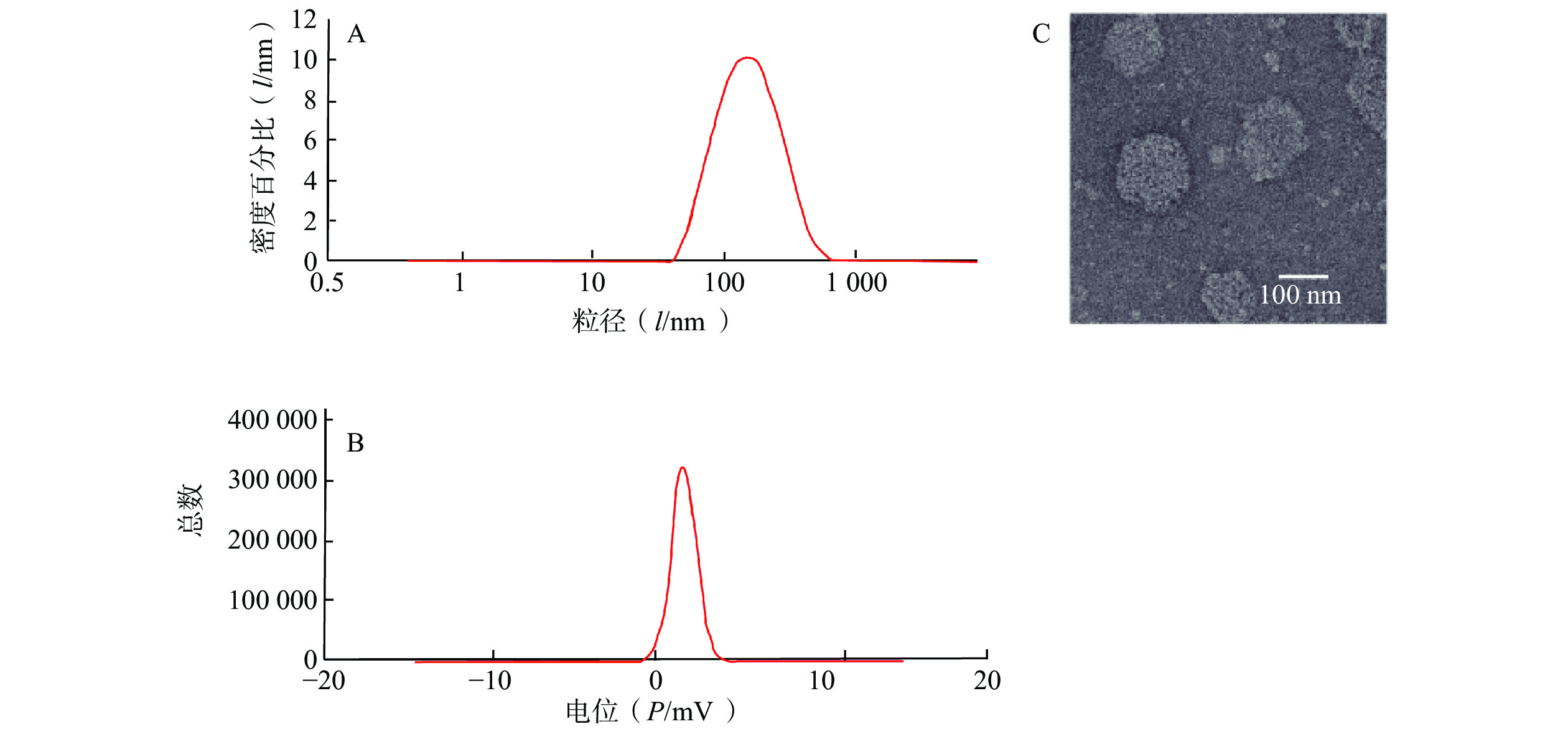
制备CAS-SLNs并对其进行表征。CAS-SLNs的粒径、Zeta电位分别为(135.97±1.73)nm,(19.33±0.37)mV。如图2所示,透射电镜照片显示CAS-SLNs为类圆形粒子,粒径约为120 nm。纳米粒包封率为(67.71±1.74)%,载药量为(7.55±0.68)%。
3.3 CAS-SLNs的体外抑菌效果
3.3.1 CAS-SLNs的最低抑菌浓度(MIC)
前期本课题组研究表明,GMS可以协同CAS抑制白色念珠菌的生长,因此我们比较了CAS-SLNs与CAS单用以及CAS+GMS合用的体外抗真菌活性。
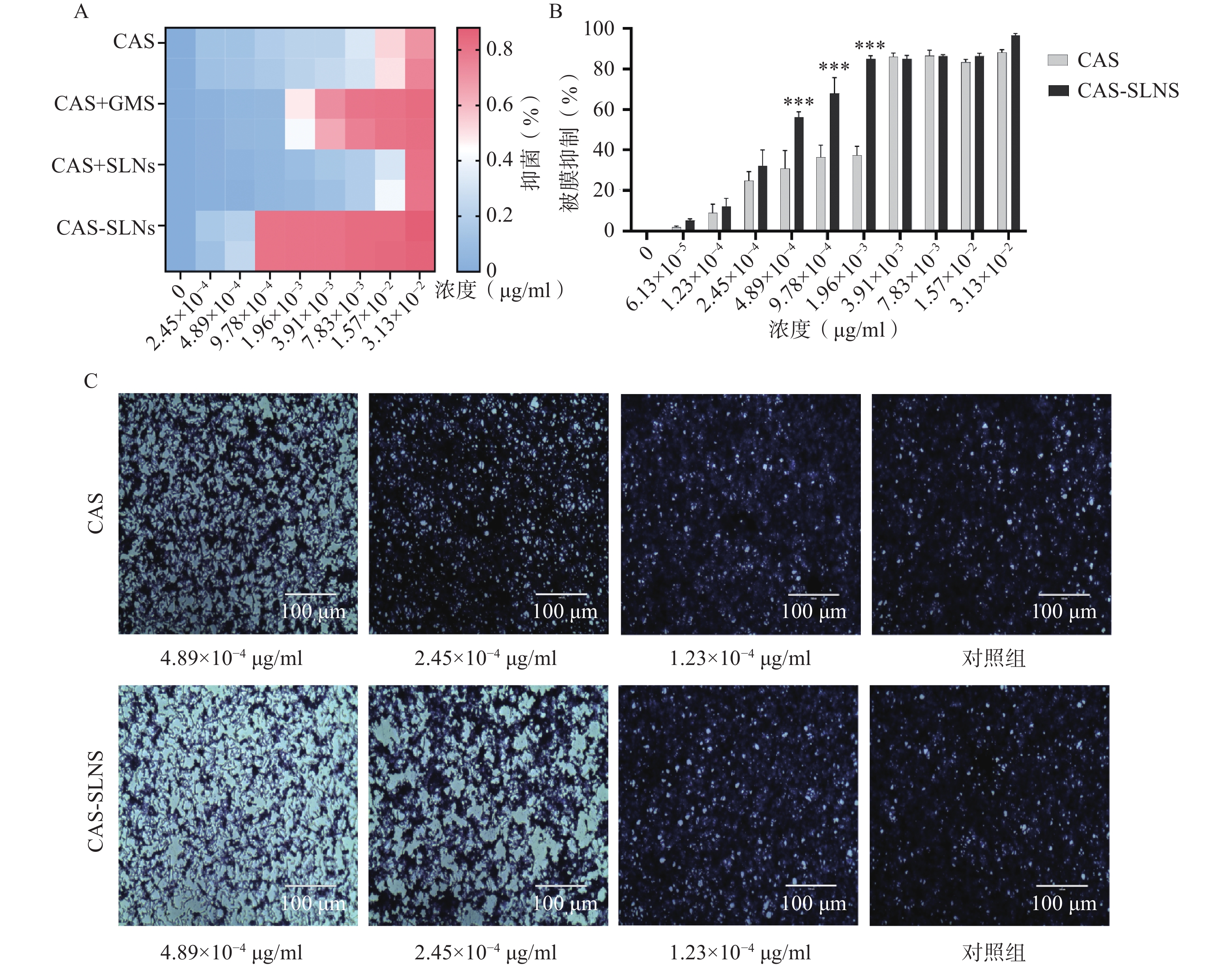
结果如表3所示,与1 μg/ml的GMS合用后,CAS的MIC从3.13×10−2 μg/ml降低到7.83×10−3 μg/ml,白色念珠菌对CAS的敏感性增加了4倍,表明CAS可以协同GMS抑制念珠菌的生长;而本课题制备的CAS-SLNs MIC为9.78×10−4 μg/ml,这与单用CAS的MIC 3.13×10−2 μg/ml相比,活性增强了32倍,这表明CAS-SLNs可以进一步发挥CAS与GMS的协同作用抑制念珠菌的生长,其抑菌活性性优于CAS和GMS物理混合组。
表 3 微量稀释法检测CAS、CAS+GMS、CAS+SLNs、CAS-SLNs抑制白色念珠菌生长的MIC ( μg/ml)菌株名称 CAS CAS+GMS CAS+SLNs CAS-SLNs C. albicans SC5314 3.13×10−2 7.83×10−3 3.13×10−2 9.78×10−4 3.3.2 CAS-SLNs生物被膜活性测定
菌丝态与酵母态混合形成的被膜是白色念珠菌耐药的重要因素,卡泊芬净单用可以显著抑制白色念珠菌被膜的形成,为了探究CAS-SLNs的优效性,采用结晶紫染色法定量检测了各组药物处理后白色念珠菌生物被膜的形成情况。结果如图3显示,CAS组在1.96×10−3、9.78×10−4、4.89×10−4 mg/ml浓度下的被膜形成抑制率分别为(37.30±4.40)%、(36.50±5.78)%、(30.70±8.96)%,CAS-SLNs组在同等的1.96×10−3、9.78×10−4 、4.89×10−4 mg/ml浓度下,被膜形成的抑制率分别为(85.03±1.59)%、(68.05±7.72)%、(56.12±2.83)%。由此可见CAS-SLNs对生物被膜形成的抑制作用与单用CAS相比显著增强。
3.4 CAS-SLNs的体内抑菌效果
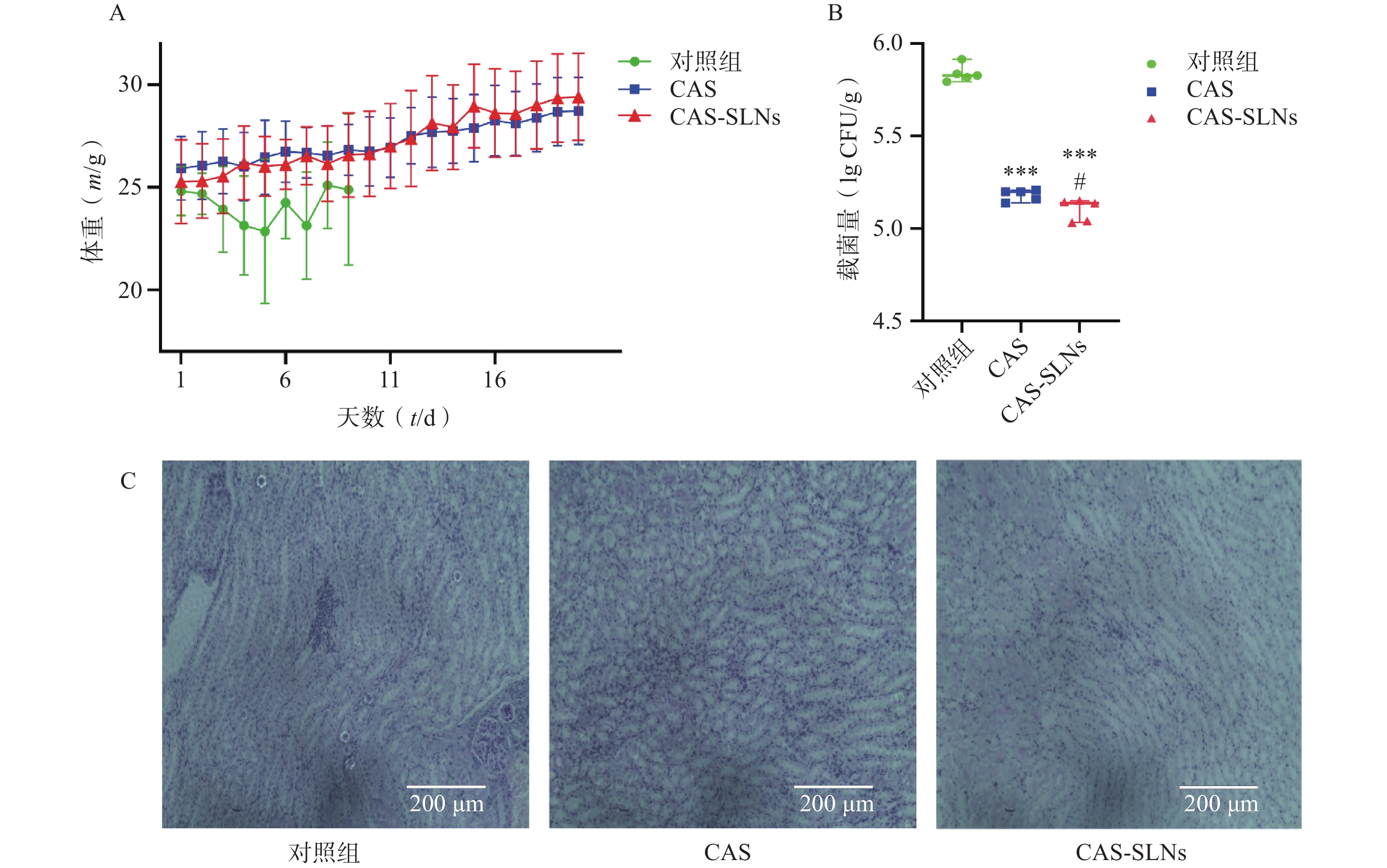
在小鼠系统性白色念珠菌感染模型中,如图4A所示,白色念珠菌感染可以导致小鼠体重的下降,而药物治疗可以恢复小鼠的体重增长。结果显示,CAS组小鼠平均体重由25.93 g增长至28.73 g,增长10.8%;而CAS-SLNs组体重由25.29 g增长至29.43 g,体重增长16.36%;对照组(对照组第10天存活率为0)与CAS-SLNs有非常显著的差异(P<0.01),CAS-SLNs组体重恢复更加显著。此外,CAS-SLNs治疗也可以显著降低小鼠肾脏的载菌量。如图4B所示,对照组、CAS组、CAS-SLNs组的载菌量分别为(5.84±0.05)CFU/g、(5.18±0.03)CFU/g、(5.10±0.06)CFU/g,与对照组肾脏载菌量有极显著差异(P<0.001),CAS-SLNs组与CAS组也有显著性差异(P<0.05)。通过PAS染色,考察小鼠肾脏的白色念珠菌感染情况,如图4C所示,在SC5314感染小鼠48 h后,对照组肾部病理切片经过PAS染色出现大量白色念珠菌。在感染小鼠经过CAS治疗后,白色念珠菌的数量明显下降。而经过同等剂量的CAS-SLNs治疗的感染小鼠肾部组织切片很少发现白色念珠菌的存在。CAS-SLNs作为以GMS为主要材料的载体包载药物CAS,其抗菌效果优于单用CAS,可以在体内发挥CAS与GMS的协同作用,体内抗菌效果显著增强。
4. 讨论
侵袭性真菌感染每年导致超过150万人死亡[13]。由于抗真菌药物耐药性的不断增多,迫切需要新的策略来对抗危及生命的真菌疾病。白念珠菌是念珠菌病的主要病原体,针对念珠菌血症的初始抗真菌治疗,美国传染病学会(IDSA)指南推荐使用棘白菌素类药物[14]。然而,抗真菌药物可能在毒性、感染复发、高成本和出现抗真菌耐药性方面存在局限性,可以采用联合用药的方式克服上述问题[15]。研究结果显示,在替代疗法中同时使用尼可霉素Z和CAS或米卡芬净[16]、以及CAS和氟康唑或伏立康唑的联用可以更好的治疗念珠菌感染[17];此外,宿主防御肽模拟物brilacidin(BRI)也可以作为CAS的增效剂,增强CAS对烟曲霉、白念珠菌、耳念珠菌和固有抗性的新型隐球菌的抗菌活性[18]。我们在前期研究发现CAS与GMS具有较强的协同抗念珠菌活性[8],GMS作为一种惰性的药用辅料,之前已报道过其作为脂质基质制备SLNs发挥协同抗金葡萄球菌和大肠埃希菌的活性[19],但抗真菌活性未有报道。因此,本研究构建了以GMS为主要材料的固体脂质纳米粒作为纳米载体包载CAS。一方面,SLNs骨架材料GMS可以协同CAS发挥抗真菌增效作用,另一方面,本课题所制备的纳米粒为水分散系统,无须有机溶剂,符合临床使用的需要。本研究结果表明CAS-SLNs相对于CAS与GMS物理混合物,MIC从7.83×10−3 μg/ml降低到9.78×10−4 μg/ml,发挥了很好的增效作用,这可能与CAS-SLNs的粒径为纳米级,具有极大的比表面积,容易被真菌摄取有关。在局部微环境中,随着载体基质的降解,药物逐步释放,在局部形成了较长时间的协同抑菌环境,从而增加了药物的抑菌活性。在可能的机制方面,有研究显示,硬脂酸可以激活三酰基甘油合成代谢途径,影响真菌的脂质代谢[20]。而棘白菌素类药物作用于白念珠菌后,白念珠菌脂质代谢的相关基因会发生改变,提示脂质代谢可能在白念珠菌抵御CAS的杀伤过程中十分重要[21]。因此,我们推测CAS-SLNs可能通过改变脂质代谢的途径,提高了CAS的敏感性,具体的信号通路和作用机制需要进一步的通过转录组学、代谢组学等方式深入研究。本研究为后续卡泊芬净的剂型改造提供了新的思路,有望为解决临床卡泊芬净药物治疗成本高的问题提供新的研究方向。
-
[1] DAND N, STUART P E, BOWES J, et al. GWAS meta-analysis of psoriasis identifies new susceptibility alleles impacting disease mechanisms and therapeutic targets[J]. medRxiv, 2023: 2023.10. 04.23296543. [2] KAMATA M, TADA Y. Dendritic cells and macrophages in the pathogenesis of psoriasis[J]. Front Immunol, 2022, 13:941071. doi: 10.3389/fimmu.2022.941071 [3] GRIFFITHS C E M, ARMSTRONG A W, GUDJONSSON J E, et al. Psoriasis[J]. Lancet, 2021, 397(10281):1301-1315. doi: 10.1016/S0140-6736(20)32549-6 [4] ARMSTRONG A W, READ C. Pathophysiology, clinical presentation, and treatment of psoriasis: a review[J]. JAMA, 2020, 323(19):1945-1960. doi: 10.1001/jama.2020.4006 [5] AGARWAL K, DAS A, DAS S, et al. Impact of psoriasis on quality of life[J]. Indian J Dermatol, 2022, 67(4):387-391. doi: 10.4103/ijd.ijd_572_22 [6] ZHANG Q H, XIE J, LI G F, et al. Psoriasis treatment using Indigo Naturalis: Progress and strategy[J]. J Ethnopharmacol, 2022, 297:115522. doi: 10.1016/j.jep.2022.115522 [7] HSIEH T S, TSAI T F. Combination therapy for psoriasis with methotrexate and other oral disease-modifying antirheumatic drugs: a systematic review[J]. Dermatol Ther, 2023, 13(4):891-909. doi: 10.1007/s13555-023-00903-5 [8] KIM M, LEE H J, RANDY A, et al. Stellera chamaejasme and its constituents induce cutaneous wound healing and anti-inflammatory activities[J]. Sci Rep, 2017, 7:42490. doi: 10.1038/srep42490 [9] 顾臣贤, 朱华荣, 王奎龙, 等. 狼毒质量控制研究进展[J]. 中国现代中药, 2014, 16(6):497-504. [10] 刘秀峰, 谢明. 狼毒品种的本草再考证[J]. 中药材, 2017, 40(10):2475-2478. [11] SELENGE T, VIEIRA S F, GENDARAM O, et al. Antioxidant and anti-inflammatory activities of Stellera chamaejasme L. roots and aerial parts extracts[J]. Life, 2023, 13(8):1654. doi: 10.3390/life13081654 [12] WANG L, DUAN H, WANG Y, et al. Inhibitory effects of Lang-du extract on the in vitro and in vivo growth of melanoma cells and its molecular mechanisms of action[J]. Cytotechnology, 2010, 62(4):357-366. doi: 10.1007/s10616-010-9283-z [13] 徐娇, 易立涛, 翁连进, 等. 月腺大戟乙醇提取物的抗痛风活性研究[J]. 中药材, 2014, 37(2):315-317. [14] 王晓瑾, 张建英, 张守亮, 等. 中医药防治银屑病的机制研究进展[J]. 中国实验方剂学杂志, 2022, 28(21):243-253. [15] 胡怡, 武思仙, 刘栋, 等. 中医药调控JAK-STAT通路治疗银屑病的研究进展[J]. 中成药, 2024, 46(2):531-536. doi: 10.3969/j.issn.1001-1528.2024.02.028 [16] 胡和珠拉, 白小红, 阿字亚, 等. 蒙药瑞香狼毒的本草考证及临床应用研究[J]. 中国民族医药杂志, 2024, 30(2):20-24. doi: 10.3969/j.issn.1006-6810.2024.02.008 [17] 李晓惠, 项勋, 唐晓萍, 等. 瑞香狼毒研究进展[J]. 动物医学进展, 2019, 40(4):96-99. doi: 10.3969/j.issn.1007-5038.2019.04.018 [18] JIN H, YANG X Y, YAN Z Q, et al. Characterization of rhizosphere and endophytic bacterial communities from leaves, stems and roots of medicinal Stellera chamaejasme L[J]. Syst Appl Microbiol, 2014, 37(5):376-385. doi: 10.1016/j.syapm.2014.05.001 [19] CHENG Z Y, HOU Z L, REN J X, et al. Guaiane-type sesquiterpenoids from the roots of Stellera chamaejasme L. and their neuroprotective activities[J]. Phytochemistry, 2021, 183:112628. doi: 10.1016/j.phytochem.2020.112628 [20] 周地, 刘丽颖, 周官红, 等. 瑞香狼毒的化学成分研究[J]. 中草药, 2023, 54(1):29-34. doi: 10.7501/j.issn.0253-2670.2023.01.004 [21] 仇立波, 孙忠人, 于佳妮. 狼毒考证集萃[J]. 四川中医, 2012, 30(9):52-54. [22] 于淑娟, 白小梅, 包文双, 等. 蒙药塔日努本草考证及现代研究概述[J]. 中国中医药信息杂志, 2023, 31(5):183-189. [23] 顾子霞, 郭建林, 周义锋, 等. 能源植物潜力种: 甘肃大戟(Euphorbia kansuensis prokh. )的形态和分布研究[J]. 安徽农业科学, 2012, 40(22):11360-11362. doi: 10.3969/j.issn.0517-6611.2012.22.080 [24] 王栋, 周志华, 郭宝凤, 等. 4种大戟科大戟属根类中药的研究进展[J]. 内蒙古医科大学学报, 2022, 44(4):437-441. [25] LIU L, XU Y L, YANG L, et al. Analysis of the mechanism of action of Euphorbia fischeriana Steud on cirrhosis based on network pharmacology[J]. Medicine, 2023, 102(37):e35118. doi: 10.1097/MD.0000000000035118 [26] CHEN G, MA T C, MA Y K, et al. Chemical composition, anti-breast cancer activity and extraction techniques of ent-abietane diterpenoids from Euphorbia fischeriana steud[J]. Molecules, 2022, 27(13):4282. doi: 10.3390/molecules27134282 [27] BAILLY C. Yuexiandajisu diterpenoids from Euphorbia ebracteolata Hayata(Langdu roots): an overview[J]. Phytochemistry, 2023, 213:113784. doi: 10.1016/j.phytochem.2023.113784 -





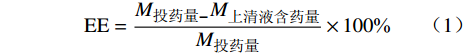

 下载:
下载:
 下载:
下载: