-
患者,男,43岁,强直性脊柱炎7年,未予正规治疗,2018年9月开始注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白(益赛普)皮下注射治疗:第1个月25 mg biw,第2个月25 mg qw,第3个月以后25 mg qow,病情缓解,患者无炎症性肠病的个人或家族史。2019年6月患者无明显诱因出现低热,未予治疗,休息1周后自行好转。7月1日再次出现发热,患者停用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白,最高体温37.5 ℃,无乏力、寒战、盗汗,无腹痛、腹泻、便血,无咳嗽、咳痰,于上海市第七人民医院就诊,血常规:白细胞计数12.50×109/L、中性粒细胞9.94×109/L、中性粒细胞百分比79.5%,予抗炎治疗后退热,之后低热间断出现,复查血常规均提示白细胞、中性粒细胞、C反应蛋白偏高。7月18日于长海医院查下腹部CT:回肠末段管壁增厚伴渗出,与膀胱上臂分界不清,建议进一步检查。患者期间有反复尿频、尿急症状,7月24日于长海医院经肛小肠镜检查示:回盲瓣、小肠多发溃疡(克罗恩病可能),同时活检取病理送检,病理报告回示:(回肠末端)溃疡伴黏膜慢性炎症。7月30日行直肠彩超:直肠腔内可见区域未见明显异常回声;结核感染T细胞斑点试验(TSPOT)阴性;自身抗体谱未见明显异常。8月22日于长海医院行小肠三维CT:回肠多段管壁增厚,管腔狭窄,符合克罗恩病。患者被确诊为克罗恩病(CD),期间予以全肠内营养治疗,发热及尿频、尿急等症状完全消失,一般情况改善。由于在重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白治疗期间开始出现肠道症状,2019年8月20日风湿科会诊,停用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白,在排除机会感染等禁忌后,分别于9月4日、9月22日、10月24日行英夫利西单抗(400 mg静脉滴注)治疗,患者经治疗后临床指标恢复正常,肠道症状明显改善,目前仍继续英夫利西单抗治疗。
-
强直性脊柱炎(AS)患者中有5%~10%伴有炎症性肠病(IBD),约50%的AS患者可有内镜或组织学的肠道炎症表现,且CD比溃疡性结肠炎(UC)更为常见[1]。在对AS患者的随访研究显示,有6%的患者可发展成IBD,而在组织学上有肠道慢性炎症病变的AS患者,15%~25%会发展为临床症状明显的CD[2],而有IBD个人史或家族史的AS患者,接受肿瘤坏死因子-α(TNF-α)受体抗体融合蛋白治疗的患者引起IBD的风险会增加10倍[3]。
-
TNF-α是一种有效的促炎细胞因子,是炎症过程的重要调节因子,包括诱导细胞因子产生,黏附分子表达和促炎细胞活化等[4]。几种自身免疫性TNF-α受体抗体融合蛋白疾病的发病机制包括类风湿关节炎(RA)、强直性脊柱炎(AS)、幼年特发性关节炎(JIA)、IBD,牛皮癣和银屑病关节炎(PsA)都与炎症部位的TNF-α水平明显升高相关[5]。TNF-α抑制剂可以中和TNF-α诱导的信号转导,能够诱导产生TNF-α的免疫细胞的凋亡,并能够减少其他免疫细胞产生的下游炎症相关因子的水平[6]。
TNF-α抑制剂包括单克隆抗体(英夫利昔单抗、阿达木单抗等)、聚乙二醇人源化Fab片段(赛妥珠单抗)、与人IgG1结合的人p75 TNF-α可溶性受体蛋白的重组二聚体(TNF-α受体抗体融合蛋白)[7]。TNF-α受体抗体融合蛋白治疗强直性脊柱炎时,成人推荐剂量为每次25 mg ih biw,每次间隔3~4 d。长期的随访研究证实了TNF-α受体抗体融合蛋白治疗AS的安全性和有效性[8]。
TNF-α抑制剂最常见的不良反应是注射或输注部位的轻度至中度瘙痒、疼痛、肿胀和发红。然而,TNF-α抑制剂还可能诱发多种疾病,包括自身免疫或自身炎症性疾病,包括牛皮癣、化脓性汗腺炎、IBD、葡萄膜炎、结节病和其他肉芽肿性疾病(环状肉芽肿、间质性肉芽肿性皮炎)、肺结节病、血管炎、白癜风和脱发等[7]。
本例患者强制性脊柱炎7年,既往无IBD个人或家族史,尽管AS疾病发展过程中有新发IBD的风险,但TNF-α抑制剂的反常应答也应被认为是触发IBD发病的原因[9]。所有TNF-α抑制剂已被广泛用于AS的治疗。而与单克隆抗体不同,TNF-α受体抗体融合蛋白对IBD无效。英夫利昔单抗与可溶性TNF-α的单体和三聚体结合,而TNF-α受体抗体融合蛋白仅与三聚体结合。前者与可溶性TNF-α形成稳定的复合物,而后者形成相对不稳定的复合物。两者结构差异及与可溶性TNF-α结合特性的差异,使得两者虽可结合并中和可溶性TNF-α,但对表达跨膜TNF-α的细胞(巨噬细胞和T细胞)的清除作用不同,单克隆抗体制剂的清除作用似乎更强[10-11]。这可能是TNF-α受体抗体融合蛋白引起CD的原因,但具体的机制还有待进一步研究。
该患者使用TNF-α受体抗体融合蛋白半年,无其他用药史,无IBD个人史及家族史,与CD之间存在明确的时间关系,同时有TNF-α受体抗体融合蛋白治疗AS期间诱发CD的类似不良反应报道[12],综合分析认为该患者新发CD疑由注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白引起。
-
一项评估风湿性关节炎(主要为AS或相关SpA)患者应用TNF-α抑制剂治疗后新发IBD的研究中,在治疗期间出现新发IBD主要类型为CD(94%),UC则不常见(6%)。大多数(87.5%)出现肠道症状的患者是接受TNF-α受体抗体融合蛋白治疗的。在停用TNF-α抑制剂或改用单克隆抗体药物后,所有报告患者的肠道症状均明显缓解[13]。同时Tolu等[12]分析了2000—2018年间使用TNF-α抑制剂治疗AS期间出现新发IBD病例,几乎所有报告的患者在停止使用TNF-α抑制剂或改用单克隆抗体药物对IBD及AS进行治疗,均得到了令人满意的临床结局。
-
随着生物制剂研究的发展,TNF-α抑制剂已经成为AS及IBD等自身免疫性疾病的主要治疗手段,同时在治疗AS时,与TNF-α抑制剂相关的肠病患者的数量可能将会增加。该病例提示我们,对于AS患者,使用注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白时,应提高警惕,尤其是有IBD病史的患者,在药物使用过程中出现肠道症状时,应进行肠镜检查,保证用药安全。目前该患者换用英夫利西单抗治疗后,取得了较好的疗效。
-
-
关键词:
- 注射用重组人Ⅱ型肿瘤坏死因子受体抗体融合蛋白 /
- 炎症性肠病 /
- 克罗恩病 /
- 强直性脊柱炎 /
- 药物副反应报告系统
-
复方苯海拉明乳膏是由盐酸苯海拉明、醋酸地塞米松、樟脑、薄荷脑等制成,是长海医院院内特色制剂,临床使用多年,主治过敏性皮炎、接触性皮炎及皮肤瘙痒症等皮肤病,疗效显著。原质量标准仅测定醋酸地塞米松含量,对反映药效的盐酸苯海拉明未建立质控方法。本研究建立测定复方苯海拉明乳膏中盐酸苯海拉明含量的HPLC法,为提高复方苯海拉明乳膏的质量控制标准提供参考。
1. 材料
1.1 仪器
岛津高效液相色谱仪(包括LC-20AD泵、SPD-M20A二极管阵列检测器、CBM-20A控制器和LC solution工作站,日本岛津公司),XS205DU 电子天平(瑞士梅特勒-托利多仪器有限公司),DL- 720A 超声波清洗器(上海之信仪器有限公司)等。
1.2 试剂和药品
复方苯海拉明乳膏(规格:20 g:盐酸苯海拉明200 mg与醋酸地塞米松10 mg,长海医院药学部自制,批号:201008、201104、201105);盐酸苯海拉明对照品(含量99.2%,启东东岳药业有限公司,批号:DH-201909101);甲醇为色谱纯,无水乙醇、磷酸均为分析纯,水为蒸馏水。
2. 方法和结果
2.1 色谱条件
色谱柱为ACE5C18S/N-A66766柱(150 mm×4.6 mm,5 µm,英国ACE公司);流动相为甲醇-水-三乙胺(70∶30∶0.67,用磷酸调pH为6.5);流速为1.0 ml/min;柱温为室温;检测波长为230 nm;进样量为20 µl。
2.2 溶液的制备
2.2.1 对照品溶液
精密称取盐酸苯海拉明对照品1.976 g,置100 ml量瓶中,加甲醇适量使溶解并稀释至刻度,摇匀,即得浓度为1.976 mg/ml的盐酸苯海拉明对照品储备液。
2.2.2 供试品溶液
精密称取本品1 g(约相当于盐酸苯海拉明10 mg),置烧杯中,加甲醇约25 ml,置水浴上加热,搅拌,使其溶解,再置冰浴中冷却,滤过,滤液置100 ml量瓶中,同法提取3次,滤液并入量瓶中,用甲醇稀释至刻度,摇匀,得供试品溶液。
2.2.3 阴性对照溶液
按本品处方制备不含盐酸苯海拉明的空白乳膏,再按供试品溶液制备方法制备成阴性对照溶液。
2.3 专属性试验
按照“2.1”项下色谱条件,分别精密吸取对照品溶液、供试品溶液和阴性对照溶液各20 µl进样测定。结果表明,供试品溶液色谱图中,在与对照品溶液色谱图相同的保留时间上有相同的色谱峰,出峰时间为7.8 min, 理论塔板数按盐酸苯海拉明峰计算大于8 000,与相邻峰的分离度大于2.0;而阴性对照品在此处则无色谱峰,说明乳膏基质及其他成分在此色谱条件下对盐酸苯海拉明测定无干扰,表明方法专属性良好,结果见图1。
2.4 标准曲线的制备
精密量取“2.2.1”项下盐酸苯海拉明对照品储备液1.0、2.0、3.0、4.0、5.0 ml分别置50 ml量瓶中,加甲醇稀释至刻度,摇匀,得到系列浓度为39.52、79.04、118.6、158.1、197.6 µg/ml的盐酸苯海拉明对照品溶液。精密吸取对照品系列溶液各20 µl,按照“2.1”项下色谱条件进样,测定峰面积。以峰面积(A)为纵坐标,浓度(C)为横坐标,绘制标准曲线,得到回归方程:A=16 944C+14 047,r=0.999 7。结果表明,盐酸苯海拉明在39.52~197.6 µg/ml范围内线性关系良好。
2.5 精密度试验
2.5.1 日内精密度
精密吸取“2.4”项下浓度为79.04 µg/ml的对照品溶液20 µl,按照“2.1”项下色谱条件连续进样6次,按峰面积计算盐酸苯海拉明的日内精密度为0.82%(n=6)。
2.5.2 日间精密度
精密吸取“2.4”项下浓度为79.04 µg/ml的对照品溶液20 µl,按照“2.1”项下色谱条件每日测定1次,连续测定5 d,记录峰面积,计算日间精密度为1.08%(n=5)。表明仪器精密度良好。
2.6 重复性试验
取同一批号(201008)样品,按“2.2.2”项下方法制备6份供试品溶液,按含量测定方法测定,代入回归方程计算含量,计算得到盐酸苯海拉明的含量为100.2%,RSD为0.78%(n=6),表明方法的重复性良好。
2.7 稳定性试验
按“2.2.2”项下方法制备供试品溶液,分别在0、2、4、6、8 h各进样1次,记录峰面积,计算得到盐酸苯海拉明的RSD为0.59%(n=5),表明供试品溶液在8 h内稳定。
2.8 加样回收率试验
精密称定9份不含盐酸苯海拉明的空白乳膏各1.0 g,置烧杯中,分别加入已知浓度的盐酸苯海拉明对照品适量,加甲醇约25 ml,置水浴上加热,搅拌,使其溶解,再置冰浴中冷却,滤过,滤液置100 ml量瓶中,同法提取3次,滤液并入量瓶中,用甲醇稀释至刻度,摇匀,得相当于标示量的80%、100%、120%的模拟样品各3份,按含量测定方法测定,代入回归方程计算含量,并计算样品的回收率。结果为盐酸苯海拉明的平均回收率100.5%(RSD=0.26%,n=9),见表1。
表 1 复方苯海拉明乳膏加样回收率试验结果 ($ \overline x $ ±s,n=9)加入量(m/mg) 测得量(m/mg) 回收率(%) 平均回收率(%) 7.90 7.92±0.09 100.25±1.08 100.47 9.88 9.92±1.16 100.40±1.17 11.86 11.95±0.19 100.76±1.59 2.9 样品含量测定
取3个批号的复方苯海拉明乳膏,按“2.2.2”项下方法制备供试品溶液,按照“2.1”项下色谱条件分别进样测定,记录峰面积,计算盐酸苯海拉明的含量分别为标示量的101.3%、99.83%和99.62%,结果见表2。
表 2 复方苯海拉明乳膏含量测定结果($ \overline x $ ±s, n=3)批号 含量(mg/g) RSD(%) 201008 10.13±0.11 1.12 201104 9.98±0.15 0.57 201105 9.96±0.22 0.66 3. 讨论
3.1 提取方法的确立
盐酸苯海拉明测定的关键在于样品中盐酸苯海拉明的提取,盐酸苯海拉明在水中极易溶解,在乙醇或三氯甲烷中易溶,熔点为167~171℃。本实验比较了不同溶剂如水、乙醇、甲醇及其混合液对样品溶解效果的影响,结果显示,用水为溶剂时,样品不溶,而采用甲醇作为溶剂提取回收率高,且样品溶液进入色谱系统不会有不溶物质析出。供试品为水包油型乳膏,其基质在常温下并不能充分溶解,本研究采用甲醇水浴加热至80℃左右,使供试品中的基质和盐酸苯海拉明完全溶解,再通过冰浴冷却除去乳膏剂中的基质,减少对盐酸苯海拉明的干扰和色谱柱的污染,从而获得相对理想的结果。
3.2 检测波长的选择
本研究参考相关文献[1-2],将对照品溶液和供试品溶液在200~400 nm进行扫描,结果发现,盐酸苯海拉明对照品在258 nm波长处有最大吸收,但供试品在258 nm波长处受杂质峰的影响较大,而230 nm波长处盐酸苯海拉明不受杂质、辅料和溶剂的干扰,因此选择230 nm作为其检测波长。
3.3 流动相的选择
本研究在测定盐酸苯海拉明时,经文献检索[3-7]和《中华人民共和国药典》[8]的收载,对文献和药典中提到的各种流动相分别进行了考察,结果显示,选用甲醇-水(70:30)作为流动相时,分离度较好,且出峰时间适中,但苯海拉明为碱性药物,色谱峰拖尾严重,加入三乙胺,可有效改善色谱峰峰型。
3.4 检测方法的选择
本实验旨在对原有质量标准进行提升,原质量标准中已有醋酸地塞米松含量的测定方法,故本实验仅考察盐酸苯海拉明的含量测定方法。
-
[1] RUDWALEIT M, BAETEN D. Ankylosing spondylitis and bowel disease[J]. Best Pract Res Clin Rheumatol,2006,20(3):451-471. doi: 10.1016/j.berh.2006.03.010 [2] SMALE S, NATT R S, ORCHARD T R, et al. Inflammatory bowel disease and spondylarthropathy[J]. Arthritis Rheum,2001,44(12):2728-2736. doi: 10.1002/1529-0131(200112)44:12<2728::AID-ART459>3.0.CO;2-8 [3] BRAUN J, BARALIAKOS X, LISTING J, et al. Differences in the incidence of flares or new onset of inflammatory bowel diseases in patients with ankylosing spondylitis exposed to therapy with anti-tumor necrosis factor alpha agents[J]. Arthritis Rheum,2007,57(4):639-647. doi: 10.1002/art.22669 [4] MOUDGIL K D, CHOUBEY D. Cytokines in autoimmunity: role in induction, regulation, and treatment[J]. J Interferon Cytokine Res,2011,31(10):695-703. doi: 10.1089/jir.2011.0065 [5] LI P, ZHENG Y, CHEN X. Drugs for autoimmune inflammatory diseases: from small molecule compounds to anti-TNF biologics[J]. Front Pharmacol,2017,8:460. doi: 10.3389/fphar.2017.00460 [6] NIELSEN O H, AINSWORTH M A. Tumor necrosis factor inhibitors for inflammatory bowel disease[J]. N Engl J Med,2013,369(8):754-762. doi: 10.1056/NEJMct1209614 [7] TOUSSIROT É, AUBIN F. Paradoxical reactions under TNF-α blocking agents and other biological agents given for chronic immune-mediated diseases: an analytical and comprehensive overview[J]. RMD Open,2016,2(2):e000239. doi: 10.1136/rmdopen-2015-000239 [8] BRANDT J, LISTING J, HAIBEL H, et al. Long-term efficacy and safety of etanercept after readministration in patients with active ankylosing spondylitis[J]. Rheumatology (Oxford),2005,44(3):342-348. doi: 10.1093/rheumatology/keh475 [9] ÜSKÜDAR CANSU D, ÜSKÜDAR TEKE H, TEMEL T, et al. Do anti-TNF agents increase the risk of inflammatory bowel disease evolution in patients with ankylosing spondylitis? real life data[J]. J Natl Med Assoc,2019,111(3):262-269. doi: 10.1016/j.jnma.2018.10.003 [10] HORIUCHI T, MITOMA H, HARASHIMA S, et al. Transmembrane TNF-alpha: structure, function and interaction with anti-TNF agents[J]. Rheumatology (Oxford),2010,49(7):1215-1228. doi: 10.1093/rheumatology/keq031 [11] SCALLON B, CAI A, SOLOWSKI N, et al. Binding and functional comparisons of two types of tumor necrosis factor antagonists[J]. J Pharmacol Exp Ther,2002,301(2):418-426. doi: 10.1124/jpet.301.2.418 [12] TOLU S, REZVANI A, HINDIOGLU N, et al. Etanercept-induced Crohn's disease in ankylosing spondylitis: a case report and review of the literature[J]. Rheumatol Int,2018,38(11):2157-2162. doi: 10.1007/s00296-018-4165-3 [13] TOUSSIROT É, HOUVENAGEL É, GOËB V, et al. Development of inflammatory bowel disease during anti-TNF-α therapy for inflammatory rheumatic disease: a nationwide series[J]. Joint Bone Spine,2012,79(5):457-463. doi: 10.1016/j.jbspin.2011.10.001 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 6922
- HTML全文浏览量: 1981
- PDF下载量: 44
- 被引次数: 0





 下载:
下载:
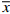
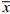

 下载:
下载:
