-
晕动病(motion sickness,MS)是因外界异常运动刺激引起的一系列生理反应,包括恶心、呕吐、冷汗、头晕等症状。人们日常生活出行乘坐飞机、船舶、汽车等交通工具过程中,晕动病时有发生,影响了人们正常的生活和工作。对海军部队而言,晕动病也是制约海军部队战斗力的因素之一[4]。研发和应用疗效好、副作用小的抗晕动病药物具有积极意义。
对于晕动病的防治策略包括药物干预和非药物干预手段。
-
目前,抗胆碱能药物和抗组胺药物是最有效的晕动病预防剂。其他晕动病干预药物包括多巴胺受体拮抗剂和5-羟色胺受体激动剂等。此外,生姜、丹参等中药对晕动病也具有防治作用。
-
抗胆碱能药物主要包括东莨菪碱、盐酸苯环壬酯、阿托品、山莨菪碱、苯海索等。东莨菪碱是最经典的抗胆碱能药物,是非选择性毒蕈碱型胆碱能受体(mAChR)拮抗剂。然而,东莨菪碱会引起嗜睡、视物模糊或头晕等不良反应。改变药物剂型,使用经皮给药方式给予东莨菪碱,可以在起到长效预防效果的同时,避免精神运动受到损伤[2-3]。盐酸苯环壬酯是原军事医学科学院研发的新一代高选择性中枢抗胆碱能Ⅰ类新药。经过于瑞起等的动物实验,证实了其药效与东莨菪碱相当,且中枢抑制作用弱(仅为前者的1/4),显著降低了嗜睡的副作用,是一种高效、安全的晕动病防治药物[4-5]。将盐酸苯环壬酯做成片剂后,防晕车、晕船的总有效率可达80%以上[6]。然而,盐酸苯环壬酯具有半衰期短(药效只能维持4~5 h)、体内血药浓度波动大、易发生不良反应或治疗失效等问题。目前有课题组正在进行剂型改进,将盐酸苯环壬酯制成缓控释片,延长抗晕、止吐、防治晕动病的时间,充分满足长时程的用药需要[7-8]。
-
抗组胺药物主要包括乙醇胺类(茶苯海明、苯海拉明)、哌嗪类(赛克力嗪、布克利嗪、美克洛嗪)、烃胺类(氯苯那敏)和吩噻嗪类(异丙嗪)等。其主要剂型包括口服制剂(全部)、肌肉注射剂(异丙嗪和环丙嗪)、栓剂(异丙嗪)和舌下制剂(苯海拉明)[9]。组胺能提高半规管传入神经的放电频率,组胺H1受体拮抗剂可以拮抗这种作用,进而起到抗晕的效果[10]。生理学研究表明,茶苯海明、桂利嗪和氯苯甲嗪作用于组胺H1和H2受体高密度分布的内侧前庭核,异丙嗪则对整个前庭系统具有抑制作用[11]。但是抗组胺类药物对中枢活性强[1],有明显的中枢抑制作用,会引起困倦、嗜睡等副作用。因此,该类药物的应用受到限制。
-
Drummond等的研究报告显示,晕动病可能是由于脑内5-羟色胺水平降低所致[12]。Furman等研究表明,5-羟色胺1B/1D型受体(5-HT1B/1D)激动剂利扎曲普坦能够通过影响血清素能前庭自主神经投射,减弱内耳前庭相关的晕动病[13]。而昂丹司琼和格拉司琼作为5-羟色胺3型受体(5-HT3)拮抗剂,虽然也属于高效的止吐药,可以预防化疗或麻醉引起的恶心、呕吐等症状,但是有证据表明5-羟色胺3型受体拮抗剂针对晕船或实验诱发的晕动病并未显示出预防效果[11]。
-
药物联用是提高晕动病防治药物药效、减少不良反应的有效策略之一。Wood等研究发现,麻黄碱与东莨菪碱合用比东莨胆碱单用的药效提升了32%[14]。Makowski等报道东莨菪碱与右旋苯丙胺的合用可以减缓晕动病的发生[15],并且能减弱东莨菪碱的中枢抑制作用。Huang等报道异丙嗪和咖啡因的联合疗法可有效治疗晕动病,并抵消单独使用异丙嗪可能造成的不良反应[16]。苯海拉明与咖啡因联用,可以在发挥苯海拉明抗晕动病效果的同时,有效减轻苯海拉明中枢抑制的不良作用。目前,笔者所在团队正在研究的复方已经进入临床前研究阶段。
-
根据中医理论,髓海不足是晕动病发病的内因,气血亏虚及痰浊中阻,是发病之本;而旋转、摇摆、颠簸等为外因。《金匮要略》中的著名方剂小半夏汤适用于晕动病的治疗[17]。生姜具有温中止吐,化痰止咳功效[。已经有多项研究验证生姜的止吐作用,其对晕动病导致的呕吐反应亦有缓解作用,且目前尚未发现明显的副作用[18-19]。丹参含有丹参酮、维生素E等脂溶性成分和丹参酸等水溶性成分[20],具有较好的血管扩张作用, 可以改善外周循环障碍,减轻头晕症状,达到抗晕效果。生姜、丹参成为被普遍看好的抗晕动病药物[21]。原军事医学科学院董俊兴教授牵头研制具有抗晕止吐功效的生姜酚类提取物软胶囊,即采用超临界CO2流体萃取获得生姜酚类提取物,并进一步制备抗运动病作用强、副作用小、剂型稳定的姜素胶丸[22-23]。
-
习服是最有效的非药物干预手段。此外,还可以利用透视显示、衰减视觉输入、皮肤神经电刺激、替代性干预和改进交通工具等措施缓解晕动病。
-
重复或持续的刺激会导致大多数人出现晕动反应,习服是缓解晕动病最有效的疗法之一[24-25]。习服是指机体长时间主动或者被动接受晕动刺激所产生的应答反应,是个体适应环境的表现形式。晕动刺激的持续施加,促使个体出现由平衡破坏到重建,再到适应的变化过程。这个变化过程分为3个阶段:①初级阶段,个体受到晕动刺激;②相对恢复阶段,个体承受一段晕动刺激后生理机能稳态破坏,发生一系列不适应答变化,随后调整恢复至原始水平;③超量恢复阶段,经过一段时间的调整后,机体抗晕动的能力恢复甚至超过初始阶段。在上述过程中,如果晕动负荷刺激不持续,个体抗晕动的能力降到原有水平,即达到复原阶段。晕动习服的过程是指前3个阶段的交替进行[26]。
习服策略对于晕动病的干预,可以通过感觉冲突理论来解释:在产生感官冲突,引起晕动病的情况下,大脑会存储冲突并且进行适应性改变,从而使感官冲突成为我们“接触史”的一部分。相同状况重现时,大脑的预期与收到的感觉信息之间的冲突就会降低。因此,一段时间后,晕动病状况得到缓解或不再出现[27]。然而,通常情况下,获得特定习服的刺激条件是差异化的。表现出晕动病症状的群体中,至少有5%无法出现习服状态,需采用其他方式(例如透视显示装置、衰减视觉输入等)进行干预[24]。
-
在Krueger的研究中,受试者佩戴简单易用的透视显示装置,利用视觉固定目标与稳定的人造视野相结合,使之与受试者的运动保持一致。研究结果表明,透视显示装置可以使晕动病的持续时间减少,显著缩短从晕动状态恢复到正常状态的时间。与此同时,佩戴透视显示装置可以控制晕动病导致的空间定向障碍,并增强前庭功能恢复的能力[28]。
-
感官冲突理论指出,传入感觉(例如视觉和前庭感觉)的相互矛盾是导致晕动病发生的可能原因。因此,衰减视觉的输入可以减少感官冲突,从而缓解晕动病症状。Ishak的视觉输入衰减实验阐明,佩戴遮光护目镜以阻挡光线进入眼部,能够延迟晕动病的发作时间,并减弱症状的严重程度[29]。
-
经皮电神经刺激(TENS)是一种用于控制疼痛的方法,可通过自主神经系统反射影响心血管反应,并增强运动功能、视觉空间功能、姿势控制功能和认知功能。Chu等发现,使用TENS干预的方法,以100 Hz的脉冲频率刺激颈项后中线区和足三里穴位20 min后,晕动病的严重程度显著降低,受试者能够更好地集中注意力,并且在认知测试中显示出更少的错误。因此,TENS被视为一种减轻晕动病症状的有效方法[30]。
-
某些具有安慰性的替代方法也可以缓解晕动病。食用维生素C、使用安慰剂并给予积极的期望、播放悦耳的音乐或释放令人愉悦的气味等,都可以对晕动病治疗产生相当显著的安慰作用[31-35]。需要注意的是,对于许多替代性干预措施,虽然安慰作用本身足以起到有益效果,但是尚无真正的前瞻性对照临床研究来判断其真正疗效。
-
悬架系统是汽车的重要组成部分,能够一定程度上控制车身震动,减少相对位置变化[36]。主动悬架系统通过外加动力进一步有效减弱波动对乘客的传递[37]。Dizio等的研究指出,在0.8~8 Hz的震动频率下,主动悬挂系统能够减弱前庭眼反射对视觉的抑制作用,从而减少晕动病的产生[38]。这为进一步优化汽车、船舶、飞机的设计以减少晕动病发作频率和强度提供了理论基础。
-
随着现代人生活方式的改变,人们的出行依赖于汽车等交通工具,晕动病对人们生活工作的影响日益突显。晕动病也是海军面临的重要问题,是造成海军非战斗减员的重要因素[1]。对晕动病防治的研究未来有以下几个方向:其一,应通过改进药物化学结构或剂型,研发强效、长效且不良反应较低的抗晕动病药物;其二,在非药物干预手段方面,应加强优化已有的手段和寻找新的干预手段,例如,探索最适合的习服周期、习服强度和优化习服所用的器械等;其三,应致力于寻找新的抗晕动病药物靶点。期待随着抗晕动病研究的不断深入,新药和新装备不断出现,人们最终免受晕动病的困扰。
Advances in prevention and treatment for motion sickness
-
摘要: 晕动病是指人体在外界异常运动的刺激下,机体的一系列生理反应。随着科技的发展,越来越多的人选择乘坐快速运动的交通工具出行,因此晕动病的发生越来越多。目前已有大量药物及非药物干预手段应用于晕动病的治疗。该文对已经报道的晕动病的预防和治疗方法进行综述,以期为此类药物研发提供新思路。Abstract: Motion sickness is a series of physiological responses in human being caused by abnormal movement stimulation. With the development of science and technology, a growing number of people choose to travel by high speed vehicles. Motion sickness happens more frequently. A large number of non-drug and drug intervention methods have been reported in the treatment of motion sickness. This article provides an overview on the research developments in the prevention and treatment of motion sickness in order to provide new ideas for drug research.
-
Key words:
- motion sickness /
- prevention /
- treatment
-
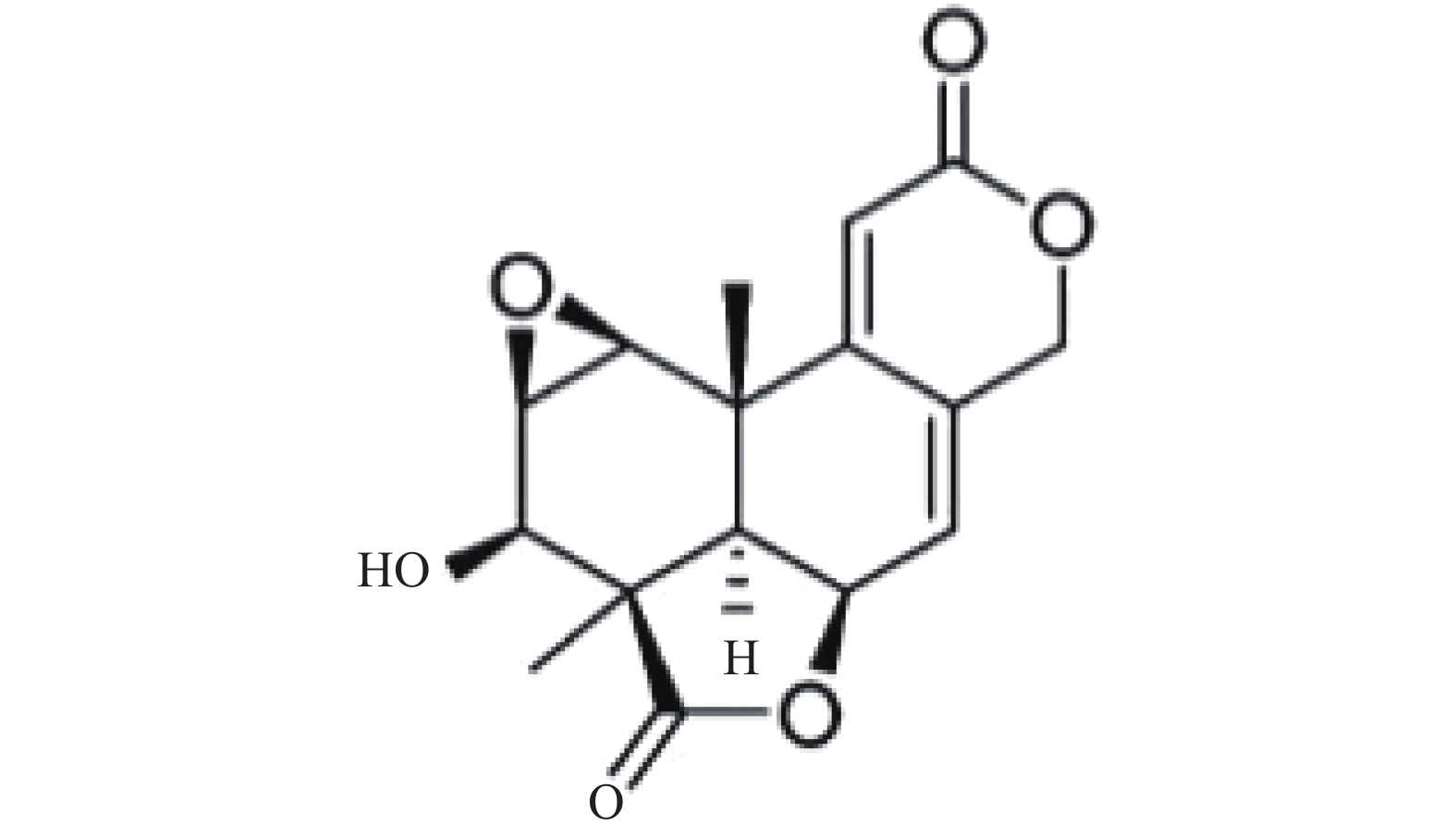
Wentilactone A(WA)是从海洋微生物中分离得到的去甲二萜类小分子化合物,对小细胞肺癌细胞系NCI-H460和NCI-H446细胞的增殖具有抑制作用,可诱导小细胞肺癌细胞系NCI-H446和NCT-H1688细胞凋亡[1]。对小细胞肺癌细胞系NCT-H1688细胞的细胞迁移和集落形成具有抑制作用[2]。WA作为一种有效抗肿瘤候选物,已从制备工艺、理化性质、急性毒性、生殖毒性等方面证明其良好的成药性[3]。遗传毒性安全性实验更是对其临床前研究全面性的补充,为提高临床用药的安全性,为了验证其是否具有遗传毒性,本实验应用微生物回复突变试验(Ames试验)、体外培养CHO细胞染色体畸变试验和小鼠骨髓微核试验方法对WA的遗传毒性进行了系统的研究,为WA的临床前毒性评价提供资料[4]。
1. 材料与方法
1.1 材料
1.1.1 化合物WA
Ames试验用WA(含量:99.9%,批号:20121115,黄色粉末)、体外培养CHO细胞染色体畸变试验用(规格:10 ml,含量:50.8 mg/ml,批号:20130506,黄色澄明溶液)、小鼠骨髓微核试验用WA(规格:10 ml/支:100mg,含量:10.2 mg/ml,批号:20130407,黄色澄明溶液),均由海军军医大学基础医学院生物化学与分子生物学教研室提供。WA的化学结构见图1。
1.1.2 菌株
组氨酸缺陷型鼠伤寒沙门菌(S. typhimurium)TA97、TA98、TA100、TA102和TA1535共5支菌株,复旦大学公共卫生学院环境卫生教研室赠予。实验前对其进行鉴定(R因子和自发回变数鉴定),均符合规定标准。
1.1.3 细胞
中国仓鼠卵巢(CHO)细胞由复旦大学公共卫生学院毒理教研室赠予。
1.1.4 动物
ICR小鼠(SPF级)共60只,每组10只,雌雄各半,5~6周龄,购入时体重16.5~20.8 g,由上海西普尔-必凯实验动物有限公司提供,动物质量合格证号:2008001629237。自购入起3天进行检疫,给药时体重20.3~23.6 g。
1.2 试验方法
按《新药(西药)临床前研究指导原则汇编》[5-6]的设计要求,分别应用Ames试验[7]、体外培养CHO细胞染色体畸变试验[8]和小鼠骨髓微核试验[9]检测WA的遗传毒性。检测终点覆盖了基因突变、染色体畸变和细胞有丝分裂异常。
1.3 实验步骤
1.3.1 Ames实验
根据《药物遗传毒性研究技术指导原则》的要求,应用S. typhimurium TA97、TA98、TA100、TA102和TA1535共5支菌株,设每皿5 000、500、50、5、0.5 μg 5个剂量组。此外,设空白对照、溶剂对照和阳性对照组(具体剂量见表1)。采用标准平板掺入法,使细菌在加和不加代谢活化系统S9的条件下接触受试物,每皿均加入供试品或溶剂对照DMSO 0.1 ml,每个剂量组及对照组均设3个平行皿。并用最低极限的琼脂培养基培养48 h后,先用显微镜观察平皿上的菌苔生长情况,确定受试物无明显的抑菌或杀菌作用,再人工计数每皿回复突变的菌落数,记录原始数据,并计算每组的均值和标准差,与溶剂对照组进行比较,重复实验一次。
表 1 阳性对照品名称及浓度组别 菌株 阳性对照品 溶液终浓度(μg/皿) 加入量(μl/皿) 浓度(μg/ml) -S9组 TA97 敌克松 50 100 500 TA98 敌克松 50 100 500 TA100 甲基磺酸甲酯 1 100 10 TA102 甲基磺酸甲酯 1 100 10 TA1535 4-硝基喹啉-N-氧化物 0.5 100 5 +S9组 TA97 2-氨基芴 10 100 100 TA98 2-氨基芴 10 100 100 TA100 2-氨基芴 10 100 100 TA102 1,8-二羟基蒽醌 50 100 500 TA1535 环磷酰胺 50 100 500 1.3.2 染色体畸变试验
在加和不加代谢活化系统S9的条件下,体外培养的CHO细胞中加入相应浓度的供试品或对照品,反应体系总体积为10 ml。低、中、高剂量组供试品终浓度分别为23.74、47.48和94.96 μg/ml,阳性对照组丝裂霉素C和环磷酰胺的终浓度分别为0.5 μg/ml、60 μg/ml,另设溶剂对照组分别作用于细胞4 h后换液继续培养至24 h,和药物作用细胞24 h后收集细胞。收获细胞前4 h,加入终浓度0.2 μg/ml秋水仙素,培养结束收集细胞,经离心、低渗处理、固定、离心、制片和Giemsa染色,每个剂量组制备2~3张玻片标本。
镜检时每组观察200个染色体中分散良好、数目完整的中期分裂相细胞(若观察到大量染色体畸变细胞,如阳性对照组,分析细胞数可相应减少为至少100个细胞)。计数染色体或染色单体的断裂、缺失及其他类型结构异常的数目(裂隙和核内复制一般不作为畸变类型),记录原始数据计算畸变率。
1.3.3 小鼠骨髓微核实验
检疫期结束后分别按低、中、高组小鼠给药,分别予100、200、400 mg/kg剂量给药,其中高剂量组设两组分别在药物作用24 h和48 h后处死,并设阳性对照组和溶剂对照组。分别在药物作用24 h和48 h后处死小鼠,取股骨骨髓制成骨髓涂片,每只动物制2张涂片,经甲醇固定后用pH6.8的Giemsa染液染色。
每只动物镜检约2000个骨髓嗜多染红细胞(PCE),计数含微核的PCE数(MNPCE),计算微核发生率,同时记录200个PCE计数过程中观察到的正染红细胞(NCE)的数目,并计算PCE/NCE值。
1.4 剂量设计
对于易溶无毒的化合物,细菌实验最高浓度应达到5 mg/皿[10]。Ames试验设每皿5 000、500、50、5、0.5 μg 5个剂量组,每皿均加入相应浓度的供试品溶液0.1 ml,另设空白对照、溶剂对照和阳性对照。在哺乳动物细胞体外遗传实验中,毒性水平应高于50%细胞抑制率或细胞融合率[11]。通过预实验确定供试品的IC50为94.96 μg/ml。染色体畸变试验的低、中、高剂量组为23.74、47.48和94.96 μg/ml,试验时在10 ml的试验体系中分别加入0.1 ml各剂量组的应用液,另设阳性对照组和溶剂对照。ICR小鼠的微核试验采用小鼠经尾静脉注射给药,总剂量分别为100、200、400 mg/kg(单次给药剂量分别为50、100、200 mg/kg,分上、下午两次经尾静脉注射给药),给药容积为20 ml/kg体重;同时设阳性对照组和溶剂对照组。阳性对照组以40 mg/kg体重的剂量腹腔注射环磷酰胺,给药容量为10 ml/kg体重;溶剂对照组给药方式与受试物组相同,以20 ml/kg体重的容积经尾静脉注射生理盐水。
1.5 统计方法
Ames试验结果的评价是以溶剂对照组的回复突变菌落数为基础,与受试物各剂量组相比较。若某剂量组回复突变菌落数为溶剂对照组的2倍以上,呈现可重复性,并在一定的剂量范围内存在着剂量-反应关系,则判断为阳性[12]。染色体畸变试验和小鼠骨髓微核试验均采用卡方检验或方差分析方法研究给药组与对照组之间是否具有统计学意义[13]。
2. 结果与分析
2.1 Ames试验结果
受试物各剂量组和对照组的平皿均可见背景菌苔生长。5支菌株的自发回复突变菌落数以及阳性对照品诱发的回复突变菌落数均在历史参考范围内,并且各菌株阳性对照组的回复突变菌落与空白对照组相比数目显著增加,提示本试验系统符合要求。在最高剂量已达到5 000 μg/皿的受试条件下,未观察到受试物的抑菌现象。各剂量组受试物在加或不加S9时对TA97、TA98、TA100、TA102和TA1535所诱发的回复突变菌落数均与自发的突变菌落数相近,未观察到明显的剂量-反应关系。结果见表2和表3。
表 2 WA对5支菌株的回变菌落数试验结果(个/皿,${\rm{\bar x}}$ ±s)(第1次)组别(μg/皿) TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 36±5 40±4 21±3 21±2 131±26 93±17 177±21 185±25 25±3 14±2 500 36±5 39±8 17±4 20±3 114±22 90±23 195±8 207±7 23±1 19±1 50 39±10 35±5 21±7 21±3 115±21 97±8 196±33 179±18 19±8 16±4 5 41±6 40±3 21±5 22±4 114±15 87±19 195±21 193±8 19±2 14±1 0.5 37±6 39±3 20±3 19±3 128±15 91±12 201±14 205±14 20±6 16±4 空白对照组 40±7 36±5 17±2 19±4 99±17 89±9 213±30 197±34 21±7 19±4 溶剂对照组 40±6 34±1 22±5 26±2 95±8 89±9 193±8 199±29 23±3 14±1 阳性对照组 839±24 841±47 936±56 1 077±55 968±27 1 111±66 1 101±17 1 024±53 342±44 345±13 表 3 WA对5支菌株的回变菌落数试验结果(个/皿,${\rm{\bar x}}$ ±s)(第2次)组别(μg/皿) TA97 TA98 TA100 TA102 TA1535 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 +S9 -S9 5 000 38±5 34±5 20±5 21±5 128±24 105±26 179±21 189±19 20±4 20±3 500 39±7 34±3 21±2 20±7 108±13 92±28 192±16 187±30 16±3 19±4 50 38±9 30±3 19±3 18±1 117±14 102±5 197±5 196±22 17±3 18±1 5 37±8 29±4 18±2 17±1 111±5 98±33 206±24 191±21 16±1 20±2 0.5 35±6 33±8 24±2 23±3 107±7 97±8 203±6 193±10 15±4 15±4 空白对照组 38±3 41±4 22±3 23±4 96±12 93±8 205±17 186±19 18±2 18±4 溶剂对照组 38±3 37±8 22±3 23±4 98±7 100±12 202±15 197±10 18±2 19±4 阳性对照组 881±18 876±35 900±11 1 077±111 964±113 996±8 1 024±37 1 011±8 392±8 392±22 2.2 染色体畸变试验结果
染色体分析结果显示,阳性对照组能够诱发受试细胞染色体的畸变率明显增高,24 h在+ S9和-S9的情况下染色体畸变率分别为11%和11%,与溶剂对照组相比,均有统计学差异(P<0.05);23.74、47.48和94.96 μg/ml受试物在24 h、+S9条件下染色体畸变率分别为1%、1%和0.5%,24 h、-S9条件下染色体畸变率分别为0%、0.5%和0%;4 h、-S9条件下染色体畸变率分别为0%、0%和0%。综上,受试物各剂量组细胞染色体畸变率均小于5%,与溶剂对照组结果相比,其差异均无统计学意义(P>0.05)。结果见表4~6。
表 4 WA对24 h体外培养CHO细胞的染色体畸变试验结果(+S9)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 1 1 0 0 0 0 0 1 2 1 47.48 μg/ml 200 2 2 0 0 0 0 0 0 2 1 94.96 μg/ml 200 0 0 0 0 0 0 0 0 1 0.5 溶剂对照组 200 200 0 0 0 0 0 3 3 3 1.5 阳性对照组 100 9 0 0 1 3 3 0 0 14 14 注:阳性对照组:+S9、环磷酰胺(60 mg/ml);溶剂对照组:DMSO;* P<0.05,与溶剂对照组比较。 表 5 WA对24 h体外培养CHO细胞的染色体畸变试验结果(-S9)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 0 0 0 0 0 0 0 0 0 0 47.48 μg/ml 200 1 0 0 0 0 0 0 0 1 0.5 94.96 μg/ml 200 0 0 0 0 0 0 0 0 0 0 溶剂对照组 200 0 0 0 0 0 0 0 0 0 0 阳性对照组 100 4 4 0 0 0 0 4 0 12 12* 注:阳性对照组:-S9、丝裂霉素C(0.5 mg/ml);溶剂对照组:DMSO;*P<0.05,与溶剂对照组比较。 表 6 WA对4 h体外培养CHO细胞的染色体畸变试验结果(-S9/4 h)组别 观察细胞数
(个)各类染色体畸变数 畸变细胞数
(个)畸变率
(%)断裂 断片 双着丝粒 三辐体 四辐体 碎片或微小体 环状 多倍体 23.74 μg/ml 200 0 0 0 0 0 0 0 0 0 0 47.48 μg/ml 200 0 0 0 0 0 0 0 0 0 0 94.96 μg/ml 200 0 0 0 0 0 0 0 0 0 0 溶剂对照组 200 阳性对照组 * P<0.05,与溶剂对照组比较。 2.3 小鼠骨髓微核试验的结果
试验结果经统计学分析表明,WA在100、200、400 mg/kg剂量下未观察到对小鼠骨髓的抑制作用,溶媒对照组和阳性对照组雌、雄性小鼠骨髓PCE微核发生率分别为2.10‰和21.36‰、1.90‰和20.88‰,两组相比差异均有统计学意义(P<0.05),验证了本次试验系统的有效性。WA 100和2 000 mg/kg剂量24 h采样组雌、雄小鼠骨髓PCE微核率分别为1.60‰和1.80‰、1.90‰和1.60‰;400 mg/kg剂量24 h和48 h采样组雌、雄小鼠骨髓PCE微核率分别为2.10‰和2.80‰、2.40‰和1.29‰,与溶媒对照组相比均无显著差异(P>0.05)。结果见表7。
表 7 WA对小鼠骨髓嗜多染红细胞的微核效应试验结果组别 性别 动物数(只) 观察PCE数(个) PCE/NCE(${\rm{\bar x}}$±s) 微核率(${\rm{\bar x}}$±s, ‰) 100 mg/kg 雌 5 10 020 2.40±0.89 1.60±0.96 200 mg/kg 雌 5 10 010 1.63±0.40 1.80±1.31 400 mg/kg (24 h采样) 雌 5 10 016 1.95±0.40 2.10±1.20 400 mg/kg (48 h采样) 雌 5 10 009 1.58±0.44 2.80±1.81 溶媒对照组 雌 5 10 009 2.37±0.69 2.10±1.20 阳性对照组 雌 5 9 095 2.18±0.30 21.36±7.84* 100 mg/kg 雄 5 10 016 1.56±0.30 1.90±1.28 200 mg/kg 雄 5 10 009 1.52±0.28 1.60±0.70 400 mg/kg (24 h采样) 雄 5 10 006 1.40±0.73 2.40±2.01 400 mg/kg (48 h采样) 雄 5 8 802 1.43±0.63 1.29±1.26 溶媒对照组 雄 5 9 029 2.13±0.58 1.90±1.45 阳性对照组 雄 5 10 011 1.62±0.42 20.88±4.94* *P<0.05,与溶剂对照组比较。 3. 讨论
沙门菌回复突变试验(Ames试验)被研究者广为采用,该法的特点是快速、简便、敏感、经济,是经典的测试化学物质或药物致突变性实验[10]。染色体畸变分析是采用中国仓鼠卵巢(CHO)细胞体外培养的方法进行的。CHO细胞在加或不加代谢活化系统的条件下,与受试物接触一定时间后再于收集染色体4 h前用秋水仙碱处理,使细胞的有丝分裂停止在中期相。然后收集细胞,经低渗、固定、涂片和染色后,在显微镜下观察染色体数量和结构的改变,检测受试物的诱变性[7]。微核试验是检测化合物对染色体损伤作用的重要方法。凡能使染色体发生断裂或使染色体和纺锤体联结损伤的化合物,微核试验都可检测[8]。
本研究采用遗传毒性研究经典组合的方法,分别从原核系统到真核系统,从体外试验系统到体内试验系统,体外试验中包含了加与不加代谢活化系统,能检测基因突变、染色体畸变等多个遗传学终点,符合国际标准化的要求[5-6]。
本研究结果显示,本试验条件下,采用标准平板掺入法,WA在每皿5 000、500、50、5、0.5 μg的受试剂量下,加或不加S9时对组氨酸缺陷型鼠伤寒沙门菌均无致突变性;对CHO细胞,在23.74、47.48、94.96 μg/ml 3个剂量组,加或不加S9,于24 h和48 h诱发的细胞染色体畸变率均小于5%,与溶剂对照组结果相比较其差异均无统计学意义(P>0.05),表明WA在受试剂量下无致CHO细胞染色体畸变效应;WA在100、200、400 mg/kg 3个剂量下,对ICR小鼠的微核诱发率与溶剂对照组比较均无显著差异,表明其在受试剂量下对ICR小鼠无致微核效应[14]。上述结果提示WA没有遗传毒性和潜在致癌性。
此前有文献表明WA对小细胞肺癌的增殖有抑制作用,但对于遗传毒性未见报道。本研究对降低WA在研发过程中用于临床试验和疾病治疗的用药风险发挥重要作用。
-
[1] 钟桂香, 严佳, 贺全山. 抗晕动病药物的研究进展[J]. 医药导报, 2010, 29(6):747-749. doi: 10.3870/yydb.2010.06.022 [2] NOY S, SHAPIRA S, ZILBIGER A, et al. Transdermal therapeutic system scopolamine (TTSS), dimenhydrinate, and placebo: a comparative study at sea[J]. Aviat Space Environ Med,1984,55(11):1051-1054. [3] GLEITER C H, ANTONIN K H, BIECK P R. Transdermally applied scopolamine does not impair psychomotor performance[J]. Psychopharmacology (Berl),1984,83(4):397-398. doi: 10.1007/BF00428554 [4] 邓运龙, 张咏梅. 盐酸苯环壬酯片预防晕动病的疗效研究[J]. 中国新药杂志, 2001, 10(6):453-454. doi: 10.3321/j.issn:1003-3734.2001.06.020 [5] 国家科学技术奖励工作办公室. 把握创新的脉搏: 记盐酸苯环壬酯研究集体[J]. 中国科技奖励, 1999(1):36-37. [6] 刘传缋, 恽榴红, 文广玲, 等. 一种防治运动病综合征的药物组合物. CN1089838[P]. 1994-07-27. [7] 王彦辰, 曾媛, 刘辉, 等. 盐酸苯环壬酯控释片半透膜包衣工艺优化[J]. 中国医药工业杂志, 2018, 49(4):485-490. [8] 曾媛, 郑露露, 刘辉. 盐酸苯环壬酯控释片释放度研究方法的建立[J]. 中国药师, 2015, 18(1):11-13, 17. doi: 10.3969/j.issn.1008-049X.2015.01.004 [9] MURDIN L, GOLDING J, BRONSTEIN A. Managing motion sickness[J]. BMJ Clin Res Ed,2011,343:d7430. doi: 10.1136/bmj.d7430 [10] HOUSLEY G D, NORRIS C H, GUTH P S. Histamine and related substances influence neurotransmission in the semicircular canal[J]. Hear Res,1988,35(1):87-97. doi: 10.1016/0378-5955(88)90043-3 [11] ZHANG L L, WANG J Q, QI R R, et al. Motion sickness: current knowledge and recent advance[J]. CNS Neurosci Ther,2016,22(1):15-24. doi: 10.1111/cns.12468 [12] BREY R L. Both migraine and motion sickness may be due to low brain levels of serotonin[J]. Neurology,2005,65(4):E9-E10. doi: 10.1212/01.wnl.0000176949.34080.64 [13] FURMAN J M, MARCUS D A, BALABAN C D. Rizatriptan reduces vestibular-induced motion sickness in migraineurs[J]. J Headache Pain,2011,12(1):81-88. doi: 10.1007/s10194-010-0250-z [14] WOOD C D, STEWART J J, WOOD M J, et al. Effectiveness and duration of intramuscular antimotion sickness medications[J]. J Clin Pharmacol,1992,32(11):1008-1012. doi: 10.1002/j.1552-4604.1992.tb03803.x [15] MAKOWSKI A L, LINDGREN K, LOCKE J P. Visual side effects of scopolamine/ dextroamphetamine among parabolic fliers[J]. Aviat Space Environ Med,2011,82(7):683-688. doi: 10.3357/ASEM.2750.2011 [16] HUANG M, GAO J Y, ZHAI Z G, et al. An HPLC-ESI-MS method for simultaneous determination of fourteen metabolites of promethazine and caffeine and its application to pharmacokinetic study of the combination therapy against motion sickness[J]. J Pharm Biomed Anal,2012,62:119-128. doi: 10.1016/j.jpba.2011.12.033 [17] 许雪莲. 晕动症中西医治疗研究进展[J]. 现代医学与健康研究电子杂志, 2017, 1(8):178. [18] BORRELLI F, CAPASSO R, AVIELLO G, et al. Effectiveness and safety of ginger in the treatment of pregnancy-induced nausea and vomiting[J]. Obstet Gynecol,2005,105(4):849-856. doi: 10.1097/01.AOG.0000154890.47642.23 [19] PALATTY P L, HANIADKA R, VALDER B, et al. Ginger in the prevention of nausea and vomiting: a review[J]. Crit Rev Food Sci Nutr,2013,53(7):659-669. doi: 10.1080/10408398.2011.553751 [20] 卢咏梅. 丹参制剂的药理作用及临床应用[J]. 实用中医内科杂志, 2012, 26(7):71-72. [21] 黄明方, 侯建萍, 盖晓波. 生姜抗运动病研究进展[J]. 中华航海医学与高气压医学杂志, 2006, 13(3):192-194. doi: 10.3760/cma.j.issn.1009-6906.2006.03.028 [22] 董俊兴, 邹节明. 一种生姜酚类提取物软胶囊及其制备方法. CN104147557A[P]. 2014-11-19. [23] 董俊兴, 邹节明. 一种生姜酚类提取物质量检测方法. CN102680637A[P]. 2012-09-19. [24] SCHMÄL F. Neuronal mechanisms and the treatment of motion sickness[J]. Pharmacology,2013,91(3-4):229-241. doi: 10.1159/000350185 [25] TAL D, HERSHKOVITZ D, KAMINSKI-GRAIF G, et al. Vestibular evoked myogenic potentials and habituation to seasickness[J]. Clin Neurophysiol,2013,124(12):2445-2449. doi: 10.1016/j.clinph.2013.05.016 [26] 张玲燕, 施开华. 晕动习服运动处方的构建研究[J]. 体育科技文献通报, 2014, 22(3):43, 84. [27] HELLING K, WESTHOFEN M. Experimental studies of motion sickness on board of a research ship[J]. Hno,1994,42(4):214-249. [28] KRUEGER W W. Controlling motion sickness and spatial disorientation and enhancing vestibular rehabilitation with a user-worn see-through display[J]. Laryngoscope,2011,121(Suppl 2):S17-S35. [29] ISHAK S, BUBKA A, BONATO F. Visual occlusion decreases motion sickness in a flight simulator[J]. Perception,2018,47(5):521-530. doi: 10.1177/0301006618761336 [30] CHU H, LI M H, JUAN S H, et al. Effects of transcutaneous electrical nerve stimulation on motion sickness induced by rotary chair: a crossover study[J]. J Altern Complementary Med N Y N Y,2012,18(5):494-500. doi: 10.1089/acm.2011.0366 [31] KESHAVARZ B, STELZMANN D, PAILLARD A, et al. Visually induced motion sickness can be alleviated by pleasant odors[J]. Exp Brain Res,2015,233(5):1353-1364. doi: 10.1007/s00221-015-4209-9 [32] KESHAVARZ B, HECHT H. Pleasant music as a countermeasure against visually induced motion sickness[J]. Appl Ergon,2014,45(3):521-527. doi: 10.1016/j.apergo.2013.07.009 [33] HORING B, WEIMER K, SCHRADE D, et al. Reduction of motion sickness with an enhanced placebo instruction: an experimental study with healthy participants[J]. Psychosom Med,2013,75(5):497-504. doi: 10.1097/PSY.0b013e3182915ee7 [34] JARISCH R, WEYER D, EHLERT E, et al. Impact of oral vitamin C on histamine levels and seasickness[J]. J Vestib Res,2014,24(4):281-288. doi: 10.3233/VES-140509 [35] HOFFMAN T. Ginger: an ancient remedy and modern miracle drug[J]. Hawaii Med J,2007,66(12):326-327. [36] YOUN I, KHAN M A, UDDIN N, et al. Road disturbance estimation for the optimal preview control of an active suspension systems based on tracked vehicle model[J]. Int J Automot Technol,2017,18(2):307-316. doi: 10.1007/s12239-017-0031-7 [37] ALJARBOUH A, FAYAZ M. Hybrid modelling and sliding mode control of semi-active suspension systems for both ride comfort and road-holding[J]. Symmetry,2020,12(8):1286. doi: 10.3390/sym12081286 [38] DIZIO P, EKCHIAN J, KAPLAN J, et al. An active suspension system for mitigating motion sickness and enabling reading in a car[J]. Aerosp Med Hum Perform,2018,89(9):822-829. doi: 10.3357/AMHP.5012.2018 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 8659
- HTML全文浏览量: 4147
- PDF下载量: 316
- 被引次数: 0




 下载:
下载:



 下载:
下载:
