-
近年来,随着肿瘤、器官移植和获得性免疫缺陷综合征(AIDS)等导致的免疫功能低下人群的增加,侵袭性真菌感染(IFIs)的发病率和病死率逐年上升[1-2]。念珠菌、隐球菌和曲霉菌是IFIs最主要的致病菌,并且造成的病死率超过90%[3]。在念珠菌属中,白念珠菌(Candida. albicans)是院内血液感染最常见的致病菌原体,其在重症监护病房(ICU)患者中致病率超过17%,病死率高达40%[4-5]。临床上治疗IFIs的抗真菌药物主要包括:多烯类(两性霉素B)、核酸类(5-氟胞嘧啶)、唑类(氟康唑)和棘白菌素类(卡泊芬净)药物(图1)[6-7]。然而,由于临床上出现抗真菌药物严重的耐药性和毒副作用,IFIs的治疗效果相当有限。因此,迫切需要研发全新机制的抗真菌药物。
组蛋白乙酰化修饰(包括组蛋白乙酰化和去乙酰化)是表观遗传学研究的重要组成部分。组蛋白去乙酰化酶(HDACs)将组蛋白和其他蛋白上的赖氨酸末端乙酰基去除,对染色体重塑和基因的表达起着重要作用[8-9]。目前HDAC抑制剂主要集中于抗肿瘤研究方向,且已有多个上市药物应用于肿瘤的治疗。据研究报道,真菌中的HDACs,如烟曲霉[10]、白念珠菌[11-12]、酿酒酵母[13]和新生隐球菌的HDACs[14-15]参与了毒力相关的过程和形态变化。因此,抑制真菌HDACs可能是治疗IFIs的有效策略。
联合药物治疗是提高临床一线药物疗效并克服真菌耐药性的有效策略之一。真菌的耐药性涉及转录调节,其中染色体重塑和组蛋白修饰起主要作用。HDACs调节的组蛋白修饰在应激信号通路中起着至关重要的作用,这可能与真菌对各种环境(包括药物)的应激反应有关[16]。此外,已有研究报道,HDAC抑制剂与唑类药物联用具有协同增效作用[17-18]。例如,HDAC抑制剂MGCD290与氟康唑联用具有协同抗多种临床真菌分离株的作用[19]。
基于此,本研究首先对8个市售的HDAC抑制剂(图2)进行体外协同抗真菌活性测试,筛选结果显示化合物Rocilinostat与氟康唑联用具有优秀的体外协同抗耐药白念珠菌活性。后续考察其与不同唑类药物联用时对不同念珠菌属的体外协同抗真菌活性,以及对正常细胞的毒性作用,以期为抗真菌药物的研发提供依据。
-
临床分离的6株唑类耐药白念珠菌(编号:9893,10061,10060,9173,4108和0304103),2株唑类耐药热带念珠菌(编号:5008,10086),1株光滑念珠菌(编号:9073)和1株耳道念珠菌(编号:0029)由海军军医大学附属长征医院提供。菌株活化首先从−80 ℃中挑取菌株冻存液至YEPD液体培养基活化24 h,然后取10 μl菌悬液至1 ml YEPD中,并在30 ℃、200 r/min下培养16 h后待用。HUVEC细胞来源于中国科学院上海细胞库,并在新鲜配置的DMEM完全培养基中培养。
YEPD液体培养基:取10 g酵母浸膏、20 g葡萄糖、20 g蛋白胨溶解于1 000 ml三蒸水中,经高压蒸汽灭菌(121 ℃, 15 min)后,保存于4 ℃条件下备用。RPMI 1640培养基:取10 g RPMI 1640(Gibco)粉末、34.5 g吗啡啉丙磺酸、2 g NaHCO3、2.7 g NaOH溶解于1 000 ml三蒸水中,经0.22 μm的微孔滤膜过滤与灭菌后,置于4 ℃条件下保存和备用。DMEM完全培养基:按照89% DMEM基础培养基+10%胎牛血清+1%的双抗比例混匀制得,混匀后置于4 ℃条件下保存和备用。PBS缓冲液:10 × PBS 100 ml溶解于900 ml三蒸水中,经高压蒸汽灭菌(121 ℃, 15 min)后,置于4 ℃条件下保存和备用。
-
THZ-92A气浴恒温振荡器(上海博迅医疗生物仪器股份有限公司)、MJ-150-I霉菌培养箱(上海一恒科学仪器有限公司)、LW100T生物显微镜(北京测维光电技术有限公司)、HDC-15K高速离心机(上海泰坦科技股份有限公司)、C170二氧化碳培养箱(BINDER GmbH)、infinite M200多功能酶标仪(Tecan Austria GmbH)、高压蒸汽灭菌锅、无菌洁净工作台。
-
本实验参照美国临床和实验室标准协会(CLSI)公布的M27-A3方案中微量液基稀释法进行。首先,收集活化好的真菌细胞,PBS洗3次后用RPMI 1640培养基制成浓度为1×103 CFU/ml的菌悬液。按照每孔100 μl接种菌悬液至无菌96孔板中,1~9列加入倍半稀释的HDAC抑制剂,A~F行加入倍半稀释的氟康唑,其中G行只加氟康唑,第10列只加化合物,第11列为不加药的阴性对照组,后将96孔板置于35 °C条件下孵育48 h。测定每孔在630 nm处的吸光度A,依据公式:抑制率(%)=(A阳性对照孔−A化合物孔)/(A阳性对照孔−A阴性对照孔)× 100%,计算各孔对应的抑制率。如果某一孔和其左边孔对应的抑制率均大于80%,则该孔对应的化合物和FLC浓度分别作为FIC化合物和FIC氟康唑,利用协同指数公式:FICI =(FIC化合物./MIC80 化合物)+(FIC氟康唑/MIC80 氟康唑),计算各化合物对应的FICI。
-
收集活化好的白念珠菌0304103稀释在RPMI 1640培养液中,保持菌浓度为1×105 CFU/ml。取5 ml稀释的菌悬液和不同浓度的待测药物加入50 ml的离心管中, DMSO组作为空白对照组和32 μg/ml FLC作为阳性对照。随后将50 ml的离心管置于30 °C条件下振荡培养(200 r/min),在多个时间点吸取不同药物组的真菌混悬液(100 μl)于96孔板上,测量A630值并使用GraphPad Prism 7作图。
-
收集指数生长期的白念珠菌0304103细胞(湿重为100 mg),然后用3 mg snailase、12 μl 2-巯基乙醇和3 ml snailase反应缓冲液等新鲜配置的真菌裂解液来处理它们,以制备真菌原生质体。真菌原生质体分散在PBS(20 ml)中以获得混悬液,然后往96孔板每孔中加入100 μl的混悬液和不同浓度的化合物Rocilinostat,并在35 °C下培育12 h。接着往每个孔中加入30 μmol/L的HDAC底物,于37°C下孵育6 h。随后添加100 μl HDAC酶促终止溶液并在37°C下孵育2 h。最后,在每个孔中取出100 μl培养物添加到黑板中,用Ex=360 nm,Em=460 nm来监测荧光强度并记录下来用于计算HDAC酶的抑制率。
-
表1列出了HDAC抑制剂单独使用或与氟康唑联合使用的体外抗真菌活性筛选结果。MIC80为抑制80%真菌细胞生长的最低药物浓度。实验结果表明,8个HDAC抑制剂单独使用对耐药白念珠菌均无直接的抗真菌活性(MIC80>64 μg/ml);而化合物Rocilinostat(FICI=0.039)和伏立诺他(FICI=0.125)与FLC联用时均表现出良好的协同抗真菌活性。其中,化合物Rocilinostat的协同活性最佳,值得进一步研究。
表 1 单用HDAC抑制剂或者与氟康唑联用对白念珠菌0304103的体外抗真菌活性(μg/ml)
抑制剂 抑制剂 氟康唑 FICI 单用 联用 单用 联用 伏立诺他 >64 4 >64 4 0.125 Rocilinostat >64 2 >64 0.5 0.039 T3516 >64 64 >64 64 2 T6016 >64 64 >64 64 2 T6421 >64 32 >64 32 1 T2157 >64 32 >64 32 1 T1726 >64 64 >64 64 2 T3358 >64 32 >64 64 1.5 注: FICI值≤ 0.5表示协同,FICI值> 4表示拮抗;0.5<FICI<4表示不相关。 -
为进一步考察Rocilinostat是否具广谱的抗真菌作用,挑选9株临床分离的念珠菌属菌株进行协同抗真菌活性测试。如表2所示,Rocilinostat与FLC联合使用时,对两株耐FLC的白念珠菌(C. albicans 9173,FICI=0.094; C. albicans 4108, FICI=0.5)和对FLC敏感的光滑念珠菌(C. glabrata 9073)表现出协同增效作用,而对热带念珠菌(C. tropicis)和耳道念珠菌(C. auris)没有协同抗真菌活性。当Rocilinostat与伏立康唑(VRC)联用时,对耐VRC的白念珠菌(C. albicans 10060, FICI=0.033)表现出优异的协同抗真菌活性 (表3)。
表 2 Rocilinostat与氟康唑单用或联用对多种念珠菌菌株的体外抗真菌活性[MIC80 (μg/ml)]
菌株 单用 联用 FICI Rocilinostat 氟康唑 Rocilinostat 氟康唑 9893 >64 >64 64 64 2 10061 >64 >64 64 64 2 10060 >64 >64 64 64 2 9173 >64 >64 4 2 0.094 4108 >64 >64 32 32 0.5 10186 >64 >64 64 64 2 5008 >64 >64 64 8 1.125 9073 32 4 32 8 0.375 0029 64 32 >64 32 1 表 3 Rocilinostat与伏立康唑单用或联用对白念珠菌菌株的体外抗真菌活性[MIC80 (μg/ml)]
菌株 单用 联用 FICI Rocilinostat 伏立康唑 Rocilinostat 伏立康唑 0304103 >64 >64 32 2 0.531 10061 >64 >64 32 0.125 0.502 10060 >64 >64 2 0.125 0.033 -
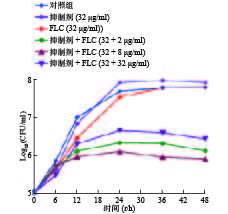
为进一步考察化合物Rocilinostat的协同抗真菌活性,我们又开展了时间-生长曲线实验。从图3结果可以看出,高浓度的氟康唑或Rocilinostat单独使用对真菌生长无抑制作用,而Rocilinostat与不同浓度的氟康唑联用能够有效抑制真菌的生长,且呈浓度依赖趋势 (图3中抑制剂为Rocilinostat)。
-
采用HUVEC(人脐静脉内皮细胞)对化合物Rocilinostat进行细胞毒性的评价。结果如表4显示,化合物Rocilinostat对正常细胞表现出低毒性,IC50值为52.17 μmol/L (22.60 μg/ml),相当于其发挥协同抗耐药真菌(C. albicans 0304103)活性MIC80值的44倍,表明Rocilinostat对真菌细胞具有较强的选择性作用。此外,我们还测试了化合物Rocilinostat对真菌总HDAC酶的抑制活性,结果表明,Rocilinostat对真菌HDAC酶抑制活性(IC50=0.41 μmol/L)优于泛HDAC抑制剂伏立诺他(IC50=1.03 μmol/L)。
表 4 Rocilinostat对正常细胞的毒性和真菌总HDAC酶活性IC50 (μmol/L)
化合物 HUVEC 白念珠菌(总HDAC酶) Rocilinostat 52.17 0.41 伏立诺他 — 1.03 注: “—”表示没有测试。 -
本研究从市售的8个HDAC抑制剂中筛选出协同活性最佳的化合物Rocilinostat。进一步研究发现Rocilinostat与氟康唑联用对白念珠菌和光滑念珠菌具有协同增效作用。此外,化合物Rocilinostat与伏立康唑联用对临床分离的耐药白念珠菌株同样具有优秀的抗真菌活性。更值得关注的是,化合物Rocilinostat对正常细胞表现出低毒性,其对真菌细胞具有很好的选择性。因此,HDAC抑制剂Rocilinostat可以作为一种低毒、有效的唑类抗真菌药物增效剂,为抗真菌药物的发展提供了新的研究基础。
Antifungal activity study on HDAC inhibitor Rocilinostat
-
摘要:
目的 探索组蛋白去乙酰化酶(HDAC)抑制剂与唑类药物联用对唑类耐药念珠菌的体外协同的抗真菌活性。 方法 根据棋盘稀释法,测试HDAC抑制剂和唑类药物联用对临床耐药株的协同抗真菌活性,通过时间-生长曲线实验和细胞毒性实验对化合物Rocilinostat的抑菌效果、毒性进行考察。 结果 化合物Rocilinostat与唑类药物联用对多种耐药白念珠菌和光滑念珠菌均表现出优秀的协同抗真菌活性,并且其在高浓度下与氟康唑联用表现出抑菌效果。此外,化合物Rocilinostat对正常细胞表现出低毒性,且对白念珠菌HDAC具有强烈的抑制活性,优于对照药伏立诺他。 结论 化合物Rocilinostat作为真菌HDAC抑制剂,具有优秀的体外协同抗真菌活性,且对真菌细胞具有较好的选择性作用。 -
关键词:
- 组蛋白去乙酰化酶抑制剂 /
- 体外协同抗真菌活性 /
- 耐药 /
- 白念珠菌
Abstract:Objective To evaluate the in vitro synergistic antifungal activity of HDAC inhibitors in combination with azole drugs against azoles-resistant Candida strains. Methods The checkerboard microdilution method was used to evaluate the antifungal activity of the HDAC inhibitors in combination with azole drugs against clinically drug-resistant strains. The fungistatic activity and toxicity of Rocilinostat was determined through time-growth curve assay and cytotoxicity assay. Results The compound Rocilinostat combined with azole drugs showed excellent synergistic antifungal activity against a variety of azoles-resistant Candida albicans and Candida glabrata. The combination of high concentration Rocilinostat with FLC exhibited fungistatic effects. Very low toxicity was detected with Rocilinostat towards normal cells. Rocilinostat showed better HDAC inhibitory activity than SAHA. Conclusion As a fungi HDAC inhibitor, Rocilinostat has excellent in vitro synergistic antifungal activity and no severe toxicity to normal human cells. -
Key words:
- HDAC inhibitors /
- in vitro synergistic antifungal activity /
- resistant /
- Candida albicans
-
高原是指海拔高于2 500 m能够引起机体产生明显生物学效应的地区[1]。高原低氧环境会影响机体的生理功能与药物疗效的发挥[2]。高原地区高血压患病率显著高于平原地区,高血压是高原地区最常见的慢性疾病和心血管疾病的严重危险因素。临床上最常使用钙通道阻滞剂类降压药(CCB)[3],硝苯地平是治疗高血压的一线用药,通过阻断血管平滑肌细胞上的钙通道从而扩张血管降低血压,同时阻断心肌细胞L型钙通道从而减慢心率[4]。本课题组前期研究表明,急进高原后大鼠体内硝苯地平的药动学参数会发生显著变化[5]。由于高原低氧环境导致药物的药动学参数改变,体内血药浓度可能达不到有效治疗浓度,从而影响硝苯地平降压效果,但目前有关硝苯地平对高原高血压人群的疗效研究尚未见报道。本研究首次报道高原低氧环境下硝苯地平控释片对高血压患者降压作用的临床疗效及安全性评价,从而为高原高血压人群提供有效治疗方案,为临床合理用药提供参考。
1. 材料与方法
1.1 病例选择
研究对象为2020年2月至2021年2月于中国人民解放军联勤保障部队第九四〇医院及玉树八一医院诊治的共84例高血压患者。本研究经第九四〇医院伦理委员会批准,审批编号为2019KYLL068。
1.1.1 诊断与入选标准
①符合《中国高血压防治指南》中关于高血压的诊断标准[6],即非同日3次所测量的诊室血压:收缩压(SBP)≥140 mmHg和(或)舒张压(DBP)≥90 mmHg的患者;②高原高血压患者为久居高原1年及以上者,平原高血压患者为久居平原1年及以上者,两组患者近1个月内未服用降压药物;③入院后连续每日晨起服用硝苯地平控释片30 mg,连续6 d达到稳态血药浓度者;④年龄40~85岁。
1.1.2 排除标准
①继发性高血压或临床诊断为病危者;②伴发有严重心脑血管疾病者。③肝功能异常者,丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)超过上限1.5倍者;④肾功能异常者或存在影响肾功能的急性因素者。
1.2 药品
硝苯地平控释片,规格:30 mg/片,批号:IX20200382,批准文号:国药准字J20180025,德国Bayer AG公司生产。
1.3 分组与治疗方法
将42例第九四〇医院高血压住院患者(海拔1 500 m)设为平原高血压组,42例八一医院高血压住院患者(海拔3 800 m)设为高原高血压组。两组患者均给予硝苯地平控释片每日晨起口服30 mg,连续6 d。
1.4 观察指标与疗效判定
根据我国总结和规定的降压药临床研究指导原则:将血压作为药效评价的主要指标,将记录的平原与高原组血压值,按照疗效标准等级:显效、有效、无效进行评价。考察相同剂量下,高原低氧环境对硝苯地平降压疗效的影响。监测平原高血压组和高原高血压组患者按照每日晨起口服30 mg硝苯地平控释片连续6 d的血压值,包括每天清晨、服药前及临睡前3个时段的SBP和DBP。具体操作为:在患者平躺情况下,对每个时间段的每次血压均测定3次,计算出平均值。疗效判定按文献[7-8]的方法对3个时间段的血压进行评价,分为显效、有效和无效。显效:SBP下降幅度≥10 mmHg并降至正常或SBP未达正常但下降幅度≥20 mmHg;有效:SBP下降1~10 mmHg并降至正常或SBP未降至正常但下降10~19 mmHg;无效:未达到上述标准。对总有效率(总有效率=显效率+有效率)进行统计学比较,以判定疗效。
此外,临床研究显示,较快的心率会显著增加高血压患者心血管事件和病死率[9-11]。依据专家建议,高血压患者应首先控制血压达标,在降压治疗的同时注重心率管理[12]。硝苯地平控释片具有反射性刺激交感神经激活的作用,可能导致心率加快引起心悸等不良反应。根据国内外指南和专家共识,在测定血压时一并测得心率,详细记录清晨、服药前、临睡前的心率。
1.5 统计学处理
用SPSS Statistics 21进行统计分析。计量资料用
$ \bar x \pm s $ 表示,组间比较用独立样本t检验,组内比较用卡方检验;计数资料用率表示,比较用卡方检验。2. 结果
2.1 一般资料
调查内容包括一般人口学资料、身高、体重、BMI、ALT、AST、Cr等。平原高血压组及高原高血压组的AST、ALT、Cr值均符合纳入排除标准,患者伴发疾病及合并用药较少。两组患者的一般资料比较,差异均无统计学意义(P>0.05),组间具有可比性,见表1。
表 1 平原高血压组和高原高血压组患者的一般资料比较($ \bar x \pm s $ ,n=42)项目 平原高血压组 高原高血压组 性别(男/女) 30/12 22/20 年龄 61.24±8.02 60.19±9.28 身高(l/cm) 168.79±9.09 168.31±6.45 体重(m/kg) 69.30±10.64 67.29±7.36 BMI (kg/m2) 24.23±2.45 23.80±2.54 AST(U/L) 21.31±8.87 25.14±9.77 ALT(U/L) 27.14±16.90 28.38±15.37 Cr(μmol/L) 74.93±17.33 76.17±19.79 2.2 高原及平原高血压人群血压值统计
依据临床血压监测指导原则,测定了3个不同时间段的血压值,分别为清晨、用药前及临睡前的血压。治疗前,高原高血压组的清晨DBP、服药前及临睡前的SBP和DBP均显著高于平原高血压组,且高原组舒张压升高更为显著。连续用药6 d后,平原高血压组的清晨、服药前及临睡前SBP均显著低于治疗前(P<0.01)。高原高血压组治疗前后的各时间段SBP和DBP均显著高于平原高血压组,差异均有统计学意义(P<0.05),但高原组治疗后与治疗前相比无显著性差异,且血压未降至正常,可见高原高血压组服用硝苯地平在6 d内的降血压疗效比平原高血压组差,详见表2。
表 2 平原高血压组和高原高血压组不同时段血压值比较(mmHg,$ \bar x \pm s $ ,n=42)组别 检测时间 SBP DBP 清晨 服药前 临睡前 清晨 服药前 临睡前 平原高血压组 治疗前 151.14±15.70 146.90±10.45 148.93±12.39 89.43±13.11 87.48±10.30 89.62±11.60 治疗后 138.86±14.66## 137.93±14.44# 137.95±17.82# 86.90±12.52 86.05±14.06 85.05±12.70 高原高血压组 治疗前 154.55±12.29 153.38±11.66** 154.60±11.98* 104.67±17.18*** 106.86±15.09*** 106.64±14.18*** 治疗后 148.93±19.76* 148.55±19.28** 149.10±20.00** 100.07±16.11*** 102.19±16.60*** 101.86±15.89*** *P<0.05, **P<0.01, ***P<0.001,与平原高血压组比较;#P<0.05,##P<0.01,与治疗前比较。 采用配对样本t检验判断硝苯地平治疗前后对平原高血压组和高原高血压组患者血压的影响,表3结果显示,平原高血压组治疗前后的清晨、服药前及临睡前SBP、临睡前DBP有统计学差异,高原高血压组治疗前后各时间段的SBP和DBP无统计学差异。
表 3 平原高血压组和高原高血压组患者治疗前后血压下降值比较(mmHg,$ \bar x \pm s $ ,n=42)组别 SBP下降值 DBP下降值 清晨 服药前 临睡前 清晨 服药前 临睡前 平原高血压组 12.29±17.10*** 8.98±15.40** 10.98±17.70*** 2.52±10.56 1.43±12.36 4.57±10.43** 高原高血压组 5.62±16.72 4.83±19.17 5.50±19.58 4.59±16.94 4.67±17.91 4.78±17.59 **P<0.01, ***P<0.001,与治疗前清晨、服药前、临睡前比较。 2.3 平原高血压组和高原高血压组患者的临床疗效评价
专家建议将研究结束时给药间隔末(谷值时)血压与基线血压的差值作为主要疗效指标[8],本研究中选用服药前时间段的治疗前后血压之差进行疗效评价。高原高血压组和平原高血压组的总有效率分别为47.62%(20例/42例)和76.19%(32例/42例),高原高血压组硝苯地平控释片降压总有效率显著低于平原高血压组(P<0.05),见表4。
表 4 平原高血压组和高原高血压组患者的临床疗效比较[例(%),n=42]组别 显效 有效 无效 总有效率 平原高血压组 24(57.14) 8(19.05) 10(23.81) 32(76.19) 高原高血压组 13(30.95) 7(16.67) 22(52.38) 20(47.62)* *P<0.05,与平原高血压组比较。 两组患者均按照医嘱连续服药,获得81例患者不同时段心率数据。其中,平原高血压组41例,高原高血压组40例。高原高血压组各时间段的心率均显著高于平原高血压组,证实高原低氧环境会导致心率显著上升。连续用药6 d后,平原高血压组的清晨及服药前心率显著低于治疗前(P<0.05),高原高血压组心率有所下降,但无显著性差异(P>0.05),见表5。提示应在降压治疗的同时关注心率管理,以预防心血管事件的发生。
表 5 平原高血压组与高原组患者心率指标比较($ \bar x \pm s $ )组别 治疗前 治疗后 清晨 服药前 临睡前 清晨 服药前 临睡前 平原高血压组 109.51±17.46 110.37±17.90 109.85±17.62 100.46±21.13# 101.46±21.88# 101.39±21.42 高原高血压组 119.03±13.96** 119.70±14.64* 119.43±14.05** 113.65±20.22** 113.18±19.56* 114.55±19.55** *P<0.05,**P<0.01,与平原高血压组比较;#P<0.05,与治疗前比较。 2.4 安全性评价
在试验过程中,平原高血压组5例患者发生心动过速、心悸的症状,高原高血压组6例患者发生心动过速、心悸的症状。两组患者的药物不良反应发生率分别为11.90%和14.29%,差异无统计学意义(P>0.05)。
3. 讨论
本研究结果表明,高原高血压组的血压和心率值均显著高于平原高血压组,且高原高血压组血压控制不良、心率管理不佳,高原高血压患者服用与平原高血压患者同剂量的硝苯地平控释片未能有效地控制短期内血压。高原地区硝苯地平用药剂量应高于平原剂量,因此有必要建议《中国高血压防治指南》可增加一项高原地区高血压人群用药剂量。以增加药物在机体内的血药浓度,从而长期有效控制血压,与此同时需做好高血压患者服药前后血压的监测及患者安全用药教育,减少药物不良反应的发生,从而提高高原地区用药的合理性、安全性及有效性。
高原合理用药展望,目前,高原地区的合理用药指导有待提高,原因有以下几点:①地域偏远、文化差异及经济欠发达导致高原地区医护人员的合理用药意识存在局限性。此外,高原地区高血压的患病率高于全国平均水平,但患者的知晓率、治疗率和控制率明显偏低[13]。②高血压是心血管系统中最常见的慢性疾病,可诱发许多并发症,高血压严重危害高原地区人群的生命健康,降低血压可随之降低心血管疾病并发率,改善预后[14-15],但高原地区患者服药的依从性差,不能长期遵医嘱服药,导致血压控制不佳,增加心血管疾病患病风险。③高原低氧环境会改变药物药动学参数从而影响药物疗效,但高原地区人体的药动学研究少有报道。从事高原合理用药研究的相关人员较少,高原人群的特殊用药至今未列入研究的议事日程。高原低氧环境导致药动学改变从而导致药效的差异是个体化合理用药中必须考虑的问题。综上,针对高原地区沿用平原临床用药方案的问题亟需解决,应着重研究高原与平原地区合理用药的临床疗效差异,发布高原地区合理用药指南,培养和提高高原地区医护人员合理用药意识,提高患者对疾病的知晓率、治疗率和控制率,提高患者用药依从性。
-
表 1 单用HDAC抑制剂或者与氟康唑联用对白念珠菌0304103的体外抗真菌活性(μg/ml)
抑制剂 抑制剂 氟康唑 FICI 单用 联用 单用 联用 伏立诺他 >64 4 >64 4 0.125 Rocilinostat >64 2 >64 0.5 0.039 T3516 >64 64 >64 64 2 T6016 >64 64 >64 64 2 T6421 >64 32 >64 32 1 T2157 >64 32 >64 32 1 T1726 >64 64 >64 64 2 T3358 >64 32 >64 64 1.5 注: FICI值≤ 0.5表示协同,FICI值> 4表示拮抗;0.5<FICI<4表示不相关。 表 2 Rocilinostat与氟康唑单用或联用对多种念珠菌菌株的体外抗真菌活性[MIC80 (μg/ml)]
菌株 单用 联用 FICI Rocilinostat 氟康唑 Rocilinostat 氟康唑 9893 >64 >64 64 64 2 10061 >64 >64 64 64 2 10060 >64 >64 64 64 2 9173 >64 >64 4 2 0.094 4108 >64 >64 32 32 0.5 10186 >64 >64 64 64 2 5008 >64 >64 64 8 1.125 9073 32 4 32 8 0.375 0029 64 32 >64 32 1 表 3 Rocilinostat与伏立康唑单用或联用对白念珠菌菌株的体外抗真菌活性[MIC80 (μg/ml)]
菌株 单用 联用 FICI Rocilinostat 伏立康唑 Rocilinostat 伏立康唑 0304103 >64 >64 32 2 0.531 10061 >64 >64 32 0.125 0.502 10060 >64 >64 2 0.125 0.033 表 4 Rocilinostat对正常细胞的毒性和真菌总HDAC酶活性IC50 (μmol/L)
化合物 HUVEC 白念珠菌(总HDAC酶) Rocilinostat 52.17 0.41 伏立诺他 — 1.03 注: “—”表示没有测试。 -
[1] FISHER M C, HAWKINS N J, SANGLARD D, et al. Worldwide emergence of resistance to antifungal drugs challenges human health and food security[J]. Science,2018,360(6390):739-742. doi: 10.1126/science.aap7999 [2] BROWN G D, DENNING D W, LEVITZ S M. Tackling human fungal infections[J]. Science,2012,336(6082):647. doi: 10.1126/science.1222236 [3] PFALLER M A, DIEKEMA D J. Epidemiology of invasive mycoses in North America[J]. Crit Rev Microbiol,2010,36(1):1-53. doi: 10.3109/10408410903241444 [4] PFALLER M A, DIEKEMA D J. Epidemiology of invasive candidiasis: a persistent public health problem[J]. Clin Microbiol Rev,2007,20(1):133-163. doi: 10.1128/CMR.00029-06 [5] WISPLINGHOFF H, BISCHOFF T, TALLENT S M, et al. Nosocomial bloodstream infections in US hospitals: analysis of 24, 179 cases from a prospective nationwide surveillance study[J]. Clin Infect Dis,2004,39(3):309-317. doi: 10.1086/421946 [6] ODDS F C. Genomics, molecular targets and the discovery of antifungal drugs[J]. Rev Iberoam Micol,2005,22(4):229-237. doi: 10.1016/S1130-1406(05)70048-6 [7] ODDS F C, BROWN A J P, GOW N A R. Antifungal agents: mechanisms of action[J]. Trends Microbiol,2003,11(6):272-279. doi: 10.1016/S0966-842X(03)00117-3 [8] KIM J, LEE J E, LEE J S. Histone deacetylase-mediated morphological transition in Candida albicans[J]. J Microbiol,2015,53(12):805-811. doi: 10.1007/s12275-015-5488-3 [9] CUI L, MIAO J, FURUYA T, et al. Histone acetyltransferase inhibitor anacardic acid causes changes in global gene expression during in vitro Plasmodium falciparum development[J]. Eukaryot Cell,2008,7(7):1200-1210. doi: 10.1128/EC.00063-08 [10] LEE I, OH J H, SHWAB E K, et al. HdaA, a class 2 histone deacetylase of Aspergillus fumigatus, affects germination and secondary metabolite production[J]. Fungal Genet Biol,2009,46(10):782-790. doi: 10.1016/j.fgb.2009.06.007 [11] LOHSE M B, JOHNSON A D. Temporal anatomy of an epigenetic switch in cell programming: the white-opaque transition of C. albicans[J]. Mol Microbiol,2010,78(2):331-343. doi: 10.1111/j.1365-2958.2010.07331.x [12] HNISZ D, SCHWARZMÜLLER T, KUCHLER K. Transcriptional loops meet chromatin: a dual-layer network controls white-opaque switching in Candida albicans[J]. Mol Microbiol,2009,74(1):1-15. doi: 10.1111/j.1365-2958.2009.06772.x [13] ROBBINS N, LEACH M D, COWEN L E. Lysine deacetylases Hda1 and Rpd3 regulate Hsp90 function thereby governing fungal drug resistance[J]. Cell Rep,2012,2(4):878-888. doi: 10.1016/j.celrep.2012.08.035 [14] LIU O W, CHUN C D, CHOW E D, et al. Systematic genetic analysis of virulence in the human fungal pathogen Cryptococcus neoformans[J]. Cell,2008,135(1):174-188. doi: 10.1016/j.cell.2008.07.046 [15] DUMESIC P A, HOMER C M, MORESCO J J, et al. Product binding enforces the genomic specificity of a yeast polycomb repressive complex[J]. Cell,2015,160(1-2):204-218. doi: 10.1016/j.cell.2014.11.039 [16] 黄海, 王彦, 李莹, 等. 白念珠菌的应激反应与耐药性[J]. 第二军医大学学报, 2010, 31(11):1239-1243. [17] KMETZSCH L. Histone deacetylases: Targets for antifungal drug development[J]. Virulence,2015,6(6):535-536. doi: 10.1080/21505594.2015.1049807 [18] SU S, LI X Y, YANG X M, et al. Histone acetylation/deacetylation in Candida albicans and their potential as antifungal targets[J]. Futur Microbiol,2020,15(11):1075-1090. doi: 10.2217/fmb-2019-0343 [19] PFALLER M A, MESSER S A, GEORGOPAPADAKOU N, et al. Activity of MGCD290, a Hos2 histone deacetylase inhibitor, in combination with azole antifungals against opportunistic fungal pathogens[J]. J Clin Microbiol,2009,47(12):3797-3804. doi: 10.1128/JCM.00618-09 -






 下载:
下载:



 下载:
下载: