-
小胶质细胞是一种神经胶质细胞,是存在于中枢神经系统中的炎症免疫相关细胞,相当于中枢神经器官(脑和脊髓)中的巨噬细胞[1]。小胶质细胞的生理作用是清除中枢神经系统中受损的神经组织、通过血脑屏障入侵中枢的感染源及异物等。在病理状态下,已有多项研究表明,小胶质细胞在多种中枢神经系统疾病的发生发展中发挥重要的作用,包括缺血性脑梗、多发性硬化、神经退行性疾病等[2-3]。因此,抑制小胶质细胞的促炎反应对多种疾病的治疗具有重要意义。
α7 n型乙酰胆碱能受体(α7 nicotinic acetylcholine receptor, α7nAChR)是一种n型乙酰胆碱能受体亚型,从属于配体门控的离子通道受体家族[4]。从传统意义上来说,α7 n型乙酰胆碱能受体位于神经肌肉接头后膜,接受传出神经末梢突触释放的化学递质(Ach)的作用,使得电信号继续传播。然而,近年来越来越多的研究表明,激动 α7 n型乙酰胆碱能受体可以参与胆碱能抗炎通路的激活,进而在多种病理状态下发挥抗炎作用[5]。目前研究已表明,α7 n型乙酰胆碱能受体介导的胆碱能抗炎通路在多种疾病的发生发展中发挥抑制作用[6]。
与其他巨噬细胞一样,小胶质细胞也分为经典活化的M1型巨噬细胞和选择性活化的M2型巨噬细胞[7]。一般来讲,M1型巨噬细胞主要分泌促炎因子,如IL-1β、IL-6、TNF-α、IL-12、IL-18等;而M2型巨噬细胞主要分泌抗炎因子,如IL-4、IL-10、IL-13等[8]。因此,在炎症免疫相关疾病中,降低M1/M2细胞的比例成为重要的治疗手段。
自噬是生物体的一种重要的代谢机制,利用溶酶体降解自身受损细胞器和大分子物质的进化上高度保守的过程[9]。自噬通常分为大自噬、小自噬和分子伴侣介导的自噬,由于大自噬的研究相对较多,在疾病中的作用也较为突出,因此,本研究主要讨论大自噬的作用(后续将描述为“自噬”)。在自噬过程中,自噬小体形成,包裹细胞组分或入侵的病原体,与溶酶体融合形成自噬溶酶体,最后自噬溶酶体将包裹的底物降解并释放入胞浆供细胞重新利用[10]。已有报道,自噬具有抗炎的作用[11]。
由此,本课题组探究在小胶质细胞中,α7 n型乙酰胆碱能受体是否具有抗炎的作用,并且探究这一过程是否有调节M1型与M2型巨噬细胞的比例与诱导自噬过程的参与。
-
75%乙醇、异丙醇、甲醇、吐温-80、20×PBS、BSA、Tris碱、多聚甲醛、引物、LPS、DMEM高糖培养基、抗LC3抗体、抗Beclin-1抗体、抗p62/SQSTM1抗体、荧光二抗、DAPI染料、氯仿、细胞/组织蛋白裂解液、蛋白酶抑制剂(三联装)、甘氨酸、30%聚丙烯酰胺溶液、过硫酸铵、TEMED、1.5 mol/L Tris(pH 8.8)、1.5 mol/L Tris(pH 6.8)。JA2003电子天平(上海天平仪器厂);电热恒温水浴槽DK-8D(上海一恒科学仪器有限公司);STS-8A转移脱色摇床(上海琪特分析仪器有限公司);离心管(Corning公司);移液枪(Eppendorf公司);7500RT-PCR仪器(Applied Biosystems公司);超纯水仪(Millipore公司);荧光显微镜IX71(日本Olympus公司);锥形瓶;激光共聚焦显微镜(日本Olympus公司);酶标仪(瑞士Tacan公司);细胞操作超净台(苏州净化设备有限公司);Odyssey扫膜仪(LI-COR公司)。
-
BV2小胶质细胞系(美国ATCC细胞库)。细胞常规培养加入10% FBS的DMEM高糖培养基中,培养在37°C、5% CO2的培养箱中。在实验中,我们提前10 min加入PNU282987孵育,后加入LPS(1 000 ng/ml)刺激BV2细胞12 h。
-
提取细胞总RNA,逆转录成cDNA,使用cDNA进行实时定量PCR检测,引物由上海生工生物合成,序列见表1。
表 1 实时定量PCR引物序列
引物名称 引物序列 IL-1β (上游) 5′-CTCGTGCTGTCGGACCCCAT-3′ IL-1β (下游) 5′- AGTGTTCGTCTCGTGTTCGGAC-3′ IL-6 (上游) 5′-TAGTCCTTCCTACCCCAATTTCC-3′ IL-6 (下游) 5′-TTGGTCCTTAGCCACTCCTTC-3′ TNF-α (上游) 5′-AAGCCTGTAGCCCACGTCGTA-3′ TNF-α (下游) 5′-GGCACCACTAGTTGGTTGTCTTTG-3′ GAPDH (上游) 5′-GTATGACTCCACTCACGGCAAA-3′ GAPDH (下游) 5′-GGTCTCGCTCCTGGAAGATG-3′ 按规范程序设置PCR仪,所得CT值按照2–∆∆CT公式计算。
-
提取细胞/组织蛋白,BCA法测定蛋白浓度,经加样、跑胶、转膜等步骤后,PVDF膜孵育牛奶封闭3 h,后分别孵育一抗(4 ℃过夜)、二抗(35 min,避光),用PBST液进行漂洗后,置于Odyssey扫膜仪中获取Western blot图像。
-
取出经过处理后的BV2细胞,弃掉培养基,加入PBS液润洗,用4%多聚甲醛室温孵育固定10 min,用PBS液洗涤5 min×3次,后用0.1% Triton X-100室温孵育5 min,用PBS洗涤5 min×3次;用山羊血清封闭室温10 min,后孵育一抗(室温1 h)、二抗(37 ℃,30 min,避光),加入DAPI染核3 min,后用PBS洗涤5 min×3次,加入抗荧光淬灭剂后于激光共聚焦显微镜拍照。
-
实验数据以(
$\bar{x}\pm s$ )表示,数据处理过程中,多组间比较用单因素方差分析(analysis of variance,ANOVA)并Bonferroni检验,P<0.05时认为差异具有统计学意义。 -
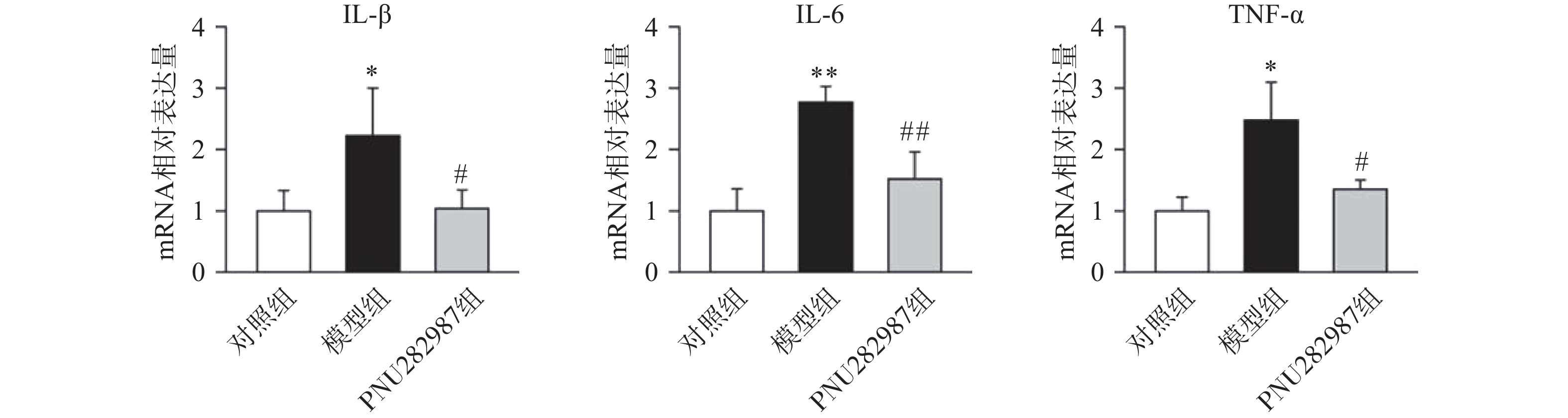
首先,我们探究在小胶质细胞中,α7 n型乙酰胆碱能受体对炎症反应水平的影响。提前10 min加入PNU282987(10 μmol/L)孵育,后加入LPS(1 000 ng/ml)刺激BV2细胞,刺激12 h后,通过实时定量PCR技术检测BV2细胞的促炎因子IL-1β、IL-6、TNF-α水平(图1)。
从图1中可以看出,在LPS的刺激下,小胶质细胞中促炎因子IL-1β、IL-6、TNF-α的mRNA水平显著增加,而应用PNU282987激动α7nAChR极大地降低了促炎因子IL-1β、IL-6、TNF-α的mRNA水平。由此可以看出,炎症环境中激动α7nAChR在小胶质细胞中的抗炎作用。
-
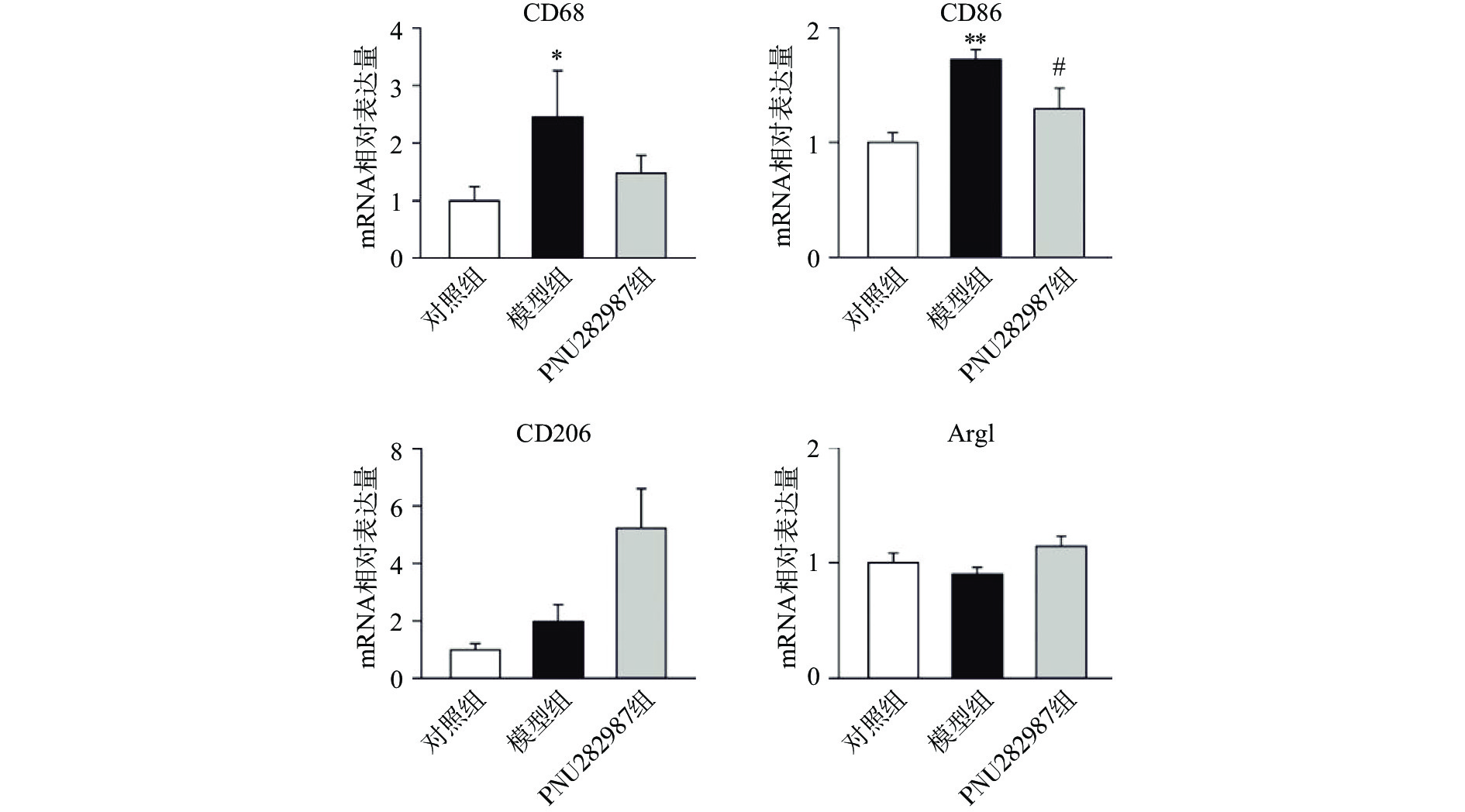
炎症环境中激动α7 n型乙酰胆碱能受体在小胶质细胞中的抗炎机制。提前10 min加入PNU282987(10 μmol/L)孵育,后加入LPS(1 000 ng/ml)刺激BV2细胞,刺激12 h后,通过实时定量PCR技术检测BV2细胞的M1型巨噬细胞标记物CD68、CD86与M2型巨噬细胞标记物CD206、Arg1的mRNA水平(图2)。
从图2可以看出,在LPS的刺激下,小胶质细胞中M1型巨噬细胞标记物CD68、CD86的mRNA水平显著增加,而应用PNU282987激动α7 n型乙酰胆碱能受体极大地降低了巨噬细胞标记物CD68、CD86的mRNA水平并增加了M2型巨噬细胞标记物CD206、Arg1的mRNA水平。
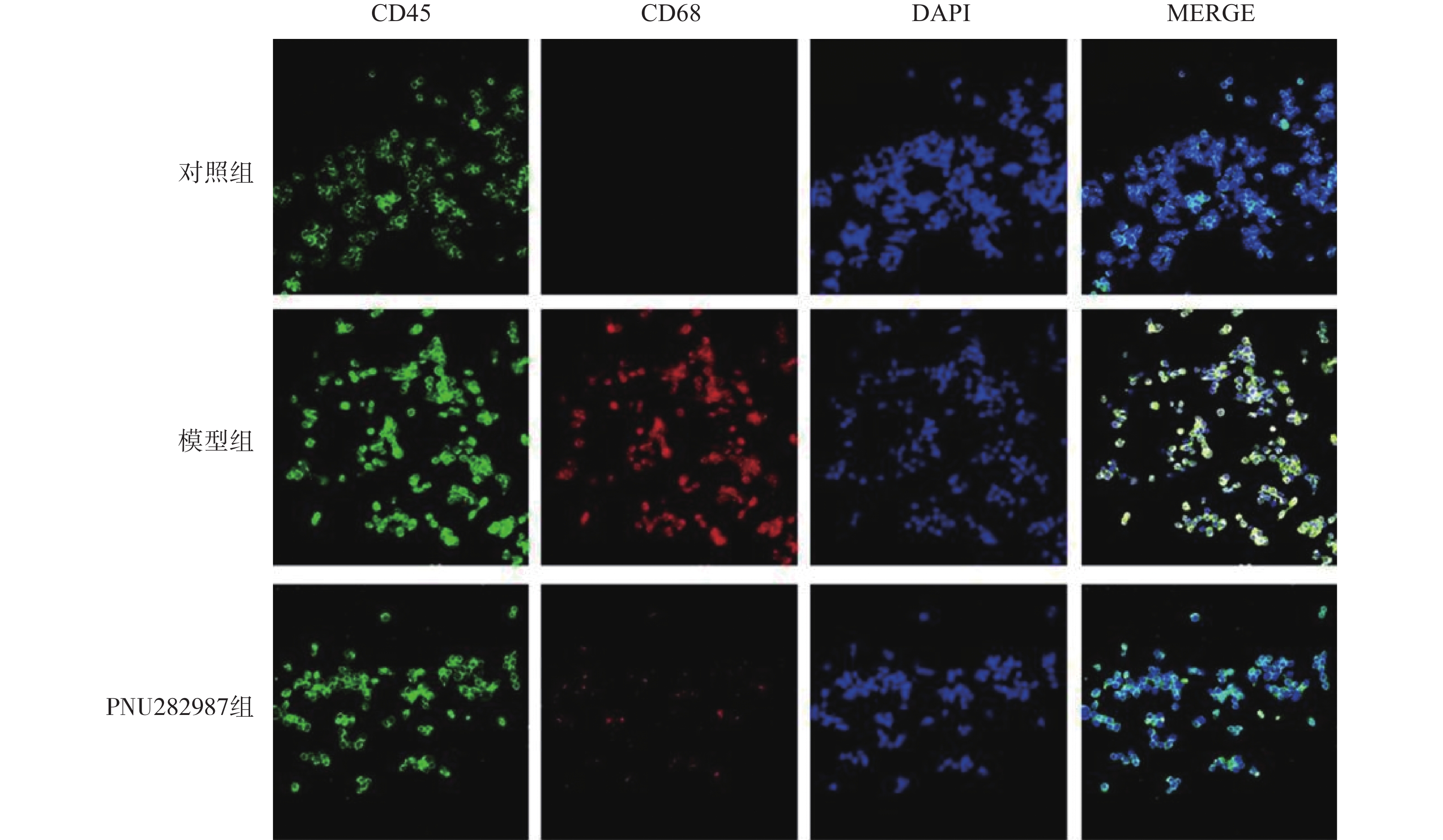
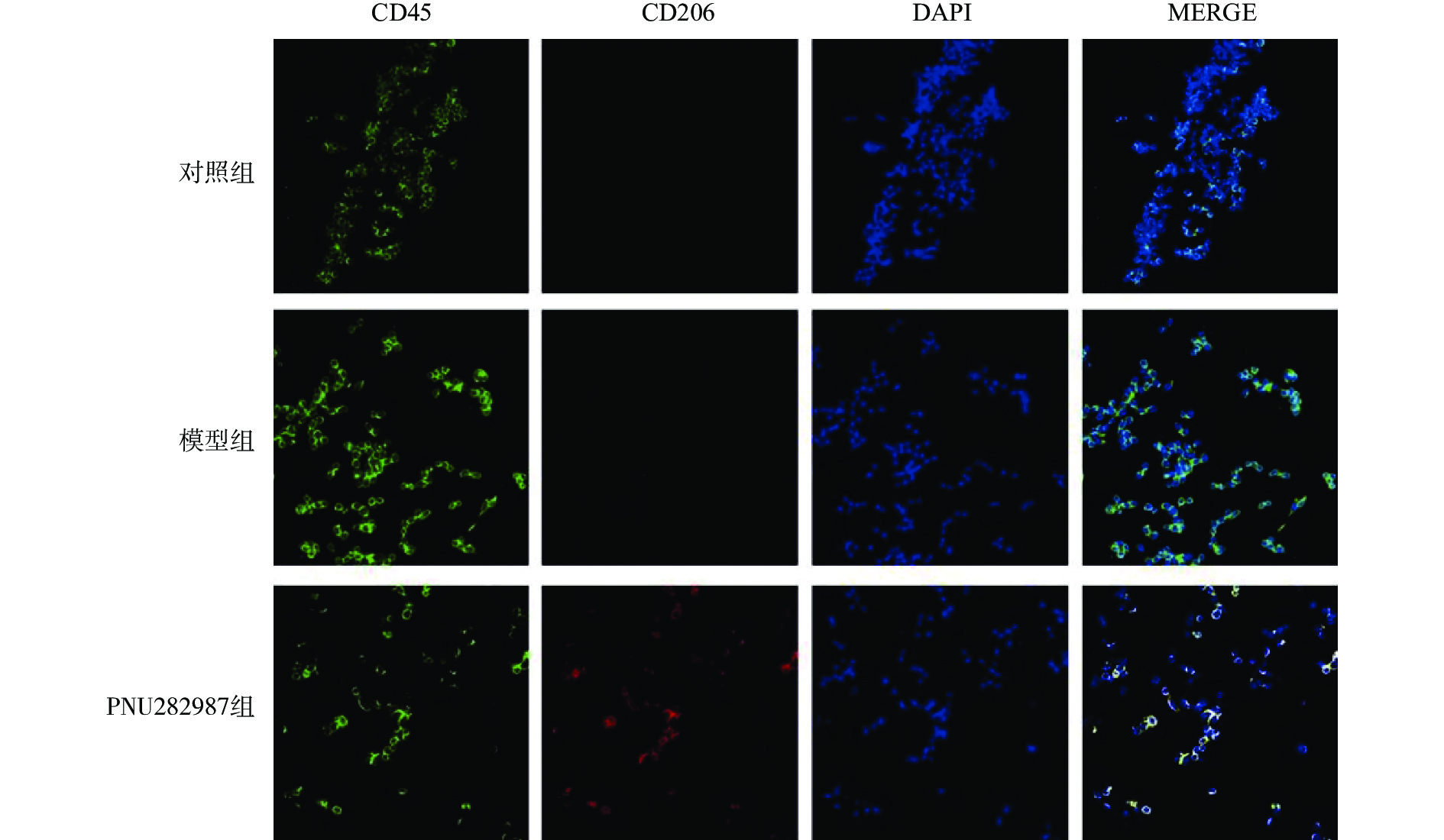
对BV2细胞进行同样的处理,而后通过细胞免疫荧光技术检测M1型巨噬细胞比例(CD45+、CD68+细胞,图3)与M2型巨噬细胞比例(CD45+、CD206+细胞,图4)。
从图3和图4可以看出,在LPS的刺激下,小胶质细胞中M1型巨噬细胞比例显著增加,而应用PNU282987激动α7 n型乙酰胆碱能受体极大地降低了M1型巨噬细胞的比例并增加了M2型巨噬细胞的比例。
综合图2~4的结果可以发现,炎症环境中激动α7 n型乙酰胆碱能受体可以调节小胶质细胞M1型与M2型比例,增加M2型巨噬细胞的比例并降低M1型巨噬细胞的比例。
-
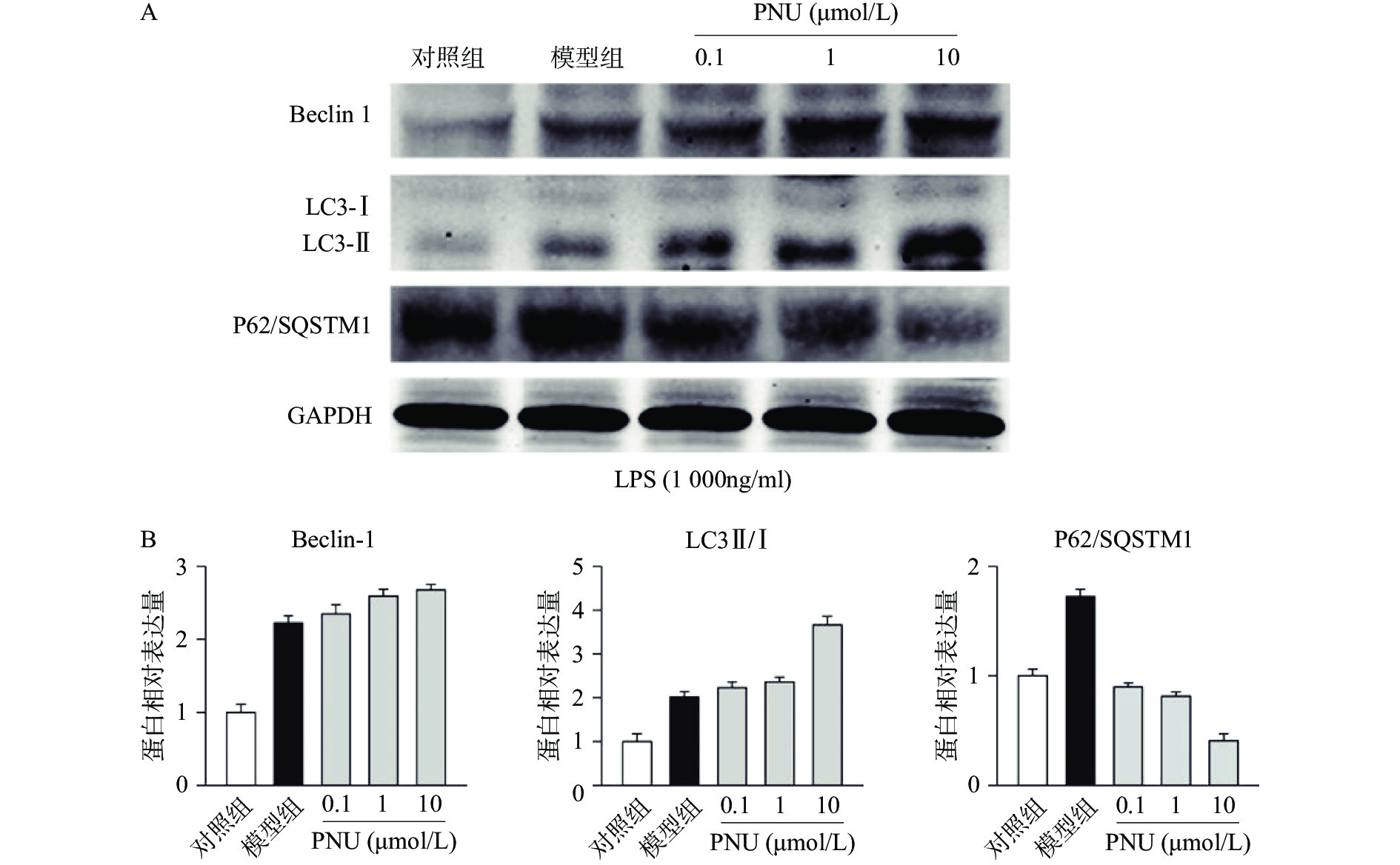
最后,我们探究炎症环境中激动α7 n型乙酰胆碱能受体的抗炎作用是否有自噬过程的参与。选用不同剂量的PNU282987,提前10 min加入PNU282987(0.1、1、10 μmol/L)孵育,后加入LPS(1 000 ng/ml)刺激BV2细胞,刺激12 h后,通过Western blot技术检测BV2细胞中的自噬相关蛋白Beclin 1、LC3-II/I比例、p62/SQSTM1表达水平(图5)。
从图5中可以看出,在LPS的刺激下,小胶质细胞中自噬水平显著增加,而应用PNU282987激动α7 n型乙酰胆碱能受体进一步增加了自噬水平。由此可以看出,炎症环境中激动α7 n型乙酰胆碱能受体可以上调BV2细胞的自噬水平。
-
α7 n型乙酰胆碱能受体介导的胆碱能抗炎通路在多种炎症免疫相关疾病中发挥重要的调节作用。课题组的前期研究发现,在小鼠多发性硬化模型中,激动α7 n型乙酰胆碱能受体可以发挥重要的抑制小胶质细胞炎症的作用[12]。本研究在细胞水平应用小胶质细胞系BV2细胞,再次证明了α7 n型乙酰胆碱能受体的抗小胶质细胞炎症的作用。
对于在小胶质细胞中α7 n型乙酰胆碱能受体抗炎作用的机制,本研究首次表明,其抗炎作用的实现有调节小胶质细胞M1型和M2型巨噬细胞比例的参与,即激动α7 n型乙酰胆碱能受体可以上调具有抗炎作用的M2型巨噬细胞并且下调M1型巨噬细胞的比例。这一结论为利用α7 n型乙酰胆碱能受体激动剂作用治疗相关疾病的药物提供了重要的理论依据。此外,我们也探讨了自噬这一重要的抗炎机制是否参与了这一过程。通过细胞实验得到了肯定的答案,与以往研究相一致,我们证明了上调小胶质细胞的自噬水平发挥抗炎作用。
由此我们得出,激动α7 n型乙酰胆碱能受体可以发挥抑制小胶质细胞炎症反应的作用,其作用的实现依赖于调节小胶质细胞M1型和M2型巨噬细胞比例和上调自噬水平。下一步,我们将通过单核巨噬细胞特异性敲除α7 n型乙酰胆碱能受体的小鼠进行研究,进一步验证激动α7 n型乙酰胆碱能受体是否可以通过调节巨噬细胞比例和自噬水平,进而抑制小胶质细胞炎症发挥作用,使实验结果更具说服力。我们相信,这一研究将为开发利用新的胆碱能抗炎药物提供新的思路。
The anti-inflammatory role of α7 nicotinic acetylcholine receptor in microglial cells and its mechanisms
-
摘要:
目的 小胶质细胞在中枢神经系统的炎症相关疾病中发挥重要作用,旨在研究在炎症环境中α7 n型乙酰胆碱能受体的抗炎作用及机制。 方法 应用PNU282987激动α7 n型乙酰胆碱能受体,应用脂多糖(LPS)造成细胞的炎症模型,通过实时定量PCR技术检测BV2细胞的炎症因子IL-1β、IL-6、TNF-α及M1型巨噬细胞标记物CD68、CD86与M2型巨噬细胞标记物CD206、Arg1的mRNA水平,通过细胞免疫荧光检测M1型及M2型巨噬细胞的比例,通过Western blot技术检测自噬相关蛋白的表达。 结果 在LPS的刺激下,小胶质细胞中促炎因子IL-1β、IL-6、TNF-α的mRNA水平显著增加、M1型巨噬细胞比例显著增加、自噬水平显著上调,而应用PNU282987激动α7 n型乙酰胆碱能受体极大地降低了促炎因子IL-1β、IL-6、TNF-α的mRNA水平、增加M2型巨噬细胞比例、降低M1型巨噬细胞比例,并进一步上调小胶质细胞的自噬水平。 结论 激动α7 n型乙酰胆碱能受体可以发挥抑制小胶质细胞炎症反应的作用,其作用的实现依赖于调节小胶质细胞M1型和M2型巨噬细胞比例和上调自噬水平。 -
关键词:
- α7 n型乙酰胆碱能受体 /
- 小胶质细胞 /
- 炎症 /
- 自噬
Abstract:Objective To investigate the anti-inflammatory role of α7 nicotinic acetylcholine receptor (α7nAChR) under inflammatory stress and its mechanisms. Methods PNU282987 was used for the activation of α7nAChR and LPS was administrated as inflammatory stressor. Realtime PCR was used for the detection of IL-1β, IL-6, TNF-α, M1 macrophage marker CD68, CD86 and M2 macrophage marker CD206, Arg1. Cell immunofluorescence was used for the detection of M1/M2 ratio and Western blot was applied for the detection of autophagy-related proteins. Results Under the stimulation of LPS, the mRNA levels of proinflammatory cytokines IL-1β, IL-6 and TNF-α, the proportion of M1 macrophage and autophagy process were increased in BV2 microglial cells. However, the administration of PNU282987 significantly decreased the mRNA levels of IL-1β, IL-6 and TNF-α and the proportion of M1 macrophage while increased the proportion of M2 macrophage and the level of autophagy process. Conclusion Activating α7nAChR plays an anti-inflammatory role in microglial cells under inflammatory stress due to the regulation of M1/M2 macrophage ratio and increase of autophagy level. -
Key words:
- α7 nicotinic acetylcholine receptor /
- microglial cells /
- inflammation /
- autophagy
-
免疫介导的炎性眼前段疾病(immune-mediated inflammatory anterior ocular diseases,IIAODs)如春季结膜炎、前葡萄膜炎等是临床上较常见的眼科疾病。局部或全身性使用类固醇是控制这类疾病炎症的主要手段。然而,长期使用类固醇可能会导致白内障、青光眼等,从而存在失明的可能。因此,眼科临床越来越频繁地局部使用免疫抑制剂来治疗这类疾病。
他克莫司(tacrolimus,FK506)作为第二代免疫抑制剂代表性药物,是治疗IIAODs的主要方式之一[1-3]。目前国内上市的FK506眼用制剂为日本千寿药业生产的Talymus®,其药效容易受到泪液冲刷的影响而降低。因此,本研究研制了他克莫司阳离子微乳凝胶(FK506-loaded cationic nanoemulsion-based in-situ gel, FK506 CNE GEL),旨在利用该剂型的特性,延长药物在眼部的滞留时间,提高生物利用度,减少给药频次。本文通过HE染色处理的兔眼组织病理切片观察FK506 CNE GEL的眼部刺激性,并通过建立HPLC-MS测定兔眼房水药物浓度的方法,考察其房水药动学。
1. 材料
1.1 仪器
Agilent 1100型高效液相色谱系统(美国安捷伦公司);AL204 电子天平(梅特勒托利多仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(上海精密试验设备有限公司);NS1001L型高压均质机(意大利Niro Soavi公司);85-1型磁力搅拌器(上海志成电器有限公司);CX31光学显微镜(Olympus Corporation);JY92-2D超声波细胞粉碎机(宁波新芝生物科技股份有限公司);H1850R型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);SCIEX QTRAP® 5500 型高压快速液相色谱-三重串联四级杆质谱联用仪(美国AB SCIEX公司)。
1.2 药物与试剂
他克莫司对照品(含量99.3%,福建科瑞药业有限公司);子囊霉素对照品(含量99.5%,上海齐奥化工有限公司);蓖麻油(湖南宏康制药股份有限公司);中链脂肪酸甘油酯(铁岭北亚药用油有限公司);吐温-80(四川金山制药有限公司);泊洛沙姆407、泊洛沙姆188(德国BASF提供);西他氯胺(Sigma-Aldrich);甘油(湖南尔康制药有限公司);注射用水(明澈D24UV);甲醇(上海科丰实业有限公司);他克莫司滴眼液(Talymus®,日本千寿制药株式会社);0.9%氯化钠注射液(国药集团化学试剂有限公司);戊巴比妥钠(Merck 分装);盐酸丙美卡因滴眼液(爱尔凯因®,美国爱尔康眼药厂比利时分厂);其他药品和试剂均为药用规格或分析纯。
1.3 动物
新西兰白兔,雌雄兼用,2.5~3.0 kg,上海斯莱克实验动物有限公司。实验前24 h自由进食、饮水,进行眼部检查以确保无任何眼病。
2. 方法与结果
2.1 FK506 CNE GEL的配制
根据本研究前期报道制备FK506 CNE GEL[4]。首先以蓖麻油(4 %,W/V)、中链脂肪酸甘油酯(6 %,W/V)作为混合油相,西他氯胺(0.02 %,W/V)作为阳离子表面活性剂,吐温−80(1 %,W/V)、泊洛沙姆188(0.1 %,W/V)作为非离子表面活性剂,甘油(2.2 %,W/V)作为渗透压调节剂,通过高压均质制得FK506 CNE(0.1 %,W/V)。而后以26 %泊洛沙姆407和12 %泊洛沙姆188共同作为凝胶基质,将FK506 CNE进一步制备成FK506 CNE GEL(0.1 %,W/V)。
2.2 FK506 CNE GEL的眼部刺激性考察[5-6]
2.2.1 分组给药设计
取实验兔8只,随机分为A、B两组。采用动物同体左右侧自身对比法,A组实验兔左眼滴入FK506 CNEGEL 50 μl,右眼滴入生理盐水50 μl作为对照。B组实验兔左眼滴入市售Talymus® 50 μl,右眼滴入生理盐水50 μl作为对照。给药后使兔眼被动闭合10 s,使药液与局部有充分接触。每日给药3次,连续给药2周。
2.2.2 眼球组织病理切片
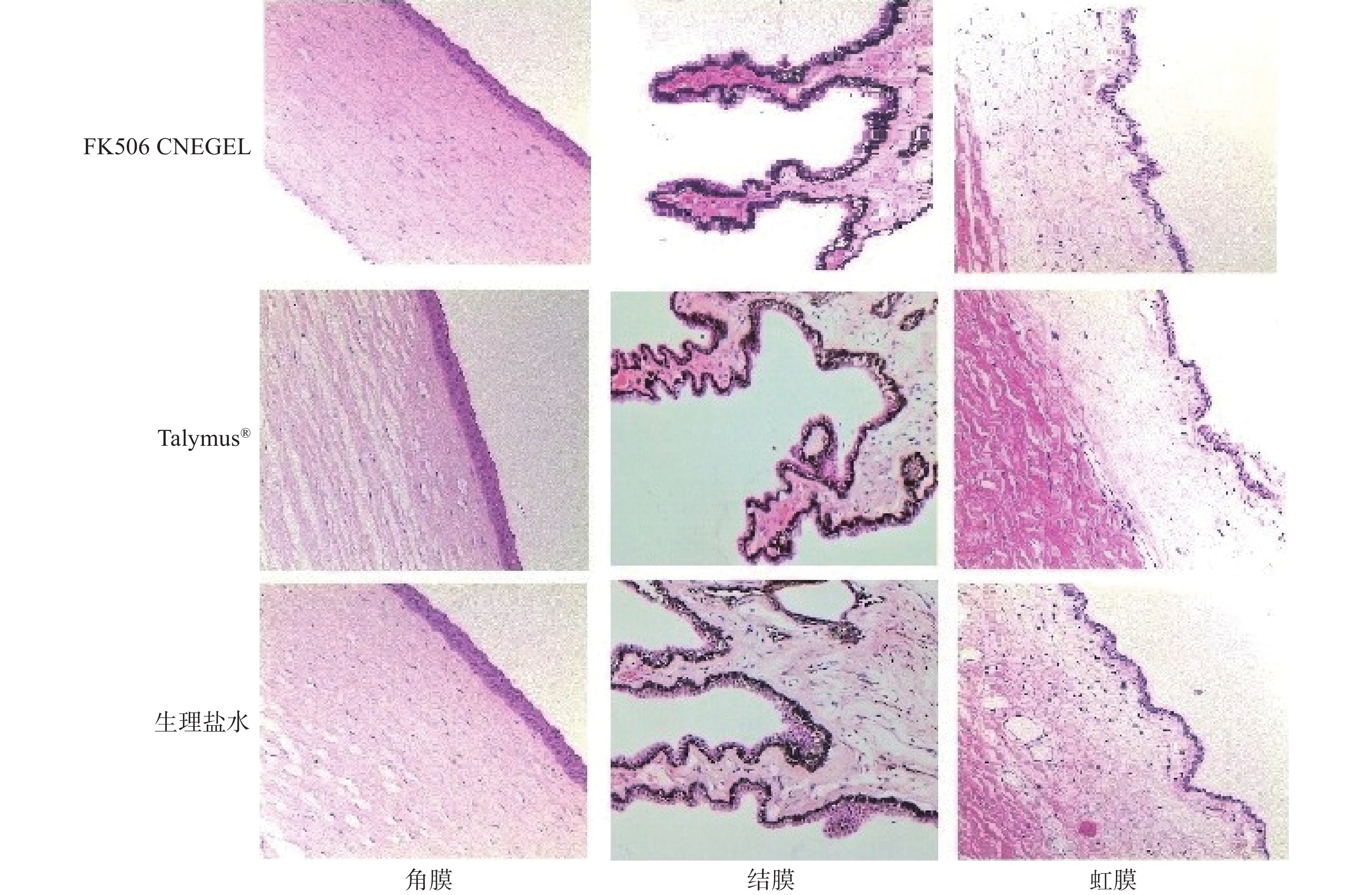
通过耳缘静脉注入空气处死实验兔后取出眼球,进行病理组织切片,详细步骤如下:① 10 %中性福尔马林固定;② 流水冲洗;③ 组织修切平面;④ 组织脱水、石蜡包埋;⑤ 石蜡组织切片;⑥ 二甲苯-无水乙醇脱蜡;⑦ 苏木素-伊红染色;⑧ 小浓度氨水返蓝;⑨ 脱水、复染、洗涤;⑩ 继续脱水后封片。光学显微镜下观察兔眼角膜,虹膜,结膜并拍照,试验结果见图1。
一般情况下,兔眼较人眼对刺激反应更为敏感。图1为显微镜下滴入FK506 CNE GEL、Talymus®及生理盐水后的兔眼角膜、虹膜及结膜结构。对比可见,滴入FK506 CNE GEL后兔眼角膜组织排列规则有序、纹理清晰;虹膜各层组织结构清晰,无明显异常;结膜组织清晰可见,未见坏死及炎性细胞浸润,与生理盐水组及Talymus®组对比无明显差异。结果表明,FK506 CNE GEL对兔眼角膜、虹膜及结膜均无明显刺激性。
2.3 FK506 CNE GEL房水药动学研究[7-10]
2.3.1 色谱条件
采用Agilent 1100型高效液相色谱仪,色谱柱为Agilent Poroshell 120 EC-C18 (2.1 mm×50 mm, 2.7 μm),流动相为甲醇-水(2 mmol/L醋酸铵)(90∶10, v/v),柱温为40 ℃,流速为0.3 ml/min,进样量为1 μl。
2.3.2 质谱条件
采用SCIEX QTRAP® 5500 型高压快速液相色谱-三重串联四级杆质谱联用仪以ESI正离子电离方式检测,扫描方式为多反应监测(MRM),扫描时间为100 ms,离子源电离电压为5 500 V,离子源温度为550 ℃,雾化气流流速为7 L/min。以上述质谱条件对FK506及子囊霉素(ascomycin ,FK520)进行离子扫描,结果如表1所示。根据扫描结果,选择m/z 821.5→768.4 作为 FK506 定量分析离子对,m/z 821.5→576.3 作为其定性分析离子对;选择m/z 809.5→756.5作为FK520定量分析离子对,m/z 809.5→564.3 作为其定性分析离子对。
表 1 FK506和FK520的质谱行为分析参数 FK506 FK520 分子量 804.2 792.4 定性分析的离子反应(m/z) 821.5→576.3 809.5→564.3 碎裂能量(CE, V) 31.2 29.0 定量分析的离子反应(m/z) 821.5→768.4 809.5→756.5 碎裂能量(CE, V) 28.0 26.1 解簇电压(DP, V) 120 45 2.3.3 房水样品的制备
精密移取房水样品30 μl置于2 ml离心管中,加入50 μl FK520内标液(100 ng/ml)及120 μl甲醇,涡旋混合,12 000 r/min离心15 min,取上清液进样分析。
2.3.4 方法专属性考察
取空白房水30 μl,将一定浓度的FK506和FK520标准溶液分别加入空白房水中,按照“2.3.3”项下方法处理,记录谱图。结果如图2所示,表明房水中内源性物质对FK506的测定无干扰,方法专属性良好。
2.3.5 标准曲线和定量限
精密移取空白房水 30 μl置于2 ml离心管中,加入不同量的100 ng/ml FK506标准溶液及50 μl FK520内标液(100 ng/ml),加入甲醇使总量达200 μl制成系列浓度50、25、10、5、2.5、1、0.5 ng/ml的FK506溶液,12 000 r/min离心15 min,液质联用仪进样分析,记录对应图谱。以FK506峰面积Ai与FK520峰面积As的比值Ai/As作为纵坐标,以FK506浓度C(ng/ml)为横坐标进行线性回归,得线性回归方程:A=0.324 75C+0.05577,r=0.999 96。结果表明FK506在0.5~50 ng/ml浓度范围内线性关系良好,定量限为0.5 ng/ml。
2.3.6 方法精密度考察
配制浓度为1、10、30 ng/ml的FK506样品,按照“2.3.3”项下方法处理,于1 d内重复测定5次,连续测定5 d,考察方法的日内、日间精密度。根据测得浓度与理论浓度比值计算方法回收率,结果见表2。结果表明,日内、日间精密度RSD<2%,精密度良好。
表 2 方法精密度试验结果时间 浓度
(ng/ml)序号 平均值 RSD
(%)1 2 3 4 5 日内 1 1.00 0.97 0.98 0.98 0.96 0.98 1.52 10 9.91 9.98 9.92 9.97 9.94 9.94 0.31 30 29.96 29.95 29.96 29.87 29.98 29.94 0.09 日间 1 0.99 0.98 1.97 0.96 1.01 1.18 0.37 10 9.96 9.98 9.95 9.97 9.98 9.97 0.13 30 29.98 29.96 29.96 30.01 29.95 29.97 0.05 2.3.7 方法重复性考察
配制浓度为1、10、30 ng/ml的房水样品各3份,按照“2.3.3”项下方法处理,1 d内测定。结果见表3,表明3个样品浓度RSD<2%,重复性良好。
表 3 方法重复性试验结果浓度
(ng/ml)序号 平均值 RSD
(%)1 2 3 1 0.98 0.96 0.97 0.97 1.03 10 9.97 9.93 9.96 9.95 0.21 30 29.93 29.98 29.92 29.94 0.06 2.3.8 回收率试验
取FK506浓度为1、10、30 ng/ml样品各3份,按照“2.3.3”项下方法处理并测定,记录FK506峰面积为A1;取空白房水同法萃取,于分离的上清液中加入对应浓度等量的FK506和FK520,测定并记录FK506峰面积A2。按提取回收率公式(A1/A2)×100 %算得FK506的提取回收率。结果表明,FK506在各个浓度的提取回收率分别为(78.14±4.21)%、(78.32±4.55)%、(76.56±4.35)%,符合体内药动学研究的相关指标。
2.3.9 分组给药设计
将实验兔随机分成A、B两组,每组6只,共12只。A组实验兔(A1~A6)左眼给予Talymus®,右眼给予自制FK506 CNE;B组实验兔(B1~B6)左眼给予FK506 CNE GEL,右眼给予FK506 CNE。实验前24 h自由进食、饮水,并进行眼部检查,以确保无任何疾病。于给药点用开睑器撑开实验兔眼睑,使用移液枪往实验兔左、右眼分别滴入等量药液50 μl,按压实验兔眼睑使之被动闭合约10 s使药物分布均匀。
2.3.10 统计学分析
采用SPSS统计软件进行独立样本t检验分析,当P<0.05时,统计学有显著性差异。实验数据均以(
$ \bar x \pm s $ )表示。2.3.11 样品采集
提前给予实验兔1 %戊巴比妥钠(0.6 ml/kg)进行耳缘静脉麻醉,并于采样前使用盐酸丙美卡因滴眼液进行局麻。接着,用镊子固定眼球后采用角膜穿刺术抽取房水,分别于给药后0.5、1、1.5、2、2.5、3、4、6、8、10 h时间点采样。A1~A3实验兔于给药后0.5、1.5、2.5、4、8 h各抽取房水30 μl,A4~A6实验兔于给药后1、2、3、6、10 h各抽取房水30 μl。B1~B3实验兔于给药后0.5、1.5、2.5、4、8 h各抽取房水30 μl,B4~B6实验兔于给药后1、2、3、6、10 h各抽取房水30 μl。
2.3.12 数据处理分析
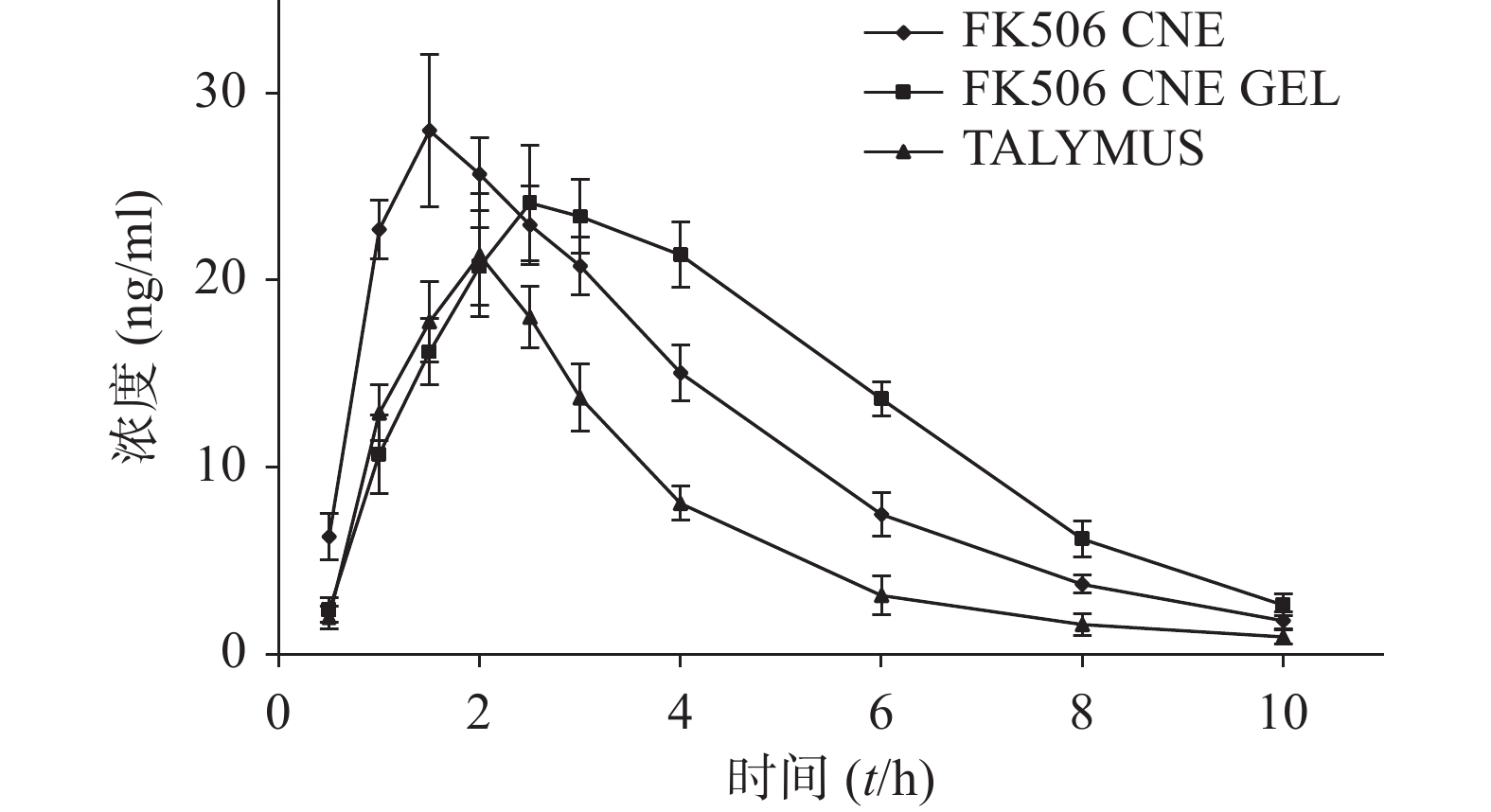
以房水样品中FK506浓度C(ng/ml)为纵坐标,以时间T(h)为横坐标作图,得药-时曲线图3及对应药动学参数表4。
表 4 给予FK506三种制剂后的房水药动学参数(n=3)药动学参数 FK506 CNE Talymus® FK506 CNE GEL AUC(ng·h /ml) 113.61±12.36* 68.25±10.82 128.34±13.09*# c max (ng/ml) 28.02±4.07 21.34±3.31 24.14±3.10 t max (t/h) 1.50±0.20* 2.00±0.17 2.50±0.25*# ka (h-1) 2.16±0.51* 1.14±0.90 0.94±0.08*# ke (h-1) 0.34±0.02* 0.41±0.05 0.32±0.02*# MRT (t/h) 3.46±0.28* 3.23±0.24 4.23±0.34*# *P<0.05,与Talymus®比较;#P<0.05,与FK 506 CNE比较 由表4可见,MRT(CNE GEL)>MRT(CNE)>MRT(Talymus®),即FK506 CNE GEL的平均滞留时间最长,表明FK506 CNE GEL在角膜的滞留时间最长。此外,AUC(Talymus®)为(68.25±10.82) ng·h /ml,AUC(CNE)为(113.61±12.36)ng·h /ml,AUC(CNE GEL)为(128.34±13.09)ng·h /ml。三者对比得AUC(CNE GEL)是AUC(CNE)的1.13倍,是AUC(Talymus®)的1.88倍,说明FK506 CNE GEL的生物利用度较高。
3. 讨论
3.1 FK506 CNE GEL的辅料
FK506 CNE GEL所采用的辅料都是安全、无刺激的,例如采用的阳离子材料为阳离子表面活性剂西他氯胺(CKC)。CKC作为眼药水中常用的防腐剂苯扎氯胺的一个组分,其安全性已得到保证,且CKC在市售产品空白阳离子纳米乳Cationorm®和口腔软膏Bonjela®中广泛使用,其临床安全性得到进一步证实。此外,采用的凝胶基质为P407/P188。由于非离子型表面活性剂泊洛沙姆无毒、无刺激,不仅可以通过空间位阻效应稳定纳米乳而且具有模拟黏膜的性质,是温敏型原位凝胶最常用的凝胶基质,同样安全性也能得到保证。其他辅料如蓖麻油、MCT、吐温-80和甘油均是常用的眼用制剂辅料之一。
3.2 FK506 CNE GEL的药动学参数
药动学参数t max (CNE GEL)>t max (Talymus®)>t max (CNE),说明FK506 CNE GEL的达峰时间最长。这是因为FK506 CNE GEL在角膜表面形成一层凝胶且其所带正电荷能与带负电荷的角膜发生静电吸引作用,从而延长其在眼部的滞留时间,缓慢而持续地释放药物,使药物作用时间延长,达峰时间延迟。而ka (CNE)>ka (Talymus®)>ka (CNE GEL)同样证实了这一点,由于FK506 CNE和Talymus®是水溶性滴眼液,相较于FK506 CNE GEL,释放药物透过角膜被吸收的速度相对较快,故FK506 CNE GEL被吸收的速度最慢。而Talymus®的粒径(1671.5±66.3)nm较FK506 CNE的粒径(178.8±2.7)nm大,故FK506 CNE相较而言吸收快、达峰时间短。
由于泪液冲刷及鼻泪管排泄,房水药物浓度随时间延长而降低。由药时曲线可见,在给药后2~4 h,Talymus®的消除曲线下降趋势最为陡峭,FK506 CNE次之,而FK506 CNE GEL的消除曲线最为平缓。ke (Talymus®)>ke (CNE)>ke (CNE GEL)同样说明FK506 CNE GEL在眼部被消除的速度最慢,相较另外两种制剂而言,明显延缓了药物从前房的消除。
综上所述,FK506 CNE GEL对兔眼无明显刺激性,给药后能黏附于黏膜表面,延长药物作用时间,提高药物生物利用度,减少给药频次。有望成为一种眼部安全性高、滞留时间长的FK506眼用制剂,其研发成功将为眼科临床提供更多选择,为IIAODs患者的临床治疗提供帮助。
-
表 1 实时定量PCR引物序列
引物名称 引物序列 IL-1β (上游) 5′-CTCGTGCTGTCGGACCCCAT-3′ IL-1β (下游) 5′- AGTGTTCGTCTCGTGTTCGGAC-3′ IL-6 (上游) 5′-TAGTCCTTCCTACCCCAATTTCC-3′ IL-6 (下游) 5′-TTGGTCCTTAGCCACTCCTTC-3′ TNF-α (上游) 5′-AAGCCTGTAGCCCACGTCGTA-3′ TNF-α (下游) 5′-GGCACCACTAGTTGGTTGTCTTTG-3′ GAPDH (上游) 5′-GTATGACTCCACTCACGGCAAA-3′ GAPDH (下游) 5′-GGTCTCGCTCCTGGAAGATG-3′ -
[1] SHE H, HE Y, ZHAO Y, et al. Autophagy in inflammation: the p38α MAPK-ULK1 axis[J]. Macrophage,2018,4:1629. [2] LI Q S, CHEN L, LIU X W, et al. Pterostilbene inhibits amyloid-β-induced neuroinflammation in a microglia cell line by inactivating the NLRP3/caspase-1 inflammasome pathway[J]. J Cell Biochem,2018,119(8):7053-7062. doi: 10.1002/jcb.27023 [3] GARRISON A M, PARROTT J M, TUÑON A, et al. Kynurenine pathway metabolic balance influences microglia activity: Targeting kynurenine monooxygenase to dampen neuroinflammation[J]. Psychoneuroendocrinology,2018,94:1-10. doi: 10.1016/j.psyneuen.2018.04.019 [4] KABBANI N, NICHOLS R A. Beyond the channel: metabotropic signaling by nicotinic receptors[J]. Trends Pharmacol Sci,2018,39(4):354-366. doi: 10.1016/j.tips.2018.01.002 [5] HONE A J, MCINTOSH J M. Nicotinic acetylcholine receptors in neuropathic and inflammatory pain[J]. FEBS Lett,2018,592(7):1045-1062. doi: 10.1002/1873-3468.12884 [6] HOOVER D B. Cholinergic modulation of the immune system presents new approaches for treating inflammation[J]. Pharmacol Ther,2017,179:1-16. doi: 10.1016/j.pharmthera.2017.05.002 [7] CHU F, SHI M, ZHENG C, et al. The roles of macrophages and microglia in multiple sclerosis and experimental autoimmune encephalomyelitis[J]. J Neuroimmunol,2018,318:1-7. doi: 10.1016/j.jneuroim.2018.02.015 [8] L'EPISCOPO F, TIROLO C, SERAPIDE M F, et al. Microglia polarization, gene-environment interactions and wnt/β-catenin signaling: emerging roles of Glia-neuron and Glia-stem/neuroprogenitor crosstalk for dopaminergic neurorestoration in aged parkinsonian brain[J]. Front Aging Neurosci,2018,10:12. doi: 10.3389/fnagi.2018.00012 [9] TAKEMURA G, KANAMORI H, OKADA H, et al. Anti-apoptosis in nonmyocytes and pro-autophagy in cardiomyocytes: two strategies against postinfarction heart failure through regulation of cell death/degeneration[J]. Heart Fail Rev,2018,23(5):759-772. doi: 10.1007/s10741-018-9708-x [10] SHAO B Z, HAN B Z, ZENG Y X, et al. The roles of macrophage autophagy in atherosclerosis[J]. Acta Pharmacol Sin,2016,37(2):150-156. doi: 10.1038/aps.2015.87 [11] KE P, SHAO B Z, XU Z Q, et al. Intestinal autophagy and its pharmacological control in inflammatory bowel disease[J]. Front Immunol,2016,7:695. [12] KE P, SHAO B Z, XU Z Q, et al. Activating α7 nicotinic acetylcholine receptor inhibits NLRP3 inflammasome through regulation of β-arrestin-1[J]. CNS Neurosci Ther,2017,23(11):875-884. doi: 10.1111/cns.12758 期刊类型引用(1)
1. 费丽萍,陈志冬,陈金锦,朱冰楠,唐坎凯. α7烟碱型乙酰胆碱受体调控线粒体自噬在脓毒症急性胃肠损伤中的作用机制研究. 现代实用医学. 2023(04): 453-455+561 .  百度学术
百度学术其他类型引用(1)
-





 下载:
下载:
 下载:
下载: