-
苦豆子(Sophora alopecuroides)为豆科(Leguminosae)槐属的草本植物,广泛生长于我国西北地区。在宁夏境内,苦豆子分布面积约为25余万公顷,其中,在盐池县分布14万公顷,占宁夏境内苦豆子总分布面积的56%,是宁夏特有的区域性药用植物[1]。苦豆子具有清热解毒、抗菌消炎的药理作用,临床上用于治疗痢疾、外伤化脓、顽癣等疾病[2]。近年来,随着对苦豆子主要活性成分生物碱的广泛研究,发现其具有缓解肝损伤、抗肝纤维化和抑制肝癌等作用[3]。本文主要对苦豆子活性成分及其防治肝脏疾病的研究进展进行综述,为苦豆子活性成分治疗肝脏疾病的进一步研究提供参考。
-
苦豆子的化学成分丰富且复杂,目前从苦豆子中分离得出的活性成分主要有生物碱、黄酮、挥发油、甾体、多糖、游离脂肪酸等[4]。
-
苦豆子主要活性成分中生物碱含量最高。目前,分离鉴定出的生物碱多达数十种(表1),主要为喹诺里西啶类生物碱,可分为苦参碱型和苦豆碱型。前者主要包含苦参碱(matrine,MT)、氧化苦参碱(oxymatrine,OMT)、槐果碱(sophocarpine,SCA)、槐定碱(sophoridine,SRI),后者有苦豆碱(aloperine,ALO)[5],化学结构见图1。药理学研究表明苦参碱型生物碱具有抗肿瘤[6]、抗炎[7]、抗病毒[8]、抗心律失常[9]等作用。
表 1 部分已分离得出的苦豆子生物碱
编号 苦豆子生物碱 文献 1 苦参碱(matrine) [10] 2 氧化苦参碱 (oxymatrine) [11] 3 槐果碱 (sophocarpine) [10] 4 槐定碱 (sophoridine) [10] 5 苦豆碱 (aloperine) [11] 6 莱曼碱 (lehmannine) [12] 7 槐胺碱 (sophoramine) [11] 8 新槐安碱 (neosophoramin) [11] 9 7α-羟基槐胺碱 (7α-hydroxysophoramine) [10] 10 3α-羟基槐定碱 (3α-hydroxy-sophoridine) [11] 11 9α-羟基槐胺碱 (9α-hydroxysophoramine) [10] 12 13,14-去氢槐定碱 ((−)-13,14-dehydrosophoridine) [13] 13 N-羟基槐定碱 (N-hydroxy-sophoridine) [13] 14 12-β羟基槐果碱 (12β-hydroxysophocarpine) [10] 15 9α-羟基苦参碱 (9α-hydroxy-matrine) [13] 16 14-β羟基苦参碱 (14β-hydroxy-matrine) [10] 17 氧化槐定碱 (oxysophoridine) [11] 18 氧化槐果碱 (oxysophocarpine) [11] 19 N-甲基苦豆碱 (N-methyl-aloperine) [11] 20 赝靛叶碱 (baptifoline) [10] 21 臭豆碱 (anagyrine) [11] 22 金雀花碱 (cytisine) [11] 23 甲基金雀花碱 (N-methyl-cytisine) [11] 24 羟乙花碱 (N-2-hydroxyethyl-cytisine) [2] 25 尼古丁 (nicotine) [11] 26 腺荚豆碱 (adenocarpine) [10] 27 三巴豆四胺 (tricrotonytetramine) [13] -
黄酮是苦豆子另一主要活性成分。李敏等[14]从新疆苦豆子中分离鉴定出3′,4′-二羟基异黄酮-7-O-β-D-吡喃葡萄糖苷、7,3′-二羟基二氢黄酮-4′-O-β-D-吡喃葡萄糖苷及芦丁3种成分。卞海涛等[15]从苦豆子中首次分离得到5,6-二羟基-3,7,3′,4′-四甲氧基黄酮、β-胡萝卜苷、3′-甲氧基木犀草素3种成分。苦豆子黄酮类成分具有抗炎[14]、降血糖[16]、抗病毒和抗菌[17]等药理作用。
-
马别厚等[18]采用GC-MS研究苦豆子豆籽油化学成分,分离得到了豆甾醇、麦角甾醇等5种甾体化合物;张建华等[19]从苦豆子中检测出谷氨酸、精氨酸、苏氨酸、胱氨酸等16种氨基酸。并且苦豆子中谷氨酸可以促进人体内消化液的分泌,具有预防贫血和解毒的作用。除此之外,还有脂肪酸、挥发油、多糖等化学成分,其中,多糖具有免疫调节、抗氧化、抗炎、抗肿瘤等生物活性[20-21]。
-
病毒性肝炎是由多种肝炎病毒引起的以肝脏病变为主的传染病,其中,慢性乙型肝炎(CHB)感染是一个非常严峻的世界公共卫生问题,其发病率呈逐年上升趋势。目前,拉米夫定等临床常用药物非但不能彻底清除乙肝病毒(HBV),而且长期使用还会产生明显的耐药问题,难以取得令人满意的治疗效果。近年来,越来越多的研究表明,传统中药苦豆子在抗乙肝药物研究中具有独特优势,从中药宝库中寻找天然抗病毒活性部位或活性成分,已成为发掘新药的重要途径之一。
赵义勇等[17]利用苦豆子总黄酮提取物对鸭乙型肝炎进行治疗,结果发现该提取物在体外能够剂量依赖地抑制细胞内HBV-DNA的表达,表现出较强的体外抗病毒活性;在体内实验中,该提取物可明显降低鸭血清中DHBV-DNA的水平,提示苦豆子总黄酮对鸭乙型肝炎有很好的治疗作用。除此之外,王浩等[22]研究发现,采取拉米夫定联合氧化苦参碱对慢性乙型肝炎患者进行治疗,结果发现患者外周血单核细胞中Toll样受体9(TLR9)信号通路关键分子的mRNA和蛋白表达增加,血清抗病毒细胞因子水平显著升高。该研究提示拉米夫定联合氧化苦参碱能够发挥有效的抗HBV作用,其机制与激活TLR9信号通路、诱导抗病毒细胞因子释放有关。不仅如此,王青等[23]研究还发现氧化苦参碱和阿德福韦酯均可抑制HepG2.2.15细胞HBV-DNA的分泌,抑制乙肝表面抗体HBeAg、HBsAg表达;而氧化苦参碱亦可显著降低HepG2.2.15细胞内HBV rcDNA以及cccDNA的水平,引起pgRNA水平的增加,这些结果提示氧化苦参碱的抗HBV的作用环节可能位于cccDNA转录形成pgRNA之后至子代病毒形成之前,有必要对HBV的复制包装过程进行详细分解做进一步研究。
-
非酒精性脂肪性肝病(NAFLD)是指除酒精和其他明确的损肝因素外所致的以肝细胞内脂肪过度沉积为主要特征的临床病理综合征。近年来随着对其发病机制的深入了解,抗NAFLD新药不断发现,科学家从苦豆子中提取的生物碱、黄酮类、酚类等中药成分具有较明确的抗氧化作用,具有毒副作用小等多种独特优势,成为治疗NAFLD的研究热点之一。
宋春艳等[24]利用槐果碱对非酒精性脂肪性肝炎小鼠进行干预,结果发现槐果碱可显著抑制小鼠体内白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、转化生长因子-β1(TGF-β1)的表达,缓解小鼠非酒精性脂肪性肝炎。该研究提示槐果碱可能通过抑制炎症细胞因子的合成来减轻肝细胞内线粒体的损伤,从而减轻肝细胞的毒性损伤。此外,史丽娟等[25-26]实验研究发现氧化苦参碱可抑制脂质从头合成途径,同时降低了NAFLD大鼠的固醇调节元件结合转录因子1(Srebf1)的mRNA表达,增加过氧化物酶体增殖物激活受体α(Pparα)的mRNA表达。提示氧化苦参碱对NAFLD大鼠肝脏脂肪变性的治疗作用可能与下调Srebf1和上调Pparα介导的代谢途径相关。除了氧化苦参碱,唐彬等[27]通过实验发现苦参碱对NAFLD大鼠同样具有显著疗效,其能够降低高脂饮食大鼠肝组织中三酰甘油、总胆固醇的含量,抑制炎症损伤,降低肝脏环氧化物酶(COX-2)、诱导型一氧化氮合酶(iNOS)的表达水平。研究结果提示苦参碱对NAFLD大鼠的治疗作用可能与抑制COX-2、iNOS 表达,阻止炎症发生和抗氧化相关。
-
肝纤维化是各种病因所致慢性肝损伤的修复反应,其主要特征是细胞外基质(extra-cellular matrix,ECM)在肝内的过度沉积,导致肝脏结构改变和肝功能丧失。目前研究认为,肝星状细胞(hepatic stellate cell,HSC)活化是肝纤维化的核心事件,而持续炎症是HSC活化的主要诱因。HSC是肝脏中产生胶原纤维的主要细胞,在肝脏受损时激活,分化成为肌成纤维样细胞,分泌大量细胞因子、趋化因子和生长因子,并产生大量的ECM,从而促进肝纤维化的发生和发展。肝纤维化持续进展会发展为肝硬化甚至肝癌,病死率极高,因此,逆转肝纤维化对于预防肝硬化和肝癌具有重要意义。目前临床上治疗肝纤维化的传统中药包括苦参碱和氧化苦参碱类生物碱。
杨增玺等[28]通过研究发现不同剂量苦参碱作用4周后可减轻CCl4诱导的肝纤维化小鼠肝脏的纤维化程度,抑制肝细胞变性、坏死和炎性细胞浸润以及胶原纤维沉积。苦参碱可抑制HSC的活化和增殖,减少α-平滑肌激动蛋白的表达,保护肝细胞,同时抑制小鼠肝脏中TGF-β1和血小板衍生生长因子-B(PDGF-B)的表达,从而产生抗肝纤维化作用。此外,闫冰川等[29]研究发现苦参碱联合扁桃苷用药可以改善CCl4肝纤维化模型小鼠的精神、活动、毛色和饮食状况,明显降低小鼠血中谷丙转氨酶(ALT)、谷草转氨酶(AST)的水平,表明两者联用可以发挥改善肝纤维化的效果。临床研究发现[30],171位肝炎和肝硬化患者通过静脉注射 400 mg/d苦参素注射液后发现肝纤维化程度降低,表明氧化苦参碱具有逆转肝纤维化作用。除此之外,另一项研究发现氧化苦参碱可降低TGF-β1和TNF-α的水平,抑制HSC的活化,减少ECM的释放,同时增加患者血清中IL-10的水平,进而减轻肝炎症状、改善肝功能,预防肝纤维化[31]。
-
肝硬化(liver cirrhosis)是临床常见的慢性进行性肝病,是由一种或多种病因长期或反复作用形成的弥漫性肝损害。目前对于肝硬化并没有特效的治疗手段,干扰素α及核苷和核苷酸类抗病毒药物存在应答率低、药物难取得、并发症风险高、耐药和治疗成本高等问题[32],很难取得良好的治疗效果。药理学研究表明,苦豆子中的生物碱成分可能会对肝硬化起到治疗作用[33]。
毛丽萍等[34]研究发现,乙肝肝硬化患者在经过苦参碱治疗1个月后,其外周血自然杀伤细胞(NK细胞)表面活化性受体NKG2D表达水平有所增加,提示具有免疫调节作用的苦参碱可以上调乙肝肝硬化患者NKG2D的表达水平,从而减少乙肝肝硬化患者发展至肝癌的概率。
此外,祝尔健等[35]通过研究发现,肝硬化患者应用苦参碱治疗8周后,其患者体内ALT、AST、血清总胆红素(TBil)水平均较单纯护肝患者明显降低;苦参碱治疗后患者的HBV-DNA、HBeAg阴转率均高于单纯护肝患者。该研究提示治疗肝硬化过程中,有必要在护肝治疗的同时联用安全、有效的药物苦参碱。
-
肝衰竭(hepatic failure)是由多种因素引起的严重肝损伤,临床主要表现为黄疸、凝血功能障碍、肝肾综合征、肝性脑病、腹水等症状。目前治疗肝衰竭的药物有核苷类药物、N-乙酰半胱氨酸、肾上腺皮质激素等[36]。但皮质激素治疗肝衰竭存在不良反应多、药物用量和作用时机难以把握等问题[37]。药物疗效并不理想,因此,肝衰竭治疗药物的研究迫在眉睫,而苦豆子生物碱在肝衰竭防治方面具有开发前景。
张弦等[38]研究发现,氧化苦参碱能够明显改善脂多糖/D-氨基半乳糖(LPS/D-GalN)诱导的大鼠急性肝衰竭肝脏的病变,降低肝脏转氨酶,并通过抑制急性肝衰竭大鼠肝组织TLR4的表达,降低TNF-α、IL-1β和半胱氨酸天冬氨酸蛋白酶3(caspases-3)的表达水平以及Bax/Bcl-2的比例,从而产生抑制肝细胞凋亡的作用,保护肝细胞。其另一项研究[39]发现,氧化苦参碱联合复方茵陈颗粒(FYK)预处理可减轻急性肝衰竭大鼠的肝损伤程度,同时降低肝衰竭的发生率。除此之外,向晓星[40]等的研究结果同样证实氧化苦参碱对于肝衰竭具有保护作用。
-
据2020年WHO报道,肝细胞癌(hepatocellular carcinoma,HCC)发病率居全球第6位、病死率居全球第3位。2020年我国发病例数和死亡人数分别多达41万和39万,HCC的发病率约占全球43%,由此看来,我国HCC的病情形势非常严峻。临床上一般采取肝脏切除和移植、局部消融或动脉化疗栓塞等方法治疗[41]。国内外大量研究报道,许多中药成分及天然产物也具有抗肿瘤的作用,其中,苦豆子的生物碱成分便是其中之一。
杨晓娟等[42]将0~4 mg/ml的苦参碱加入到HepG2和BEL-7404肝癌细胞中,结果发现苦参碱能够以时间和浓度依赖性的方式抑制肝癌细胞增殖,并诱导其凋亡。机制研究发现其可能通过激活p38/JNK信号通路,下调抑凋亡基因Bcl-2和上调促凋亡基因Bax及caspases 3的表达来诱导肝癌细胞凋亡。此外,Liu等[43]研究发现苦豆碱能够剂量依赖性地抑制Hep3B和Huh7肝癌细胞的增殖、诱导肝癌细胞凋亡和G2/M细胞周期阻滞。另一项研究报道[44],0~20 mg/ml槐定碱可通过增强抑癌基因PTEN的表达,抑制PI3K/AKT信号通路的激活,同时增加caspases 3/9)和基质金属蛋白酶3/9(MMP3/9)的蛋白表达,最终抑制HepG2细胞的增殖、侵袭和迁移,并诱导细胞凋亡。Zhang等[45]报道1000 μmol/L槐果碱能够显著抑制HCC-LM3和MHCC-97H的细胞增殖率,使细胞周期阻滞在G0/G1期。其作用机制是通过抑制AKT/GSK3β/β-catenin轴和TGF-β诱导的肝癌细胞的上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)发挥治疗肝癌的作用。
-
近年来,随着新药研发和临床需求的不断扩大,苦豆子作为传统中药,其抗炎、抗病毒、抗肿瘤和免疫调节等药理作用不断被发现。本文就宁夏苦豆子中的主要成分及其在治疗肝脏疾病中的活性作用进行了综述,发现苦豆子在治疗病毒性肝炎、非酒精性肝病、肝纤维化、肝硬化、肝衰竭、肝细胞癌等疾病中可能发挥重要作用,其中,苦参碱(斯巴特康)注射液已于临床用于急、慢性肝炎、肝硬化及其他肝胆疾病的治疗。
尽管国内外对苦豆子的研究不断增多,但是关于苦豆子的药物研究和开发仍然存在诸多问题,如黄酮、挥发油类等研究还较少,对苦参碱(素)类药物的临床副反应还不明确,药物和药物之间可能存在的相互作用尚未清楚,对活性成分在不同组织中的分子靶点和作用机制的研究不够深入,对苦豆子药动学的临床研究不够充分等。因此,迫切需要科研力量的投入,系统开展苦豆子基础研究,建立一套以宁夏苦豆子活性成分为主的肝病防治药物创新技术体系和苦豆子产业发展的关键技术体系,为宁夏苦豆子的资源利用和高技术产品开发奠定坚实的技术基础。
Research progresses on the main active components in Ningxia Sophora alopecuroides and the therapeutic activities for liver diseases
-
摘要: 苦豆子是豆科槐属植物,为宁夏的道地药材之一。苦豆子有着丰富而复杂的活性成分,主要有生物碱、黄酮、挥发油、甾体、多糖、脂肪酸等。近年来,国内外对苦豆子生物碱开展了大量研究,该类生物碱具有抗肝炎、抗肝纤维化、抗肝硬化、抗肝衰竭、抗肝癌等药理作用,其中,苦参碱相关药物已经获批在临床用于治疗乙型肝炎病毒感染等疾病。鉴于苦豆子在肝脏疾病治疗中的药用价值,对苦豆子主要活性成分进行综述,重点阐述其治疗肝脏疾病的研究进展。Abstract: Sophora alopecuroides, a plant of the family Leguminosae, is one of the Daodi herbs in Ningxia. The active constituents of Sophora alopecuroides are abundant and complex, including alkaloids, flavonoids, volatile oils, steroids, polysaccharides, fatty acids and so on. In recent decades, a great number of domestic and overseas studies have been carried out on Sophora alopecuroides alkaloids, which have anti-hepatitis, anti-liver fibrosis, anti-cirrhosis, anti-liver failure and anti-liver cancer and other pharmacological effects. Clinically, Matrine-related drugs are used to treat hepatitis B virus infection and other diseases. This review aims to summarize the main active ingredients of Sophora alopecuroides, mainly focusing on the research progress in their treatment activities for liver diseases.
-
Key words:
- Ningxia Sophora alopecuroides /
- active constituents /
- hepatic disease /
- research progress
-
三阴性乳腺癌(triple-negative breast cancer,TNBC)临床特点表现为转移能力强、复发率高和患者预后差,是目前威胁女性健康常见的恶性肿瘤之一[1-3]。由于其细胞表面不表达孕酮受体、雌激素受体以及表皮生长因子受体,使得常规靶向疗法对TNBC收效甚微,目前临床治疗手段仍以传统的化疗为主。然而TNBC除了不表达多种激素受体外,往往也伴随着乳腺癌基因(breast cancer gene,BRCA)等多种基因的突变[4-6],导致其成为一种高度异质性的肿瘤类型,易对化疗药物产生抗性,进一步增加了治疗难度。
代谢旺盛的肿瘤细胞能量供应高度依赖有氧糖酵解产生的ATP,越来越多的研究表明,线粒体氧化磷酸化(oxidative phosphorylation,OXPHOS)对肿瘤细胞糖类、脂类及蛋白质类三大营养物质的相互转化和氧化还原反应的平衡有着重要的作用[7-8]。在多种流行病学、临床和实验室研究中证实,糖代谢抑制剂、线粒体呼吸链阻滞剂等具有显著的抗肿瘤作用[9]。因此,在正常细胞可承受范围内,靶向破坏肿瘤细胞的糖代谢以及干扰呼吸链的电子传递,是目前肿瘤治疗的新策略。
二甲双胍以其良好的安全性和耐受性,在糖尿病临床治疗中被广泛应用[10]。越来越多的研究表明,以二甲双胍为代表的双胍类药物对多种肿瘤具有抑制作用[11-12]。苯乙双胍是比二甲双胍作用强50倍的线粒体复合物I抑制剂[13]。然而,苯乙双胍作为一种抗肿瘤药物却难以获得各国药品管理部门的批准,主要原因是其副作用会产生大量的乳酸,易引起严重的乳酸性酸血症[14-16]。因此,联用其他辅助药物以降低苯乙双胍的使用剂量,在可控的不良反应内达到有效的抗肿瘤作用,是目前肿瘤临床治疗研究的新策略。
笔者将以肿瘤细胞能量代谢为突破点,研究低剂量的苯乙双胍联合己糖激酶抑制剂2-DG对TNBC的治疗作用,为将来针对TNBC的耐药和复发而进行的临床治疗提供新的策略。
1. 材料
1.1 实验动物及细胞
40只SPF级雌性6周龄BALB/c小鼠,体质量(20±2)g,购自浙江省实验动物中心,许可证号:SCXK(浙)2016-0002。小鼠三阴性乳腺癌细胞系4T1和人三阴性乳腺癌细胞系MBA-MD-231(中国医学科学院基础医学研究所细胞资源中心)。
1.2 实验试剂
苯乙双胍(Selleck公司);2-脱氧葡萄糖(Sigma公司);RNA反转录试剂盒(ABI公司);FITC-annexin Ⅴ/PI凋亡染色试剂盒(BD公司);葡萄糖含量检测试剂盒、乳酸含量(LA)检测试剂盒(北京索莱宝科技有限公司);海马细胞线粒体压力检测试剂盒(Agilent公司)。
2. 方法
2.1 细胞分组及药物处理
分别将1×105个4T1或MDA-MB-231细胞接种到6孔板中,每组设3个复孔。实验分为空白对照组、苯乙双胍(100 μmol/L)组、2-DG(2 mmol/L)组和联用组(苯乙双胍:10 μmol/L;2-DG:200 μmol/L)。作用48 h后,用0.25%的胰蛋白酶消化细胞,获得单细胞悬液,用于后续的细胞增殖和凋亡检测。
2.2 流式细胞仪检测细胞凋亡
药物处理细胞48 h后,收集各组细胞悬液,4℃ 500×g离心5 min。弃上清液,每管加入1 ml冷PBS重悬细胞,离心后弃上清液,清洗细胞。加入100 μl 1×偶联缓冲液重悬细胞,然后每管分别加入2 μl annexin Ⅴ和PI,4℃避光孵育30 min。加入400 μl PBS重悬细胞,流式细胞仪检测各组细胞凋亡的情况。
2.3 葡萄糖和乳酸浓度的测定
各组细胞处理48 h后,收集细胞培养上清液,分别用葡萄糖含量检测试剂盒和乳酸含量检测试剂盒测定葡萄糖和乳酸浓度,同时收集细胞并计数。
2.4 线粒体耗氧量(OCR)的测定
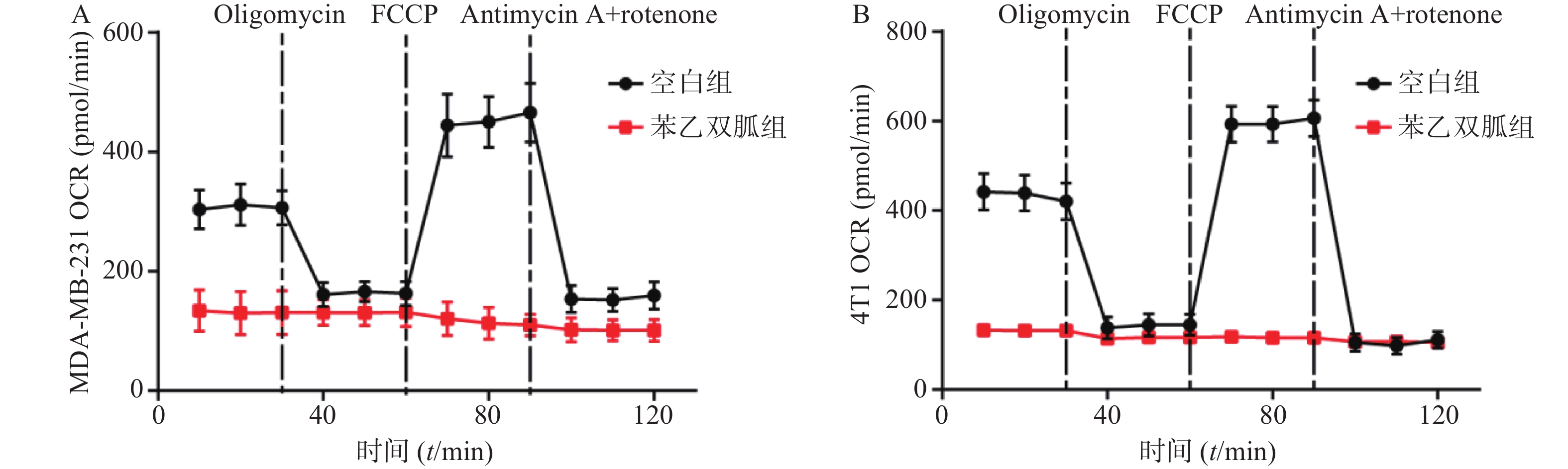
用海马细胞线粒体压力检测试剂盒测定4T1或MDA-MB-231细胞的线粒体OCR。细胞用药物预处理24 h,在评估前8 h,以6×105个细胞/孔的最佳培养密度将细胞转移到XF微板上,使细胞贴壁。用调节好pH 7.4的培养基对细胞进行清洗,在无CO2培养箱中平衡1 h。ABC孔分别加入寡霉素、线粒体解偶联剂(FCCP)、鱼藤酮和抗霉素A后,上机检测。
2.5 动物实验的分组及处理
分为空白(PBS)组、苯乙双胍(1 mg/kg)组、2-DG(5 mg/kg)组和联用组(苯乙双胍:0.1 mg/kg;2-DG:0.5 mg/kg),每组10只小鼠。1×105个 4T1细胞原位接种到BALB/c小鼠乳腺脂肪垫内,待肿瘤生长至5 mm×5 mm左右时,荷瘤小鼠开始给药治疗,并每天测量肿瘤的大小。各给药组小鼠按50 μl体积瘤内注射给予,对照组给予等体积的PBS,每2 d给药1次。连续给药10次后,观察荷瘤小鼠的肿瘤大小并记录各组小鼠的死亡时间。
3. 统计学分析
采用SPSS 22.0软件进行统计学分析。实验数据用(
$\bar x $ ±s )表示,两组间比较用t检验,多组的组间比较采用单因素方差分析,动物生存时间比较采用Kaplan-Meier法。4. 结果
4.1 苯乙双胍下调4T1或MDA-MB-231细胞线粒体OCR
为检测苯乙双胍对线粒体呼吸的影响,将100 μmol/L苯乙双胍分别作用于4T1和MDA-MB-231细胞,24 h后收获细胞,海马生物能量分析仪检测细胞OCR水平。结果表明,苯乙双胍孵育24 h后,MDA-MB-231或4T1细胞线粒体OCR与空白组相比显著降低(图1)。
4.2 苯乙双胍对4T1或MDA-MB-231细胞有氧糖酵解的影响
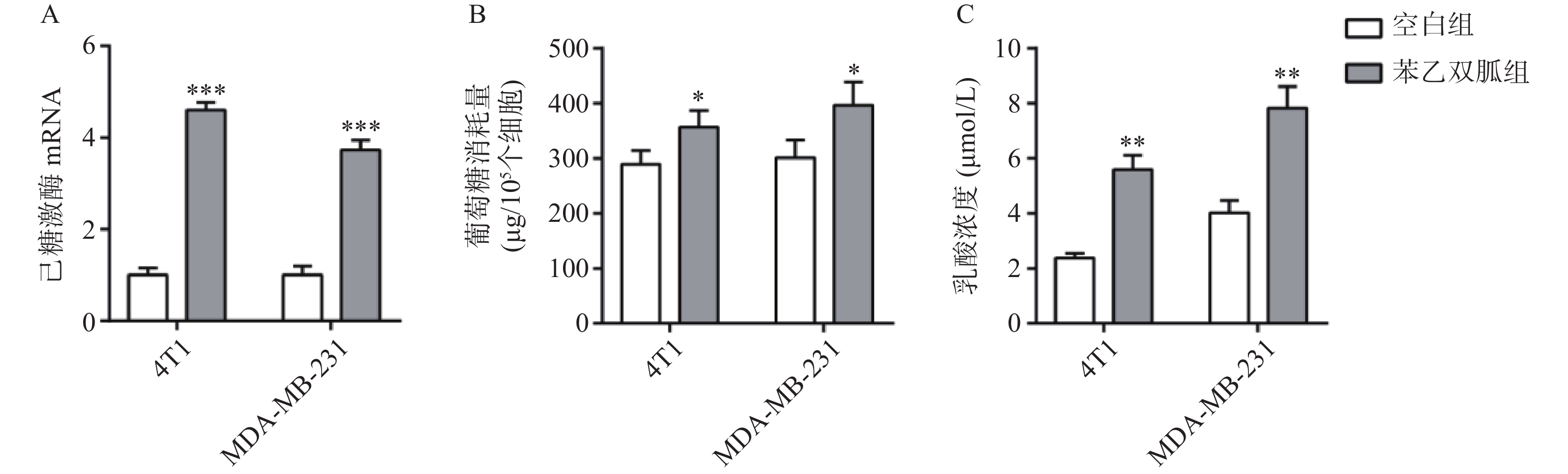
100 μmol/L苯乙双胍处理4T1和MDA-MB-231细胞48 h后,检测细胞上清液中己糖激酶表达量、葡萄糖以及乳酸浓度。结果显示,4T1和MDA-MB-231细胞上清液中己糖激酶表达量,苯乙双胍给药组(4.6±0.17,3.73±0.21,n=3)明显高于空白组(1±0.15,1±0.12, n=3),组间有显著性差异(P<0. 001),表明苯乙双胍可在基因水平显著上调己糖激酶的表达(图2A);4T1和MDA-MB-231细胞上清中葡萄糖消耗量,苯乙双胍给药组(356±31,397±42,n=3)μg/105个细胞明显高于空白组(289±25,301±32,n=3)μg/105细胞,组间有显著性差异(P < 0. 05),表明苯乙双胍能促进细胞摄取更多的葡萄糖,致使培养基中葡萄糖含量显著增加(图2B);4T1和MDA-MB-231细胞上清中乳酸浓度,苯乙双胍给药组(5.59±0.52, 7.83±0.78, n=3)μmol/L明显高于空白组(2.37±0.18,4.01±0.45,n=3)μmol/L,组间有显著性差异(P < 0.01),表明苯乙双胍能显著促进培养上清液中乳酸的产生(图2C)。
4.3 苯乙双胍联合2-DG诱导三阴性乳腺癌细胞凋亡
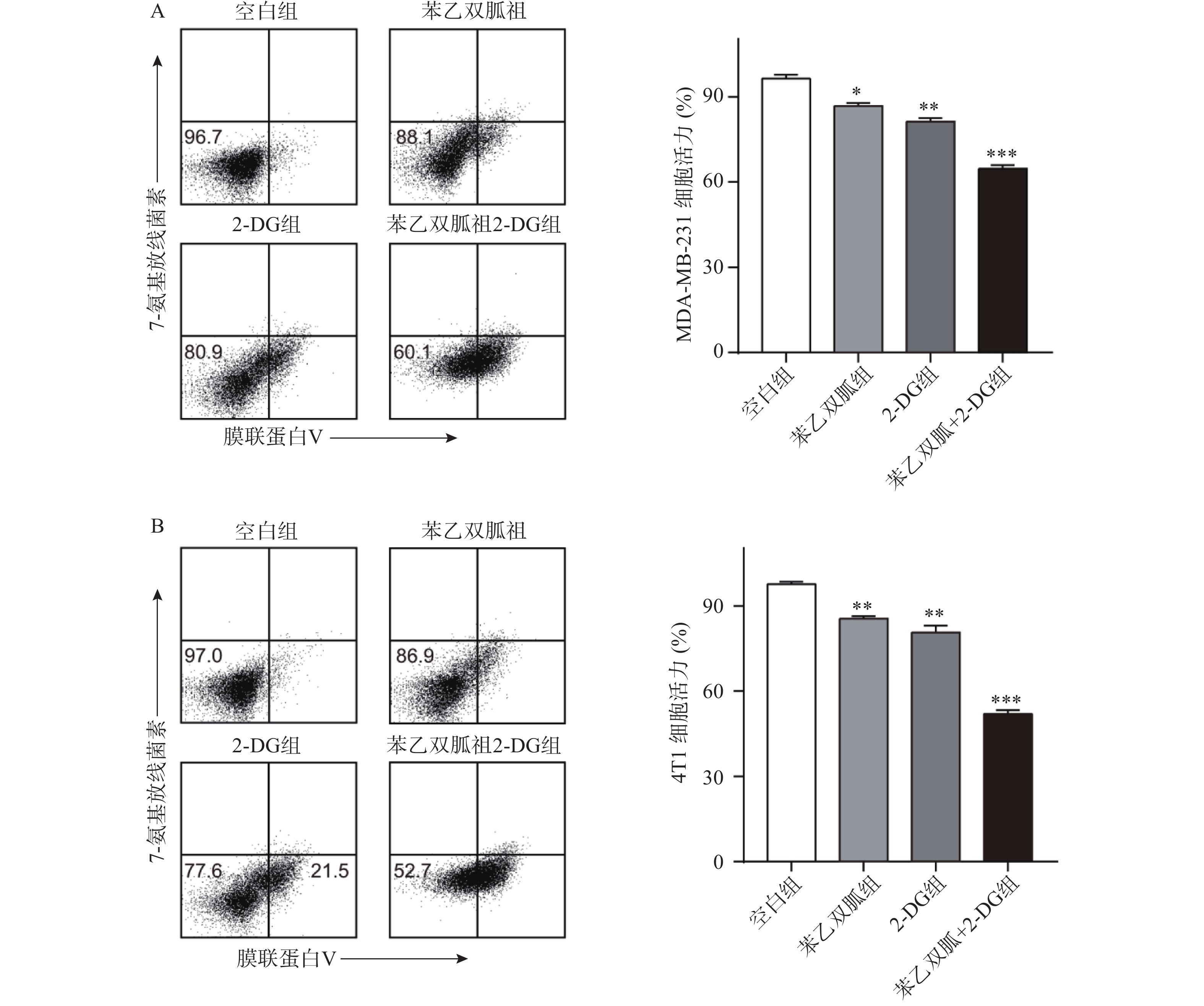
由于苯乙双胍可上调4T1和MDA-MB-231细胞的有氧糖酵解,因此当我们联用低剂量的己糖激酶抑制剂2-DG时,三阴性乳腺癌细胞会发生什么变化呢?结果显示,与空白组相比,单用苯乙双胍或2-DG均能显著降低4T1与MDA-MB-231细胞存活率(P<0.01)(表1,图3);与苯乙双胍或2-DG单药组相比,苯乙双胍联用2-DG,即使降低90%剂量,仍然可以显著降低4T1与MDA-MB-231细胞的存活率(P<0.001)(表1,图3),以上结果表明,苯乙双胍联用2-DG能显著促进三阴性乳腺癌细胞的凋亡。与此同时,检测细胞上清液中的乳酸含量,相比苯乙双胍组(5.59±0.52,7.83±0.78,n=3)μmol/L,苯乙双胍与2-DG联用组(3.46±0.37,5.18±0.62,n=3)μmol/L细胞的乳酸产量也大幅下降(P < 0.01)(图4)。
表 1 苯乙双胍联合2-DG对三阴性乳腺癌细胞凋亡的影响[`x±s , n = 3,存活率(%)]组别 4T1 MDA-MB-231 空白组(PBS) 96.37±2.31 97.63±1.46 苯乙双胍组(100 μmol/L) 86.70±1.83 * 85.53±1.46 ** 2-DG(2 mmol/L) 81.27±2.16** 80.67±4.07** 苯乙双胍+2-DG组(苯乙双胍:
10 μmol/L,2-DG: 200 μmol/L)64.63±2.28*** 51.97±2.29*** *P<0. 05,**P<0.01,***P<0.001,与空白组比较 4.4 苯乙双胍联用2-DG显著抑制4T1肿瘤的生长
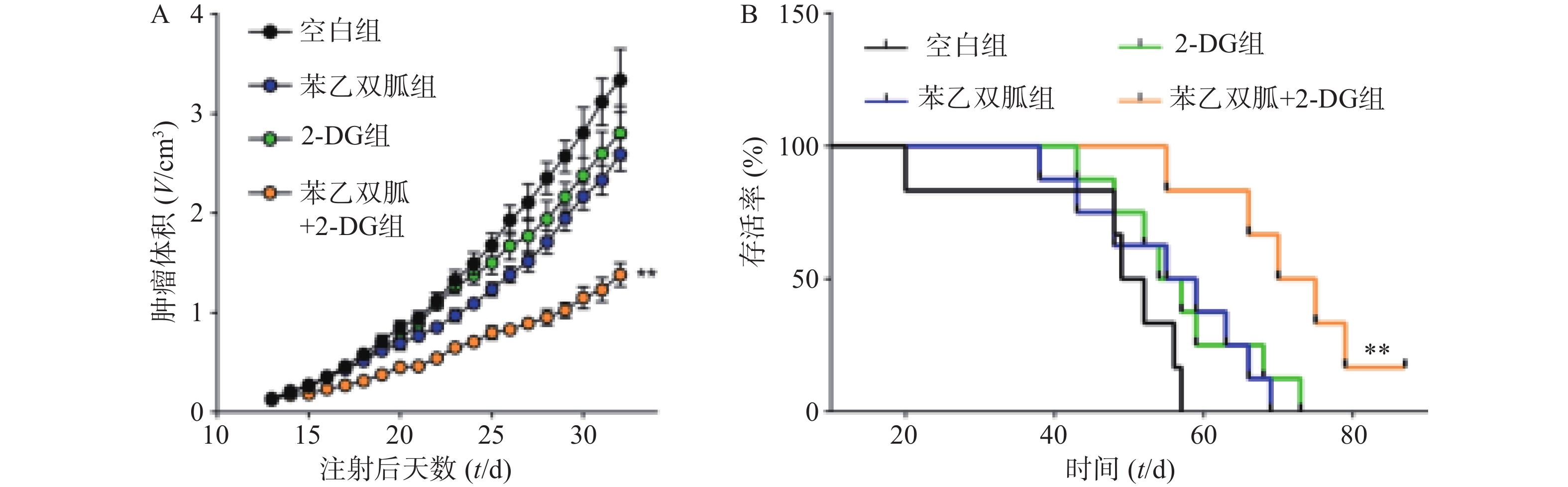
为了进一步验证苯乙双胍联合2-DG在体内抗肿瘤的效果,我们将4T1细胞原位接种到小鼠乳腺脂肪垫中,并分别给予单药治疗或联合治疗,观察肿瘤的生长速度以及荷瘤小鼠的生存时间。结果显示,与苯乙双胍或2-DG单药组相比,苯乙双胍联合2-DG组可显著抑制荷瘤小鼠体内肿瘤的生长速度(P<0.01)(图5A)。此外,苯乙双胍联合2-DG组荷瘤小鼠中位生存时间为72.5 d,高于苯乙双胍组(57 d)、2-DG组(55.5 d)、空白组组(50.5 d),差异有统计学意义(P<0.01)(图5B),表明苯乙双胍联合2-DG可以延长荷瘤小鼠生存时间。
5. 讨论
二甲双胍等双胍类糖尿病治疗药物,能够通过抑制线粒体复合物I来降低细胞内ATP水平。线粒体复合物I的损伤会降低NADH氧化为NAD+,这是维持TCA循环功能的关键反应,并最终导致抑制氧化磷酸化。前期研究表明,二甲双胍表现出显著的抗肿瘤作用。苯乙双胍与二甲双胍具有非常相似的代谢特征,而苯乙双胍的效力更强[17-18]。由于乳酸性酸中毒病死率高,2型糖尿病临床治疗不再使用苯乙双胍作为一线药物[19]。 然而作为一种抗癌药物,因其较低的有效剂量和较短的疗程,与糖尿病临床治疗大有不同,苯乙双胍被认为最有希望替代二甲双胍的双胍类药物[20-22]。
本研究采用小鼠三阴性乳腺癌细胞系4T1和人三阴性乳腺癌细胞系MBA-MD-231作为研究对象,发现苯乙双胍可显著抑制其线粒体氧化磷酸化,并上调肿瘤细胞的糖酵解。当加入己糖激酶抑制剂2-DG时,糖酵解途径被阻断,肿瘤细胞被迫使用氧化磷酸化来获取ATP,在此情况下,细胞对苯乙双胍更加敏感。基于该项发现,采用苯乙双胍联用2-DG治疗三阴性乳腺癌细胞。动物体内外结果表明,苯乙双胍联用2-DG可显著增加4T1细胞和MBA-MD-231细胞的死亡率,并延长荷瘤小鼠的生存时间。除了对这两种糖代谢方式双重抑制作用外,联用2-DG带来的另一个优势是可大大降低苯乙双胍的使用剂量,从而减轻苯乙双胍代谢产生的乳酸对机体的不良作用。
综上所述,通过苯乙双胍联用2-DG,可显著增强苯乙双胍对三阴性乳腺癌的凋亡作用,并降低其使用剂量,减轻不良反应,这一发现为三阴性乳腺癌的临床治疗提供新的策略。
-
表 1 部分已分离得出的苦豆子生物碱
编号 苦豆子生物碱 文献 1 苦参碱(matrine) [10] 2 氧化苦参碱 (oxymatrine) [11] 3 槐果碱 (sophocarpine) [10] 4 槐定碱 (sophoridine) [10] 5 苦豆碱 (aloperine) [11] 6 莱曼碱 (lehmannine) [12] 7 槐胺碱 (sophoramine) [11] 8 新槐安碱 (neosophoramin) [11] 9 7α-羟基槐胺碱 (7α-hydroxysophoramine) [10] 10 3α-羟基槐定碱 (3α-hydroxy-sophoridine) [11] 11 9α-羟基槐胺碱 (9α-hydroxysophoramine) [10] 12 13,14-去氢槐定碱 ((−)-13,14-dehydrosophoridine) [13] 13 N-羟基槐定碱 (N-hydroxy-sophoridine) [13] 14 12-β羟基槐果碱 (12β-hydroxysophocarpine) [10] 15 9α-羟基苦参碱 (9α-hydroxy-matrine) [13] 16 14-β羟基苦参碱 (14β-hydroxy-matrine) [10] 17 氧化槐定碱 (oxysophoridine) [11] 18 氧化槐果碱 (oxysophocarpine) [11] 19 N-甲基苦豆碱 (N-methyl-aloperine) [11] 20 赝靛叶碱 (baptifoline) [10] 21 臭豆碱 (anagyrine) [11] 22 金雀花碱 (cytisine) [11] 23 甲基金雀花碱 (N-methyl-cytisine) [11] 24 羟乙花碱 (N-2-hydroxyethyl-cytisine) [2] 25 尼古丁 (nicotine) [11] 26 腺荚豆碱 (adenocarpine) [10] 27 三巴豆四胺 (tricrotonytetramine) [13] -
[1] 邢世瑞. 宁夏中药志-下卷[M]. 2版. 银川: 宁夏人民出版社, 2006. [2] 郝伟亮, 孟根达来, 解红霞. 苦豆子的化学成分及药理作用研究进展[J]. 中国药房, 2016, 27(13):1848-1850. doi: 10.6039/j.issn.1001-0408.2016.13.35 [3] 于蕾, 张连芳, 东方, 等. 苦豆子中主要生物碱药理作用的研究进展[J]. 北京联合大学学报(自然科学版), 2015, 29(2):61-66. [4] WANG R Z, DENG X X, GAO Q X, et al. Sophora alopecuroides L. : an ethnopharmacological, phytochemical, and pharmacological review[J]. J Ethnopharmacol,2020,248:112172. doi: 10.1016/j.jep.2019.112172 [5] YANG L, GUAN W, JIE L, et al. Quinolizidine alkaloids derivatives from Sophora alopecuroides Linn: Bioactivities, structure-activity relationships and preliminary molecular mechanisms[J]. Eur J Med Chem,2020,188:111972. doi: 10.1016/j.ejmech.2019.111972 [6] 任莉莉. 苦参碱抗肿瘤作用及其机制研究进展[J]. 中国医师杂志, 2012(2):281-283. doi: 10.3760/cma.j.issn.1008-1372.2012.02.051 [7] HE L J, LIU J S, LUO D, et al. Quinolizidine alkaloids from Sophora tonkinensis and their anti-inflammatory activities[J]. Fitoterapia,2019,139:104391. doi: 10.1016/j.fitote.2019.104391 [8] ZHANG Y B, LUO D, YANG L, et al. Matrine-type alkaloids from the roots of Sophora flavescens and their antiviral activities against the hepatitis B virus[J]. J Nat Prod,2018,81(10):2259-2265. doi: 10.1021/acs.jnatprod.8b00576 [9] ZHOU Y, WU Y, DENG L, et al. The alkaloid matrine of the root of Sophora flavescens prevents arrhythmogenic effect of ouabain[J]. Phytomedicine,2014,21(7):931-935. doi: 10.1016/j.phymed.2014.02.008 [10] ATTA-UR-RAHMAN, CHOUDHARY M I, PARVEZ K, et al. Quinolizidine alkaloids from Sophora alopecuroides[J]. J Nat Prod,2000,63(2):190-192. doi: 10.1021/np990351v [11] 牟新利, 王武宝, 巴杭, 等. 中药苦豆子化学成分及生理活性的研究进展[J]. 新疆师范大学学报(自然科学版), 2005, 24(1):45-50. [12] 宋丽军, 梁丽萍, 赵淑敏, 等. 一测多评法测定苦豆子总生物碱中6种成分的含量[J]. 中药材, 2017, 40(6):1380-1383. [13] 游菁菁, 李月英, 沙碧莹, 等. 中药苦豆子生物碱的研究进展[J]. 江西中医药大学学报, 2015, 27(2):109-113,116. [14] 热孜古丽·克依木, 李敏, 热娜·卡斯木, 等. 新疆苦豆子中黄酮类化学成分的研究[J]. 新疆医科大学学报, 2012, 35(5):591-593. doi: 10.3969/j.issn.1009-5551.2012.05.007 [15] 卞海涛, 赵军, 黄华, 等. 苦豆子化学成分研究[J]. 中药材, 2014, 37(1):72-73. [16] LV Y, ZHAO P, PANG K J, et al. Antidiabetic effect of a flavonoid-rich extract from Sophora alopecuroides L. in HFD-and STZ-induced diabetic mice through PKC/GLUT4 pathway and regulating PPARα and PPARγ expression[J]. J Ethnopharmacol,2021,268:113654. doi: 10.1016/j.jep.2020.113654 [17] 赵义勇, 杨巧丽, 李壮, 等. 苦豆子总黄酮对乙肝病毒复制的影响[J]. 中国民族民间医药, 2017, 26(17):21-24. [18] 马别厚, 张尊听. 苦豆子豆籽油化学成分研究[J]. 天然产物研究与开发, 2003, 15(2):133-134. doi: 10.3969/j.issn.1001-6880.2003.02.013 [19] 李艳艳, 冯俊涛, 张兴, 等. 苦豆子化学成分及其生物活性研究进展[J]. 西北农业学报, 2005, 14(2):133-136,140. doi: 10.3969/j.issn.1004-1389.2005.02.031 [20] 陈冠, 赵振宇, 傅予, 等. 苦豆子多糖SAP的结构表征及其对CT26抗肿瘤活性研究[J]. 中草药, 2017, 48(6):1103-1107. [21] WU Y, GUO R, CAO N N, et al. A systematical rheological study of polysaccharide from Sophora alopecuroides L. seeds[J]. Carbohydr Polym,2018,180:63-71. doi: 10.1016/j.carbpol.2017.10.007 [22] 王浩, 高淑林, 杨晶晶. 氧化苦参碱联合拉米夫定对慢性乙型肝炎患者TLR9信号通路的影响[J]. 河北医药, 2016, 38(2):187-190. [23] 王青. 氧化苦参碱体外抗乙型肝炎病毒作用机制的初步研究[D]. 上海: 第二军医大学, 2007: 1-50. [24] 宋春艳. 槐果碱对非酒精性脂肪性肝炎防治作用的实验研究[D]. 上海: 第二军医大学, 2009: 1-64. [25] 史丽娟. 氧化苦参碱改善非酒精性脂肪肝大鼠肝脂沉积的机制探讨[D]. 石家庄: 河北医科大学, 2013: 1-141. [26] SHI L J, SHI L, SONG G Y, et al. Oxymatrine attenuates hepatic steatosis in non-alcoholic fatty liver disease rats fed with high fructose diet through inhibition of sterol regulatory element binding transcription factor 1 (Srebf1) and activation of peroxisome proliferator activated receptor alpha (Pparα)[J]. Eur J Pharmacol,2013,714(1-3):89-95. doi: 10.1016/j.ejphar.2013.06.013 [27] 唐彬. 苦参碱对NASH大鼠氧化应激的影响以及NASH患者氧化应激相关指标的检测及意义[D]. 北京: 北京协和医学院, 2013:1-46. [28] 杨增玺. 苦参碱对肝纤维化小鼠α-SMA、TGF-β1及PDGF-B调节作用的研究[D]. 兰州: 兰州大学, 2012: 1-33. [29] 闫冰川, 江鹏, 江伟炽, 等. 苦参素联合扁桃苷治疗小鼠肝纤维化的相关研究[J]. 新中医, 2018, 50(12):25-27. [30] 孙永年, 黄长形, 黄祝青. 苦参素对慢性乙型肝炎患者血清TGF-β1、TNF-α及肝纤维化指标的影响[J]. 武警医学, 2003, 14(9):531-534. doi: 10.3969/j.issn.1004-3594.2003.09.007 [31] 梁建新, 屈杏芬, 曾文铤, 等. 氧化苦参碱在治疗慢性乙型肝炎中抗肝纤维化的作用机制[J]. 南方医科大学学报, 2010, 30(8):1871-1873. doi: 10.12122/j.issn.1673-4254.2010.08.030 [32] 吴钦梅, 尤红. 中国乙型病毒性肝炎肝硬化研究现状[J]. 中国病毒病杂志, 2014, 4(1):7-10. [33] JIANG X, XIE L, HUANG C, et al. Oral oxymatrine for hepatitis B cirrhosis: a systematic review protocol[J]. Medicine (Baltimore),2018,97(49):e13482. doi: 10.1097/MD.0000000000013482 [34] 毛莉萍, 王越, 章幼奕, 等. 苦参碱治疗对乙肝肝硬化患者自然杀伤细胞表型变化的影响[J]. 中药药理与临床, 2016, 32(1):178-181. [35] 祝尔健, 朴云峰, 丁百静, 等. 苦参碱治疗乙型肝炎后肝硬化近期疗效观察[J]. 中国老年学杂志, 2008, 28(6):611-612. doi: 10.3969/j.issn.1005-9202.2008.06.046 [36] 苏毅. 急性肝衰竭的病因与治疗研究现状[J]. 中国实用医药, 2019, 14(19):194-195. [37] 范文瀚, 罗怡平, 李成忠. 糖皮质激素应用于肝衰竭治疗机制及其临床时机的把握[J]. 实用肝脏病杂志, 2020, 23(1):7-9. doi: 10.3969/j.issn.1672-5069.2020.01.004 [38] 张弦, 蒋道荣, 赵华, 等. 苦参素联合复方茵陈颗粒预处理对大鼠急性肝衰竭的防治作用观察[J]. 山东医药, 2017, 57(15):37-40. doi: 10.3969/j.issn.1002-266X.2017.15.010 [39] 张弦. TLR4介导的信号通路对肝细胞凋亡的影响及氧化苦参碱的干预机制研究[D]. 苏州: 苏州大学, 2016: 1-163. [40] 向晓星. 氧化苦参碱治疗重型肝炎的实验与临床研究[D]. 上海: 第二军医大学, 2001: 1-78. [41] DAWKINS J, WEBSTER R M. The hepatocellular carcinoma market[J]. Nat Rev Drug Discov,2019,18(1):13-14. doi: 10.1038/nrd.2018.146 [42] 杨晓娟. 苦参碱通过p38/JNK信号通路对肝癌细胞增殖及凋亡的影响[D]. 兰州: 甘肃中医药大学, 2020:1-53. [43] LIU J S, HUO C Y, CAO H H, et al. Aloperine induces apoptosis and G2/M cell cycle arrest in hepatocellular carcinoma cells through the PI3K/Akt signaling pathway[J]. Phytomedicine,2019,61:152843. doi: 10.1016/j.phymed.2019.152843 [44] WANG B, XU J, WANG H, et al. Effect and Mechanism of Sophoridine to suppress Hepatocellular carcinoma in vitro and vivo[J]. Biomed Pharmacother,2017,95:324-330. doi: 10.1016/j.biopha.2017.08.029 [45] ZHANG P P, WANG P Q, QIAO C P, et al. Differentiation therapy of hepatocellular carcinoma by inhibiting the activity of AKT/GSK-3β/β-catenin axis and TGF-β induced EMT with sophocarpine[J]. Cancer Lett,2016,376(1):95-103. doi: 10.1016/j.canlet.2016.01.011 -






 下载:
下载:


 下载:
下载:


