-
苦豆子(Sophora alopecuroides)为豆科(Leguminosae)槐属的草本植物,广泛生长于我国西北地区。在宁夏境内,苦豆子分布面积约为25余万公顷,其中,在盐池县分布14万公顷,占宁夏境内苦豆子总分布面积的56%,是宁夏特有的区域性药用植物[1]。苦豆子具有清热解毒、抗菌消炎的药理作用,临床上用于治疗痢疾、外伤化脓、顽癣等疾病[2]。近年来,随着对苦豆子主要活性成分生物碱的广泛研究,发现其具有缓解肝损伤、抗肝纤维化和抑制肝癌等作用[3]。本文主要对苦豆子活性成分及其防治肝脏疾病的研究进展进行综述,为苦豆子活性成分治疗肝脏疾病的进一步研究提供参考。
-
苦豆子的化学成分丰富且复杂,目前从苦豆子中分离得出的活性成分主要有生物碱、黄酮、挥发油、甾体、多糖、游离脂肪酸等[4]。
-
苦豆子主要活性成分中生物碱含量最高。目前,分离鉴定出的生物碱多达数十种(表1),主要为喹诺里西啶类生物碱,可分为苦参碱型和苦豆碱型。前者主要包含苦参碱(matrine,MT)、氧化苦参碱(oxymatrine,OMT)、槐果碱(sophocarpine,SCA)、槐定碱(sophoridine,SRI),后者有苦豆碱(aloperine,ALO)[5],化学结构见图1。药理学研究表明苦参碱型生物碱具有抗肿瘤[6]、抗炎[7]、抗病毒[8]、抗心律失常[9]等作用。
表 1 部分已分离得出的苦豆子生物碱
编号 苦豆子生物碱 文献 1 苦参碱(matrine) [10] 2 氧化苦参碱 (oxymatrine) [11] 3 槐果碱 (sophocarpine) [10] 4 槐定碱 (sophoridine) [10] 5 苦豆碱 (aloperine) [11] 6 莱曼碱 (lehmannine) [12] 7 槐胺碱 (sophoramine) [11] 8 新槐安碱 (neosophoramin) [11] 9 7α-羟基槐胺碱 (7α-hydroxysophoramine) [10] 10 3α-羟基槐定碱 (3α-hydroxy-sophoridine) [11] 11 9α-羟基槐胺碱 (9α-hydroxysophoramine) [10] 12 13,14-去氢槐定碱 ((−)-13,14-dehydrosophoridine) [13] 13 N-羟基槐定碱 (N-hydroxy-sophoridine) [13] 14 12-β羟基槐果碱 (12β-hydroxysophocarpine) [10] 15 9α-羟基苦参碱 (9α-hydroxy-matrine) [13] 16 14-β羟基苦参碱 (14β-hydroxy-matrine) [10] 17 氧化槐定碱 (oxysophoridine) [11] 18 氧化槐果碱 (oxysophocarpine) [11] 19 N-甲基苦豆碱 (N-methyl-aloperine) [11] 20 赝靛叶碱 (baptifoline) [10] 21 臭豆碱 (anagyrine) [11] 22 金雀花碱 (cytisine) [11] 23 甲基金雀花碱 (N-methyl-cytisine) [11] 24 羟乙花碱 (N-2-hydroxyethyl-cytisine) [2] 25 尼古丁 (nicotine) [11] 26 腺荚豆碱 (adenocarpine) [10] 27 三巴豆四胺 (tricrotonytetramine) [13] -
黄酮是苦豆子另一主要活性成分。李敏等[14]从新疆苦豆子中分离鉴定出3′,4′-二羟基异黄酮-7-O-β-D-吡喃葡萄糖苷、7,3′-二羟基二氢黄酮-4′-O-β-D-吡喃葡萄糖苷及芦丁3种成分。卞海涛等[15]从苦豆子中首次分离得到5,6-二羟基-3,7,3′,4′-四甲氧基黄酮、β-胡萝卜苷、3′-甲氧基木犀草素3种成分。苦豆子黄酮类成分具有抗炎[14]、降血糖[16]、抗病毒和抗菌[17]等药理作用。
-
马别厚等[18]采用GC-MS研究苦豆子豆籽油化学成分,分离得到了豆甾醇、麦角甾醇等5种甾体化合物;张建华等[19]从苦豆子中检测出谷氨酸、精氨酸、苏氨酸、胱氨酸等16种氨基酸。并且苦豆子中谷氨酸可以促进人体内消化液的分泌,具有预防贫血和解毒的作用。除此之外,还有脂肪酸、挥发油、多糖等化学成分,其中,多糖具有免疫调节、抗氧化、抗炎、抗肿瘤等生物活性[20-21]。
-
病毒性肝炎是由多种肝炎病毒引起的以肝脏病变为主的传染病,其中,慢性乙型肝炎(CHB)感染是一个非常严峻的世界公共卫生问题,其发病率呈逐年上升趋势。目前,拉米夫定等临床常用药物非但不能彻底清除乙肝病毒(HBV),而且长期使用还会产生明显的耐药问题,难以取得令人满意的治疗效果。近年来,越来越多的研究表明,传统中药苦豆子在抗乙肝药物研究中具有独特优势,从中药宝库中寻找天然抗病毒活性部位或活性成分,已成为发掘新药的重要途径之一。
赵义勇等[17]利用苦豆子总黄酮提取物对鸭乙型肝炎进行治疗,结果发现该提取物在体外能够剂量依赖地抑制细胞内HBV-DNA的表达,表现出较强的体外抗病毒活性;在体内实验中,该提取物可明显降低鸭血清中DHBV-DNA的水平,提示苦豆子总黄酮对鸭乙型肝炎有很好的治疗作用。除此之外,王浩等[22]研究发现,采取拉米夫定联合氧化苦参碱对慢性乙型肝炎患者进行治疗,结果发现患者外周血单核细胞中Toll样受体9(TLR9)信号通路关键分子的mRNA和蛋白表达增加,血清抗病毒细胞因子水平显著升高。该研究提示拉米夫定联合氧化苦参碱能够发挥有效的抗HBV作用,其机制与激活TLR9信号通路、诱导抗病毒细胞因子释放有关。不仅如此,王青等[23]研究还发现氧化苦参碱和阿德福韦酯均可抑制HepG2.2.15细胞HBV-DNA的分泌,抑制乙肝表面抗体HBeAg、HBsAg表达;而氧化苦参碱亦可显著降低HepG2.2.15细胞内HBV rcDNA以及cccDNA的水平,引起pgRNA水平的增加,这些结果提示氧化苦参碱的抗HBV的作用环节可能位于cccDNA转录形成pgRNA之后至子代病毒形成之前,有必要对HBV的复制包装过程进行详细分解做进一步研究。
-
非酒精性脂肪性肝病(NAFLD)是指除酒精和其他明确的损肝因素外所致的以肝细胞内脂肪过度沉积为主要特征的临床病理综合征。近年来随着对其发病机制的深入了解,抗NAFLD新药不断发现,科学家从苦豆子中提取的生物碱、黄酮类、酚类等中药成分具有较明确的抗氧化作用,具有毒副作用小等多种独特优势,成为治疗NAFLD的研究热点之一。
宋春艳等[24]利用槐果碱对非酒精性脂肪性肝炎小鼠进行干预,结果发现槐果碱可显著抑制小鼠体内白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、转化生长因子-β1(TGF-β1)的表达,缓解小鼠非酒精性脂肪性肝炎。该研究提示槐果碱可能通过抑制炎症细胞因子的合成来减轻肝细胞内线粒体的损伤,从而减轻肝细胞的毒性损伤。此外,史丽娟等[25-26]实验研究发现氧化苦参碱可抑制脂质从头合成途径,同时降低了NAFLD大鼠的固醇调节元件结合转录因子1(Srebf1)的mRNA表达,增加过氧化物酶体增殖物激活受体α(Pparα)的mRNA表达。提示氧化苦参碱对NAFLD大鼠肝脏脂肪变性的治疗作用可能与下调Srebf1和上调Pparα介导的代谢途径相关。除了氧化苦参碱,唐彬等[27]通过实验发现苦参碱对NAFLD大鼠同样具有显著疗效,其能够降低高脂饮食大鼠肝组织中三酰甘油、总胆固醇的含量,抑制炎症损伤,降低肝脏环氧化物酶(COX-2)、诱导型一氧化氮合酶(iNOS)的表达水平。研究结果提示苦参碱对NAFLD大鼠的治疗作用可能与抑制COX-2、iNOS 表达,阻止炎症发生和抗氧化相关。
-
肝纤维化是各种病因所致慢性肝损伤的修复反应,其主要特征是细胞外基质(extra-cellular matrix,ECM)在肝内的过度沉积,导致肝脏结构改变和肝功能丧失。目前研究认为,肝星状细胞(hepatic stellate cell,HSC)活化是肝纤维化的核心事件,而持续炎症是HSC活化的主要诱因。HSC是肝脏中产生胶原纤维的主要细胞,在肝脏受损时激活,分化成为肌成纤维样细胞,分泌大量细胞因子、趋化因子和生长因子,并产生大量的ECM,从而促进肝纤维化的发生和发展。肝纤维化持续进展会发展为肝硬化甚至肝癌,病死率极高,因此,逆转肝纤维化对于预防肝硬化和肝癌具有重要意义。目前临床上治疗肝纤维化的传统中药包括苦参碱和氧化苦参碱类生物碱。
杨增玺等[28]通过研究发现不同剂量苦参碱作用4周后可减轻CCl4诱导的肝纤维化小鼠肝脏的纤维化程度,抑制肝细胞变性、坏死和炎性细胞浸润以及胶原纤维沉积。苦参碱可抑制HSC的活化和增殖,减少α-平滑肌激动蛋白的表达,保护肝细胞,同时抑制小鼠肝脏中TGF-β1和血小板衍生生长因子-B(PDGF-B)的表达,从而产生抗肝纤维化作用。此外,闫冰川等[29]研究发现苦参碱联合扁桃苷用药可以改善CCl4肝纤维化模型小鼠的精神、活动、毛色和饮食状况,明显降低小鼠血中谷丙转氨酶(ALT)、谷草转氨酶(AST)的水平,表明两者联用可以发挥改善肝纤维化的效果。临床研究发现[30],171位肝炎和肝硬化患者通过静脉注射 400 mg/d苦参素注射液后发现肝纤维化程度降低,表明氧化苦参碱具有逆转肝纤维化作用。除此之外,另一项研究发现氧化苦参碱可降低TGF-β1和TNF-α的水平,抑制HSC的活化,减少ECM的释放,同时增加患者血清中IL-10的水平,进而减轻肝炎症状、改善肝功能,预防肝纤维化[31]。
-
肝硬化(liver cirrhosis)是临床常见的慢性进行性肝病,是由一种或多种病因长期或反复作用形成的弥漫性肝损害。目前对于肝硬化并没有特效的治疗手段,干扰素α及核苷和核苷酸类抗病毒药物存在应答率低、药物难取得、并发症风险高、耐药和治疗成本高等问题[32],很难取得良好的治疗效果。药理学研究表明,苦豆子中的生物碱成分可能会对肝硬化起到治疗作用[33]。
毛丽萍等[34]研究发现,乙肝肝硬化患者在经过苦参碱治疗1个月后,其外周血自然杀伤细胞(NK细胞)表面活化性受体NKG2D表达水平有所增加,提示具有免疫调节作用的苦参碱可以上调乙肝肝硬化患者NKG2D的表达水平,从而减少乙肝肝硬化患者发展至肝癌的概率。
此外,祝尔健等[35]通过研究发现,肝硬化患者应用苦参碱治疗8周后,其患者体内ALT、AST、血清总胆红素(TBil)水平均较单纯护肝患者明显降低;苦参碱治疗后患者的HBV-DNA、HBeAg阴转率均高于单纯护肝患者。该研究提示治疗肝硬化过程中,有必要在护肝治疗的同时联用安全、有效的药物苦参碱。
-
肝衰竭(hepatic failure)是由多种因素引起的严重肝损伤,临床主要表现为黄疸、凝血功能障碍、肝肾综合征、肝性脑病、腹水等症状。目前治疗肝衰竭的药物有核苷类药物、N-乙酰半胱氨酸、肾上腺皮质激素等[36]。但皮质激素治疗肝衰竭存在不良反应多、药物用量和作用时机难以把握等问题[37]。药物疗效并不理想,因此,肝衰竭治疗药物的研究迫在眉睫,而苦豆子生物碱在肝衰竭防治方面具有开发前景。
张弦等[38]研究发现,氧化苦参碱能够明显改善脂多糖/D-氨基半乳糖(LPS/D-GalN)诱导的大鼠急性肝衰竭肝脏的病变,降低肝脏转氨酶,并通过抑制急性肝衰竭大鼠肝组织TLR4的表达,降低TNF-α、IL-1β和半胱氨酸天冬氨酸蛋白酶3(caspases-3)的表达水平以及Bax/Bcl-2的比例,从而产生抑制肝细胞凋亡的作用,保护肝细胞。其另一项研究[39]发现,氧化苦参碱联合复方茵陈颗粒(FYK)预处理可减轻急性肝衰竭大鼠的肝损伤程度,同时降低肝衰竭的发生率。除此之外,向晓星[40]等的研究结果同样证实氧化苦参碱对于肝衰竭具有保护作用。
-
据2020年WHO报道,肝细胞癌(hepatocellular carcinoma,HCC)发病率居全球第6位、病死率居全球第3位。2020年我国发病例数和死亡人数分别多达41万和39万,HCC的发病率约占全球43%,由此看来,我国HCC的病情形势非常严峻。临床上一般采取肝脏切除和移植、局部消融或动脉化疗栓塞等方法治疗[41]。国内外大量研究报道,许多中药成分及天然产物也具有抗肿瘤的作用,其中,苦豆子的生物碱成分便是其中之一。
杨晓娟等[42]将0~4 mg/ml的苦参碱加入到HepG2和BEL-7404肝癌细胞中,结果发现苦参碱能够以时间和浓度依赖性的方式抑制肝癌细胞增殖,并诱导其凋亡。机制研究发现其可能通过激活p38/JNK信号通路,下调抑凋亡基因Bcl-2和上调促凋亡基因Bax及caspases 3的表达来诱导肝癌细胞凋亡。此外,Liu等[43]研究发现苦豆碱能够剂量依赖性地抑制Hep3B和Huh7肝癌细胞的增殖、诱导肝癌细胞凋亡和G2/M细胞周期阻滞。另一项研究报道[44],0~20 mg/ml槐定碱可通过增强抑癌基因PTEN的表达,抑制PI3K/AKT信号通路的激活,同时增加caspases 3/9)和基质金属蛋白酶3/9(MMP3/9)的蛋白表达,最终抑制HepG2细胞的增殖、侵袭和迁移,并诱导细胞凋亡。Zhang等[45]报道1000 μmol/L槐果碱能够显著抑制HCC-LM3和MHCC-97H的细胞增殖率,使细胞周期阻滞在G0/G1期。其作用机制是通过抑制AKT/GSK3β/β-catenin轴和TGF-β诱导的肝癌细胞的上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)发挥治疗肝癌的作用。
-
近年来,随着新药研发和临床需求的不断扩大,苦豆子作为传统中药,其抗炎、抗病毒、抗肿瘤和免疫调节等药理作用不断被发现。本文就宁夏苦豆子中的主要成分及其在治疗肝脏疾病中的活性作用进行了综述,发现苦豆子在治疗病毒性肝炎、非酒精性肝病、肝纤维化、肝硬化、肝衰竭、肝细胞癌等疾病中可能发挥重要作用,其中,苦参碱(斯巴特康)注射液已于临床用于急、慢性肝炎、肝硬化及其他肝胆疾病的治疗。
尽管国内外对苦豆子的研究不断增多,但是关于苦豆子的药物研究和开发仍然存在诸多问题,如黄酮、挥发油类等研究还较少,对苦参碱(素)类药物的临床副反应还不明确,药物和药物之间可能存在的相互作用尚未清楚,对活性成分在不同组织中的分子靶点和作用机制的研究不够深入,对苦豆子药动学的临床研究不够充分等。因此,迫切需要科研力量的投入,系统开展苦豆子基础研究,建立一套以宁夏苦豆子活性成分为主的肝病防治药物创新技术体系和苦豆子产业发展的关键技术体系,为宁夏苦豆子的资源利用和高技术产品开发奠定坚实的技术基础。
Research progresses on the main active components in Ningxia Sophora alopecuroides and the therapeutic activities for liver diseases
-
摘要: 苦豆子是豆科槐属植物,为宁夏的道地药材之一。苦豆子有着丰富而复杂的活性成分,主要有生物碱、黄酮、挥发油、甾体、多糖、脂肪酸等。近年来,国内外对苦豆子生物碱开展了大量研究,该类生物碱具有抗肝炎、抗肝纤维化、抗肝硬化、抗肝衰竭、抗肝癌等药理作用,其中,苦参碱相关药物已经获批在临床用于治疗乙型肝炎病毒感染等疾病。鉴于苦豆子在肝脏疾病治疗中的药用价值,对苦豆子主要活性成分进行综述,重点阐述其治疗肝脏疾病的研究进展。Abstract: Sophora alopecuroides, a plant of the family Leguminosae, is one of the Daodi herbs in Ningxia. The active constituents of Sophora alopecuroides are abundant and complex, including alkaloids, flavonoids, volatile oils, steroids, polysaccharides, fatty acids and so on. In recent decades, a great number of domestic and overseas studies have been carried out on Sophora alopecuroides alkaloids, which have anti-hepatitis, anti-liver fibrosis, anti-cirrhosis, anti-liver failure and anti-liver cancer and other pharmacological effects. Clinically, Matrine-related drugs are used to treat hepatitis B virus infection and other diseases. This review aims to summarize the main active ingredients of Sophora alopecuroides, mainly focusing on the research progress in their treatment activities for liver diseases.
-
Key words:
- Ningxia Sophora alopecuroides /
- active constituents /
- hepatic disease /
- research progress
-
玄参别名元参、黑参、浙玄参等,为我国传统大宗药材,主产地为浙江、安徽、四川、贵州等地[1-2]。玄参,始载于《神农本草经》,被列为中品,味甘、苦、咸,性微寒[3];归肺、胃、肾经,具有清热凉血,滋阴降火,解毒散结的功效,常用于热病伤阴,舌绛烦渴,津伤便秘、目赤、咽痛等症[4-5]。环烯醚萜苷类是玄参的主要有效成分,包括哈巴苷、哈巴俄苷等,临床上主要用于脑缺血、高血压、糖尿病等疾病,具有抗炎、保护心血管、抗肿瘤、免疫调节等作用[6-9]。
关于不同产地玄参有效成分含量测定的报道较少,仅有的报道也只集中在少数产地[10-11]。玄参药材原植物生长环境差别大,不同的生境因子下药材质量参差不齐,且在栽培过程中,栽培品系繁多混杂,严重阻碍了玄参产业的可持续发展。2020版《中国药典》规定将哈巴苷、哈巴俄苷作为玄参药材的质控成分,现代药理学研究也表明哈巴苷、哈巴俄苷具有保护心血管、保护神经的药理作用[12-13]。因此,课题组以哈巴苷和哈巴俄苷成分为指标性成分,收集全国玄参15个主产区玄参种质资源,建立HPLC法对其进行含量测定,分析不同产地玄参环烯醚萜苷类成分之间的差异性,以期为玄参药材质量控制提供理论依据。
1. 材料与方法
1.1 药材
2019年11月至2019年12月,收集浙江磐安、安徽谯城区、贵州阳溪、河南朱庄、四川陇东等15个产地新鲜玄参种质资源,经浙江中医药大学药学教研室秦路平教授鉴定为玄参科植物玄参(Scrophularia ningpoensis Hemsl.)的干燥根,信息见表1。
表 1 不同产地玄参样品信息编号 产地 经度(°) 纬度(°) 海拔(l/m) 降雨量(l/mm) 年平均温度(t/℃) S1 浙江磐安 120.43 29.05 1020 1440.1 17.4 S2 浙江临安 119.72 30.23 1050 1463.3 16.2 S3 杭州植物园 120.13 30.27 25 1400.3 16.1 S4 安徽涡阳 116.22 33.52 40 809.8 15.1 S5 安徽谯城区 115.77 33.88 35 805.0 14.5 S6 安徽利辛 116.20 33.15 22 823.9 14.8 S7 河南太丘 116.13 33.93 32 740.5 14.3 S8 河南南丰 115.20 33.65 34 738.6 14.6 S9 河南朱庄 114.51 33.01 33 740.5 14.3 S10 四川陇东 102.71 30.48 1428 1000.0 12.6 S11 四川永富 102.65 30.55 1456 984.6 13.4 S12 四川五龙 102.77 30.40 1410 993.4 12.5 S13 贵州洛龙 107.71 29.06 832 1170.4 22.1 S14 贵州阳溪 107.57 29.07 1300 1100.3 16.3 S15 贵州玉溪 107.36 29.05 1324 1070.3 15.6 1.2 仪器与试剂
Waters Alliance e2695型高效液相色谱仪(美国Waters公司);ZORBAX Eclipse C18色谱柱(250 mm×4.6 mm, 5 μm);XS105型电子分析天平(梅特勒-多利多公司);超纯水仪(美国Millipore公司);DXF–60D型中药打粉机(广州市大祥电子机械设备有限公司);KQ–300DV型超声波(广州颖汉科技有限公司);DHG–9031A型电热恒温鼓风干燥箱(上海森信试验仪器有限公司)。哈巴苷(B20481)、哈巴俄苷(B20480)对照品均购于上海源叶生物科技有限公司。乙腈(色谱级,美国天地公司),磷酸(色谱级,上海阿拉丁公司),其余试剂均为分析纯。
1.3 方法
1.3.1 色谱条件
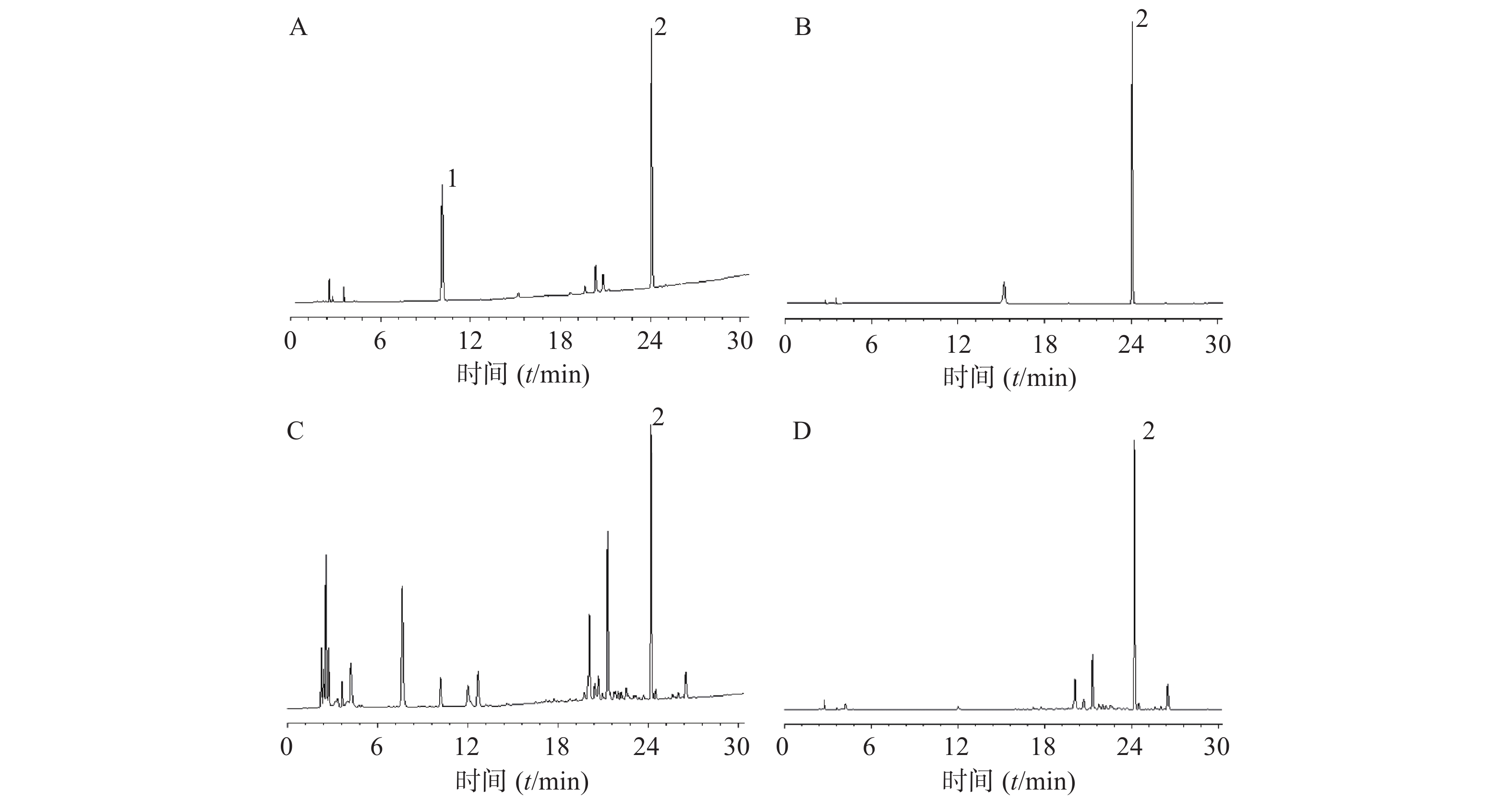
ZORBAX Eclipse Plus C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)–0.03%磷酸水溶液(B),梯度洗脱(1~10 min,3%~10% A;10~20 min,10%~33% A;20~25 min,33%~50% A;25~30 min,50%~80% A;30~35 min,80% A;35~37 min,80%~3% A;37~42 min,3% A);体积流量1.0 ml/min,柱温30 ℃,进样量为10 μl;检测波长为210、280 nm。色谱图见图1。
1.3.2 线性关系考察
精密称取哈巴苷、哈巴俄苷对照品适量,用30%甲醇溶液制备成终质量浓度为每1 ml含哈巴苷0.6 mg、哈巴俄苷0.2 mg的混合对照品溶液,于4 ℃冰箱中保存备用。分别精密吸取哈巴苷、哈巴俄苷混合对照品溶液0.34、0.67、1.00、1.40、1.70 ml置于2 ml容量瓶中,30%甲醇溶液定容至2 ml,吸取上述溶液适量,0.45 μm微孔滤膜过滤,按“1.3.1”项下色谱条件依次进样。哈巴苷的检测波长为210 nm,哈巴俄苷的检测波长为280 nm。以对照品溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表2,可知哈巴苷与哈巴俄苷在各自范围内线性关系良好。
表 2 线性关系考察成分 回归方程 线性范围 r 哈巴苷 Y=2964.3X+5156.4 0.1020~0.5100 mg/ml 0.9999 哈巴俄苷 Y=13919X+366.1 0.0340~0.1700 mg/ml 0.9999 1.3.3 供试品溶液制备
将洗净后的玄参根切片,置于60 ℃烘箱中烘至恒定质量,粉碎后过3号筛。精密称取玄参根样品粉末0.25 g,置于25 ml具塞锥形瓶中,精密加入50%甲醇溶液25 ml,密塞,称定重量,浸泡1 h,超声处理45 min(300 W, 40 kHz),放冷,再称定重量,用50%甲醇溶液补足损失的重量,摇匀,用0.45 μm微孔滤膜过滤,取续滤液,即得。按“1.3.1”项下色谱条件平行测定3次。
1.3.4 精密度试验
精密吸取哈巴苷、哈巴俄苷对照品溶液适量,按“1.3.1”项下色谱条件依次进样6次,测得哈巴苷、哈巴俄苷峰面积RSD分别为0.11%、0.09%,表明仪器精密度良好。
1.3.5 稳定性试验
取浙江磐安样品,按“1.3.3”项下方法制备供试品溶液,分别于0、2、4、8、12、18、24 h,按“1.3.1”项下色谱条件进样,测得哈巴苷、哈巴俄苷峰面积RSD分别为0.24%、0.17%,表明供试品溶液在24 h内稳定性良好。
1.3.6 重复性试验
取浙江磐安样品6份,按“1.3.3”项下方法制备供试品溶液,按“1.3.1”项下色谱条件进样,测得哈巴苷、哈巴俄苷含量的RSD分别为0.59%、0.50%,表明该方法重复性良好。
1.3.7 加样回收率试验
取含量已知的浙江磐安样品,精密称定0.125 g, 加入哈巴苷、哈巴俄苷对照品适量,按“1.3.3”项下方法制备成供试品溶液,按“1.3.1”项下色谱条件进样,计算回收率,结果见表3。
表 3 加样回收率试验结果(n=6)成分 称样量(m/g) 原有量(m /mg) 加入量(m /mg) 测得量(m /mg) 回收率(%) 平均回收率(RSD)(%) 哈巴苷 0.1251 0.0748 0.0748 0.1478 0.9759 97.44(0.93) 0.1250 0.0748 0.0748 0.1476 0.9733 0.1251 0.0748 0.0748 0.1486 0.9866 0.1254 0.0750 0.0750 0.1482 0.9760 0.1253 0.0749 0.0749 0.1480 0.9760 0.1251 0.0748 0.0748 0.1465 0.9586 哈巴俄苷 0.1250 0.1065 0.1065 0.2093 0.9653 97.08(1.24) 0.1254 0.1068 0.1068 0.2126 0.9906 0.1252 0.1067 0.1068 0.2089 0.9569 0.1251 0.1066 0.1068 0.2109 0.9766 0.1253 0.1068 0.1068 0.2096 0.9625 0.1251 0.1066 0.1068 0.2105 0.9728 1.4 数据处理与分析
应用SPSS 19.0软件处理数据。方差分析采用单因素ANOVA分析,聚类分析采用组间连接法[14]。
2. 结果与分析
2.1 哈巴苷与哈巴俄苷含量比较
15个产地间玄参根中哈巴苷、哈巴俄苷的含量存在统计学差异(P<0.01),结果见表4。哈巴苷、哈巴俄苷含量以及两者总量分别为0.791、0.228、1.265 mg/g。四川陇东产哈巴苷含量最高、安徽谯城区含量最低;浙江磐安产哈巴俄苷含量最高,四川永富含量最低;四川陇东产哈巴苷与哈巴俄苷总量最高,杭州植物园最低,含量范围在0.752~1.529 mg/g之间,均符合《中国药典》2020版质量标准。
表 4 不同产地间玄参样品中各成分含量测定结果($\bar x \pm s$ ,n=3,mg/g)样品 哈巴苷含量 哈巴俄苷含量 哈巴苷与哈巴俄苷总量 S1 0.598±0.003 0.852±0.003 1.450±0.006 S2 0.979±0.002 0.520±0.004 1.499±0.006 S3 0.600±0.007 0.152±0.009 0.752±0.013 S4 0.625±0.003 0.542±0.003 1.167±0.004 S5 0.489±0.002 0.831±0.008 1.320±0.009 S6 0.558±0.003 0.615±0.006 1.173±0.009 S7 0.730±0.021 0.626±0.017 1.355±0.038 S8 0.921±0.007 0.563±0.006 1.484±0.002 S9 0.642±0.004 0.655±0.004 1.297±0.008 S10 1.147±0.006 0.382±0.002 1.529±0.008 S11 0.992±0.016 0.036±0.002 1.029±0.017 S12 0.560±0.002 0.422±0.001 0.983±0.002 S13 0.759±0.006 0.385±0.005 1.144±0.009 S14 1.120±0.009 0.234±0.015 1.355±0.024 S15 1.140±0.007 0.297±0.294 1.434±0.010 均值 0.791** 0.228** 1.265** **P<0.01,表示不同产地的哈巴苷或哈巴俄苷含量存在极显著差异。 2.2 相关性分析
对不同产地之间中的有效成分与生境因子进行相关性分析,结果如表5所示,哈巴苷与海拔、降雨量、年平均温度呈正相关关系,与海拔正相关系数最高为(0.440);与经度、纬度之间呈负相关关系,与经度负相关系数最高为(–0.419)。哈巴俄苷与经度、纬度呈正相关,与海拔、降雨量、年平均温度呈负相关,与海拔负相关系数最高为(–0.360)。
表 5 玄参中哈巴苷、哈巴俄苷含有量与生境因子相关性分析项目 哈巴苷 哈巴
俄苷经度 纬度 海拔 年降
雨量年平均
温度哈巴苷 1.000 哈巴俄苷 −0.553 1.000 经度 −0.419 0.572 1.000 纬度 −0.341 0.506 0.370 1.000 海拔 0.440 −0.360 −0.620* −0.768** 1.000 年降雨量 0.098 −0.243 0.184 −0.795** 0.508 1.000 年平均温度 0.079 −0.237 −0.005 −0.507 0.009 0.363 1.000 *P<0.05,表示显著相关;**P<0.01,表示极显著相关。 2.3 聚类分析
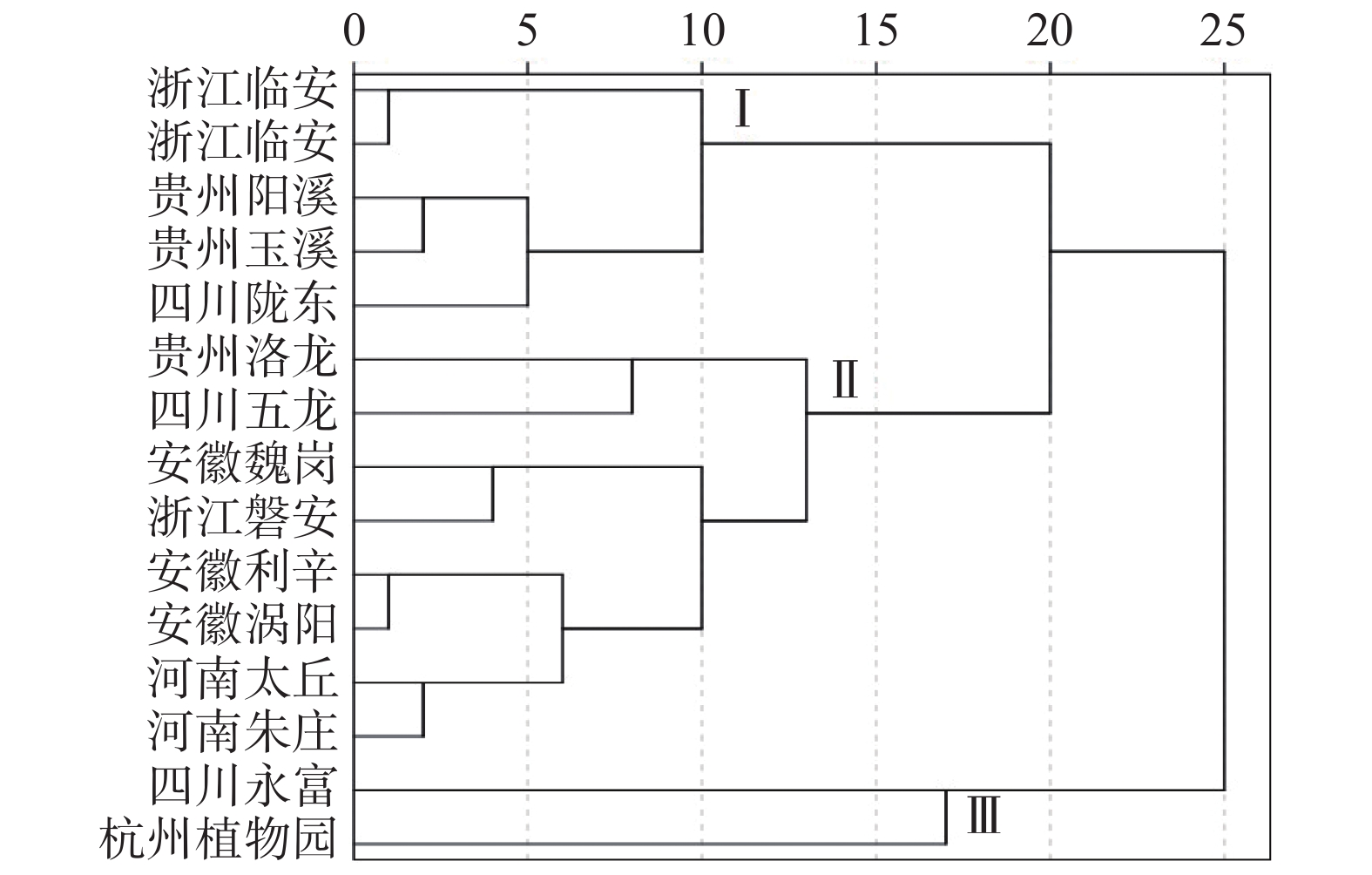
以哈巴苷、哈巴俄苷含量以及两者总量为参考指标,对15个产地玄参进行聚类分析,根据欧式距离D2=19.98将不同产地划分为3个类群,如图2所示。类群I共5个产地,分别为浙江临安,河南南丰,贵州阳溪、玉溪,四川陇东,该类玄参中哈巴苷含量、哈巴苷和哈巴俄苷总量最高;类群II有8个产地、分别为贵州洛龙,四川五龙,安徽利辛、谯城区、涡阳,浙江磐安,河南太丘、朱庄,这些产地哈巴俄苷含量次之;类群III共有2个产地,分别是四川永富和杭州植物园,这两个产地的哈巴俄苷含量、哈巴苷和哈巴俄苷总量最低。
3. 讨论与结论
本试验采用高效液相法测定玄参哈巴苷与哈巴俄苷含量,经PDA检测器对哈巴苷和哈巴俄苷标准品溶液进行波长扫描,结果显示,哈巴苷的最大检测波长是210 nm,与溶剂甲醇的吸收波长一致,此处会有溶剂峰的出现,而哈巴俄苷的最大检测波长是280 nm,此时基线平稳,未与溶剂峰相重叠,因此,确定检测波长为210 nm和280 nm;采用2020版《中国药典》中哈巴苷与哈巴俄苷的含量测定的提取方法及流动相,结果显示,提取、分离效果良好,哈巴苷与哈巴俄苷在甲醇中超声处理45 min即可提取完全,各峰之间的分离度>1.5,理论塔板数>5000,哈巴苷与哈巴俄苷的保留时间分别是10.107、24.116 min。
药用植物的生长环境对次生代谢产物的积累起着非常关键的作用,包括经纬度、海拔、降雨量等[14]。本实验结果显示,15个产地玄参根中哈巴苷、哈巴俄苷的含量存在统计学差异(P<0.01),其中四川陇东、河南南丰、浙江临安、磐安含量最高;海拔、降雨量、年平均温度与哈巴苷之间呈正相关,与哈巴俄苷呈负相关。课题组发现,浙江临安、磐安的海拔分别是1050 m、1020 m,远高于杭州植物园的25 m,因此,临安、磐安哈巴苷的含量要高于植物园,这与实验结果一致;经纬度与哈巴俄苷呈正相关,且相关系数较大,经纬度越高,哈巴俄苷的含量就越大,四川陇东、永富、五龙的经纬度低于安徽利辛、涡阳、谯城区,因此,前者的哈巴俄苷的含量低于后者。结果显示,经纬度越高越有利于哈巴俄苷的积累,降雨量越大,海拔越高,越有利于哈巴苷的积累,故可优先在拥有上述环境条件的种质中选择。本实验只对玄参中哈巴苷、哈巴俄苷的含量进行测定,下一步将继续增加其他活性成分的含量测定,为玄参的质量控制提供参考依据。
-
表 1 部分已分离得出的苦豆子生物碱
编号 苦豆子生物碱 文献 1 苦参碱(matrine) [10] 2 氧化苦参碱 (oxymatrine) [11] 3 槐果碱 (sophocarpine) [10] 4 槐定碱 (sophoridine) [10] 5 苦豆碱 (aloperine) [11] 6 莱曼碱 (lehmannine) [12] 7 槐胺碱 (sophoramine) [11] 8 新槐安碱 (neosophoramin) [11] 9 7α-羟基槐胺碱 (7α-hydroxysophoramine) [10] 10 3α-羟基槐定碱 (3α-hydroxy-sophoridine) [11] 11 9α-羟基槐胺碱 (9α-hydroxysophoramine) [10] 12 13,14-去氢槐定碱 ((−)-13,14-dehydrosophoridine) [13] 13 N-羟基槐定碱 (N-hydroxy-sophoridine) [13] 14 12-β羟基槐果碱 (12β-hydroxysophocarpine) [10] 15 9α-羟基苦参碱 (9α-hydroxy-matrine) [13] 16 14-β羟基苦参碱 (14β-hydroxy-matrine) [10] 17 氧化槐定碱 (oxysophoridine) [11] 18 氧化槐果碱 (oxysophocarpine) [11] 19 N-甲基苦豆碱 (N-methyl-aloperine) [11] 20 赝靛叶碱 (baptifoline) [10] 21 臭豆碱 (anagyrine) [11] 22 金雀花碱 (cytisine) [11] 23 甲基金雀花碱 (N-methyl-cytisine) [11] 24 羟乙花碱 (N-2-hydroxyethyl-cytisine) [2] 25 尼古丁 (nicotine) [11] 26 腺荚豆碱 (adenocarpine) [10] 27 三巴豆四胺 (tricrotonytetramine) [13] -
[1] 邢世瑞. 宁夏中药志-下卷[M]. 2版. 银川: 宁夏人民出版社, 2006. [2] 郝伟亮, 孟根达来, 解红霞. 苦豆子的化学成分及药理作用研究进展[J]. 中国药房, 2016, 27(13):1848-1850. doi: 10.6039/j.issn.1001-0408.2016.13.35 [3] 于蕾, 张连芳, 东方, 等. 苦豆子中主要生物碱药理作用的研究进展[J]. 北京联合大学学报(自然科学版), 2015, 29(2):61-66. [4] WANG R Z, DENG X X, GAO Q X, et al. Sophora alopecuroides L. : an ethnopharmacological, phytochemical, and pharmacological review[J]. J Ethnopharmacol,2020,248:112172. doi: 10.1016/j.jep.2019.112172 [5] YANG L, GUAN W, JIE L, et al. Quinolizidine alkaloids derivatives from Sophora alopecuroides Linn: Bioactivities, structure-activity relationships and preliminary molecular mechanisms[J]. Eur J Med Chem,2020,188:111972. doi: 10.1016/j.ejmech.2019.111972 [6] 任莉莉. 苦参碱抗肿瘤作用及其机制研究进展[J]. 中国医师杂志, 2012(2):281-283. doi: 10.3760/cma.j.issn.1008-1372.2012.02.051 [7] HE L J, LIU J S, LUO D, et al. Quinolizidine alkaloids from Sophora tonkinensis and their anti-inflammatory activities[J]. Fitoterapia,2019,139:104391. doi: 10.1016/j.fitote.2019.104391 [8] ZHANG Y B, LUO D, YANG L, et al. Matrine-type alkaloids from the roots of Sophora flavescens and their antiviral activities against the hepatitis B virus[J]. J Nat Prod,2018,81(10):2259-2265. doi: 10.1021/acs.jnatprod.8b00576 [9] ZHOU Y, WU Y, DENG L, et al. The alkaloid matrine of the root of Sophora flavescens prevents arrhythmogenic effect of ouabain[J]. Phytomedicine,2014,21(7):931-935. doi: 10.1016/j.phymed.2014.02.008 [10] ATTA-UR-RAHMAN, CHOUDHARY M I, PARVEZ K, et al. Quinolizidine alkaloids from Sophora alopecuroides[J]. J Nat Prod,2000,63(2):190-192. doi: 10.1021/np990351v [11] 牟新利, 王武宝, 巴杭, 等. 中药苦豆子化学成分及生理活性的研究进展[J]. 新疆师范大学学报(自然科学版), 2005, 24(1):45-50. [12] 宋丽军, 梁丽萍, 赵淑敏, 等. 一测多评法测定苦豆子总生物碱中6种成分的含量[J]. 中药材, 2017, 40(6):1380-1383. [13] 游菁菁, 李月英, 沙碧莹, 等. 中药苦豆子生物碱的研究进展[J]. 江西中医药大学学报, 2015, 27(2):109-113,116. [14] 热孜古丽·克依木, 李敏, 热娜·卡斯木, 等. 新疆苦豆子中黄酮类化学成分的研究[J]. 新疆医科大学学报, 2012, 35(5):591-593. doi: 10.3969/j.issn.1009-5551.2012.05.007 [15] 卞海涛, 赵军, 黄华, 等. 苦豆子化学成分研究[J]. 中药材, 2014, 37(1):72-73. [16] LV Y, ZHAO P, PANG K J, et al. Antidiabetic effect of a flavonoid-rich extract from Sophora alopecuroides L. in HFD-and STZ-induced diabetic mice through PKC/GLUT4 pathway and regulating PPARα and PPARγ expression[J]. J Ethnopharmacol,2021,268:113654. doi: 10.1016/j.jep.2020.113654 [17] 赵义勇, 杨巧丽, 李壮, 等. 苦豆子总黄酮对乙肝病毒复制的影响[J]. 中国民族民间医药, 2017, 26(17):21-24. [18] 马别厚, 张尊听. 苦豆子豆籽油化学成分研究[J]. 天然产物研究与开发, 2003, 15(2):133-134. doi: 10.3969/j.issn.1001-6880.2003.02.013 [19] 李艳艳, 冯俊涛, 张兴, 等. 苦豆子化学成分及其生物活性研究进展[J]. 西北农业学报, 2005, 14(2):133-136,140. doi: 10.3969/j.issn.1004-1389.2005.02.031 [20] 陈冠, 赵振宇, 傅予, 等. 苦豆子多糖SAP的结构表征及其对CT26抗肿瘤活性研究[J]. 中草药, 2017, 48(6):1103-1107. [21] WU Y, GUO R, CAO N N, et al. A systematical rheological study of polysaccharide from Sophora alopecuroides L. seeds[J]. Carbohydr Polym,2018,180:63-71. doi: 10.1016/j.carbpol.2017.10.007 [22] 王浩, 高淑林, 杨晶晶. 氧化苦参碱联合拉米夫定对慢性乙型肝炎患者TLR9信号通路的影响[J]. 河北医药, 2016, 38(2):187-190. [23] 王青. 氧化苦参碱体外抗乙型肝炎病毒作用机制的初步研究[D]. 上海: 第二军医大学, 2007: 1-50. [24] 宋春艳. 槐果碱对非酒精性脂肪性肝炎防治作用的实验研究[D]. 上海: 第二军医大学, 2009: 1-64. [25] 史丽娟. 氧化苦参碱改善非酒精性脂肪肝大鼠肝脂沉积的机制探讨[D]. 石家庄: 河北医科大学, 2013: 1-141. [26] SHI L J, SHI L, SONG G Y, et al. Oxymatrine attenuates hepatic steatosis in non-alcoholic fatty liver disease rats fed with high fructose diet through inhibition of sterol regulatory element binding transcription factor 1 (Srebf1) and activation of peroxisome proliferator activated receptor alpha (Pparα)[J]. Eur J Pharmacol,2013,714(1-3):89-95. doi: 10.1016/j.ejphar.2013.06.013 [27] 唐彬. 苦参碱对NASH大鼠氧化应激的影响以及NASH患者氧化应激相关指标的检测及意义[D]. 北京: 北京协和医学院, 2013:1-46. [28] 杨增玺. 苦参碱对肝纤维化小鼠α-SMA、TGF-β1及PDGF-B调节作用的研究[D]. 兰州: 兰州大学, 2012: 1-33. [29] 闫冰川, 江鹏, 江伟炽, 等. 苦参素联合扁桃苷治疗小鼠肝纤维化的相关研究[J]. 新中医, 2018, 50(12):25-27. [30] 孙永年, 黄长形, 黄祝青. 苦参素对慢性乙型肝炎患者血清TGF-β1、TNF-α及肝纤维化指标的影响[J]. 武警医学, 2003, 14(9):531-534. doi: 10.3969/j.issn.1004-3594.2003.09.007 [31] 梁建新, 屈杏芬, 曾文铤, 等. 氧化苦参碱在治疗慢性乙型肝炎中抗肝纤维化的作用机制[J]. 南方医科大学学报, 2010, 30(8):1871-1873. doi: 10.12122/j.issn.1673-4254.2010.08.030 [32] 吴钦梅, 尤红. 中国乙型病毒性肝炎肝硬化研究现状[J]. 中国病毒病杂志, 2014, 4(1):7-10. [33] JIANG X, XIE L, HUANG C, et al. Oral oxymatrine for hepatitis B cirrhosis: a systematic review protocol[J]. Medicine (Baltimore),2018,97(49):e13482. doi: 10.1097/MD.0000000000013482 [34] 毛莉萍, 王越, 章幼奕, 等. 苦参碱治疗对乙肝肝硬化患者自然杀伤细胞表型变化的影响[J]. 中药药理与临床, 2016, 32(1):178-181. [35] 祝尔健, 朴云峰, 丁百静, 等. 苦参碱治疗乙型肝炎后肝硬化近期疗效观察[J]. 中国老年学杂志, 2008, 28(6):611-612. doi: 10.3969/j.issn.1005-9202.2008.06.046 [36] 苏毅. 急性肝衰竭的病因与治疗研究现状[J]. 中国实用医药, 2019, 14(19):194-195. [37] 范文瀚, 罗怡平, 李成忠. 糖皮质激素应用于肝衰竭治疗机制及其临床时机的把握[J]. 实用肝脏病杂志, 2020, 23(1):7-9. doi: 10.3969/j.issn.1672-5069.2020.01.004 [38] 张弦, 蒋道荣, 赵华, 等. 苦参素联合复方茵陈颗粒预处理对大鼠急性肝衰竭的防治作用观察[J]. 山东医药, 2017, 57(15):37-40. doi: 10.3969/j.issn.1002-266X.2017.15.010 [39] 张弦. TLR4介导的信号通路对肝细胞凋亡的影响及氧化苦参碱的干预机制研究[D]. 苏州: 苏州大学, 2016: 1-163. [40] 向晓星. 氧化苦参碱治疗重型肝炎的实验与临床研究[D]. 上海: 第二军医大学, 2001: 1-78. [41] DAWKINS J, WEBSTER R M. The hepatocellular carcinoma market[J]. Nat Rev Drug Discov,2019,18(1):13-14. doi: 10.1038/nrd.2018.146 [42] 杨晓娟. 苦参碱通过p38/JNK信号通路对肝癌细胞增殖及凋亡的影响[D]. 兰州: 甘肃中医药大学, 2020:1-53. [43] LIU J S, HUO C Y, CAO H H, et al. Aloperine induces apoptosis and G2/M cell cycle arrest in hepatocellular carcinoma cells through the PI3K/Akt signaling pathway[J]. Phytomedicine,2019,61:152843. doi: 10.1016/j.phymed.2019.152843 [44] WANG B, XU J, WANG H, et al. Effect and Mechanism of Sophoridine to suppress Hepatocellular carcinoma in vitro and vivo[J]. Biomed Pharmacother,2017,95:324-330. doi: 10.1016/j.biopha.2017.08.029 [45] ZHANG P P, WANG P Q, QIAO C P, et al. Differentiation therapy of hepatocellular carcinoma by inhibiting the activity of AKT/GSK-3β/β-catenin axis and TGF-β induced EMT with sophocarpine[J]. Cancer Lett,2016,376(1):95-103. doi: 10.1016/j.canlet.2016.01.011 -





 下载:
下载:


 下载:
下载:


