-
克罗恩病(Crohn’s disease, CD)是一种病因未明的炎症性肠病(inflammatory bowel disease, IBD)。临床以腹痛、腹泻、肠梗阻等为特点,常伴有肠外表现,并发症多,致残率高,发作与缓解交替出现,治疗难度较大。英夫利昔单抗(infliximab, IFX)是IBD治疗中最早使用的生物制剂,但是随着目前国内广泛应用,有部分IBD患者对IFX表现为失应答。临床药师通过血药浓度监测对1例CD合并低蛋白血症患者出现失应答的原因进行分析,考虑该患者血清白蛋白水平影响药物药动学过程,协助医生共同解决用药问题,以期提高IFX的应答,并对患者进行药学监护。
-
患者,女,53岁,身高165 cm,体重48 kg,体重指数(BMI)为17.63,于2017年7月无明显诱因出现黏液血便,每日4~5次,伴脐周痛,于当地医院对症治疗,症状好转,之后症状间断出现。曾就诊于外院提示溃疡性结肠炎,予口服美沙拉嗪1 g tid,联合美沙拉嗪灌肠液4 g qn,灌肠治疗,症状有所缓解,但无法达到完全缓解。2019-01-21就诊于长海医院,经肛小肠镜检查:回肠多发溃疡,病理:(回肠下段)见固有层较多淋巴结,浆、中性粒细胞浸润,局灶见肉芽肿,符合克罗恩病改变。依据《世界卫生组织克罗恩病诊断标准》,符合节段性病变及全壁性炎性反应,内镜回肠至肛周多发节段性纵行溃疡伴狭窄,确诊克罗恩病,予IFX 300 mg静脉滴注治疗,出院后在进少渣软食的同时口服肠内营养制剂增加营养素的摄入。至2020-03-26期间规律行IFX 300 mg维持治疗,2020-04-23日因患者出现腹痛症状反复,故将IFX剂量调整至400 mg。
患者于2020-06-17再次就诊我院,仍有腹痛腹胀症状,结肠镜:克罗恩病,回肠末端病理示:固有层较多淋巴细胞、浆细胞、中性粒细胞浸润,未见肉芽肿。查炎症因子水平:(白介素)IL-6 23.9 pg/ml,TNFα 133 pg/ml,粪便钙卫蛋白(FC)>1800 μg/g,IFX血药浓度<0.4 μg/ml,抗体血清浓度<4 ng/ml,由于IFX血药浓度低于下限,临床药师与医师分析后,考虑药物剂量不足引起继发性失应答,缩短注射间隔,本次输注IFX后间隔4周返院行IFX治疗。患者白蛋白25 g/L,住院期间输注20%人血白蛋白50 ml,临床药师建议医师对该患者进行全肠内营养支持,每日口服肠内营养粉剂(TP)(荷兰Abbott.Lab.B.V.,批准文号:H20130320)1罐,短肽型肠内营养剂(德国MilupaGmbH,批准文号:H20170170)1盒。患者出院4周后(2020-07-18)返院行IFX 400 mg治疗,查炎症因子水平:IL-6 14.9 pg/ml,CRP 21.4 mg/L,红细胞沉降率 41 mm/H,TNFα 56.3 pg/ml,查炎症因子与炎症指标较前下降,症状有所缓解,疾病活动度下降。
-
患者为中年女性,IFX用药期间临床症状反复,处于疾病活动期,且IFX血清谷浓度<0.4 μg/ml,低于有效的谷浓度范围(3~7 μg/ml),抗体浓度测定<4 ng/ml,未产生抗药抗体。有研究表明,IFX谷浓度水平可预测其治疗CD的疗效[1]。Hibi等认为达到临床反应的谷浓度阈值约1.0 μg/ml [2],在韩国人群中的研究显示基于疾病活动度的谷浓度截断值为0.68 μg/ml[3]。有研究发现,在对IFX治疗最初有应答的IBD患者中,最终也有高达40%的患者由于药物暴露不佳、副作用或其他原因不明的机制而失去反应[4]。结合该患者临床症状及实验室指标,考虑该患者为IFX剂量不足从而引起继发性失应答。
对继发性失应答的患者进行治疗药物监测(therapeutic drug monitoring,TDM)可指导治疗方案的调整 [5]。针对TDM结果,临床药师利用药动学、药效学、临床药物治疗学等知识,综合分析产生该结果的原因,评估该结果对药物治疗效果、安全性及用药依从性等方面的影响,为临床医师确定药物治疗方案、药师实施药物治疗管理及患者自我管理提供参考[6]。针对该患者的TDM结果,临床药师提出以下建议:该患者谷浓度低,抗体阴性,现用剂量400 mg,患者体重48 kg,已经达到8 mg/kg,IFX最高剂量为10 mg/kg,同时考虑免疫抑制剂如硫唑嘌呤可导致严重的骨髓抑制、肝功能异常等剂量依赖性不良反应,建议采取缩短注射间隔,由8周缩短为间隔4周,后期若患者应答情况差,加用硫唑嘌呤联合治疗或更换同类别或跨类别转换治疗。医师采纳,嘱患者出院后4周返院行IFX治疗,后期随访炎症因子与炎症指标较前下降,活动度下降。
-
虽然关于失应答的确切原因还不明确,但是目前研究观点认为导致IFX药物失效可能是由于以下两个关键机制:①药物免疫原性。由于IFX是人鼠嵌合型抗体,存在鼠源成分,因此有可能引发人体免疫系统产生抗药抗体,识别并中和体内药物,增加药物清除率,导致药物浓度的降低。②药动学变化。受疾病严重程度、血清蛋白水平和体重指数等多个因素的影响,体内药物代谢和清除速率发生变化,导致药物浓度偏低。
与传统化学药物不同,IFX是大分子药物,由于其分子质量较大,使其呈现出不同于小分子药物的独特药代特征,几乎不存在经肾清除,一般包括:①通过抗体与Fcγ受体结合,被网状内皮系统的吞噬细胞进行蛋白分解代谢,然后被细胞内的溶酶体降解成肽段和氨基酸;②通过FcRn介导的循环[7]。所以影响这些机制的参数就会导致更多的清除和较低的药物浓度。
患者此次入院,血清白蛋白25 g/L,查既往病史资料,自2020-03-26起血清白蛋白水平一直<30 g/L,处于低蛋白血症的状态,是否血清白蛋白水平影响药物清除及应答?临床药师查阅文献后认为,血清白蛋白水平低会导致外源的IgG即IFX分解代谢增加,清除率增加,从而降低了IFX药物暴露,产生失应答。一项真实世界探索影响IBD患者IFX药动学因素的大型队列研究发现,高滴度ATIs、高体重和低血清白蛋白水平是影响IFX清除的独立因素[8]。有研究利用ACCENT I和REACH试验数据建立非线性混合效应模型,发现当CD患者白蛋白降低时清除率是增加的[9]。Dotan等也发现IFX清除率与白蛋白、体重和ATI等患者因素显著相关,建议对低蛋白血症者缩短给药间隔,体重较低者应给予较高的初始剂量[10]。有研究提出FcRn共同挽救IgG和白蛋白的机制在解释血清白蛋白水平与IFX药动学之间的关系中起重要作用,虽然可能需要进一步的研究来阐明FcRn的作用[11]。该患者住院期间及时静脉输注人血白蛋白纠正低白蛋白水平是合理的。
-
临床药师对该患者进行营养筛查,NRS2002总评分≥3分,同时对当前营养状况进行评估:血生化评价营养指标血清白蛋白25 g/L,前白蛋白115 mg/L,明显偏低,提示患者属于营养状况不良,需加强营养支持。有研究表明,肠内营养不仅可以改善营养状态,还能诱导和维持CD缓解,可能机制主要是:下调促炎因子,发挥抗炎作用,促进肠道黏膜上皮愈合,降低肠道渗透性,且使机体脂肪和蛋白质等大分子致病抗原的含量大大降低, 进而起到减少肠道黏膜抗原暴露的目的,使肠道休息,还可调整肠道菌群[12]。并且不同的配方成分在诱导克罗恩病患者缓解时的疗效无显著差异,蛋白质类型均不影响肠内营养效果[13]。该患者前期一直服用整蛋白型肠内营养制剂,药师认为营养成分完整、接近正常饮食组成、价廉、口感好的整蛋白型肠内营养制剂是适宜的。短肽肠内营养制剂可直接吸收,不依赖于消化酶可快速纠正低蛋白状态,且低脂配方不增加肠道负担。联合使用可以及时补充患者蛋白质,有助于肠道黏膜对蛋白质的吸收,提高血浆前蛋白、白蛋白水平,临床药师建议患者联合使用。2006年欧洲肠外肠内营养学会(ESPEN)推荐缓解期克罗恩病患者:25~30 kcal/(kg·d),活动期CD患者:约高出缓解期8%~10%,该患者进行全肠内营养,联合使用短肽型和整蛋白型制剂,肠内营养粉剂(TP)400 g(1800 kcal)每日一罐,肠内营养粉剂(短肽型)125 g(500 kcal)每日一袋,一日总热量为2300 kcal,是合理的。
-
该患者接受IFX治疗过程中,容易诱发机会性感染,如真菌感染、病毒感染等,这些感染会导致各种感染性疾病,本次治疗前检查无机会感染发生,继续加强监护。针对该患者肠内营养支持的监护,首先要加强营养状况监测,定期筛查营养风险,定期检查微量营养素缺乏情况,如维生素D、B12、叶酸等;其次,进行用药教育增加患者用药依从性和意识,全肠内营养不仅是营养支持,更是一种治疗,能够诱导CD缓解,并可能有助于维持缓解,延缓复发,促进肠黏膜溃疡愈合;最后,密切监测相关并发症,如肠道并发症(腹泻、腹胀、恶心、呕吐等)、代谢并发症(水电解质平衡异常、血糖波动等)。
-
克罗恩病是一种慢性炎症性病变,属于需要长期治疗的疾病。临床药师对患者进行全程药学监护,特别是结合患者合并低蛋白血症的病情,查阅相关文献,分析IFX血药浓度较低的原因,协助医师优化治疗方案,较好地发挥了临床药师进行药学服务实践的作用。该病例提示我们,临床患者使用IFX是具有个体差异的,特别是对于复杂病情的患者,我们应该提高警惕,尤其是要关注血清白蛋白水平对IFX消除以及疗效的影响。
Pharmaceutical care for a Crohn's disease patient with hypoalbuminemia and non-response to infliximab
-
摘要:
目的 探讨临床药师在克罗恩病患者出现英夫利昔单抗继发性失应答的个体化治疗和用药监护中的作用。 方法 临床药师参与1例克罗恩病合并低蛋白血症患者的药学实践过程,及时查阅文献对英夫利昔单抗血药浓度检测结果进行解读,分析该药的药动学过程,高度怀疑患者血清白蛋白水平降低致消除加快,浓度降低引起继发性失应答。 结果 临床药师协助医生调整药物治疗方案,患者经治疗后病情趋于好转。 结论 临床药师充分了解药物药动学变化,对治疗药物监测结果进行解读,可协助临床发现药物治疗相关问题,有利于建立个体化治疗方案,提高患者生物制剂用药的安全性及有效性。 Abstract:Objective To investigate the role of clinical pharmacists in individualized treatment and pharmaceutical care for a Crohn’s disease patient with non-response to infliximab. Methods The clinical pharmacist participated in the pharmaceutical care for a Crohn’s disease patient with hypoalbuminemia. Clinical pharmacists interpreted the blood concentration results of infliximab based on literature review, analyzed the pharmacokinetic process of drugs, and suggested that low serum albumin levels may cause the accelerated drug elimination and resulted in reduced drug concentration and secondary non-response. Results Clinical pharmacists assisted clinician adjusting the medication regimen and the patient recovered well after the new treatment plan. Conclusion With good understanding in medication pharmacokinetics and the blood test results, clinical pharmacists can help to solve the drug therapy related problems and establish an individual treatment plan to improve the safety and effectiveness of the biological medications. -
鹦鹉热衣原体是在革兰染色阴性需氧细胞内寄生的病原体,主要宿主为鸟类,吸入鹦鹉热衣原体污染的气溶胶可致病,人际间传播较为罕见,主要通过接触鸟类的排泄物感染,肺是主要受累器官之一,严重者可致呼吸衰竭[1]。重症肺炎又是一种起病急、进展迅速、病死率高、治疗困难且预后较差的呼吸系统疾病,是严重威胁人类生命健康的感染性疾病之一[2]。临床药师发挥药学专业优势,协助医师优化治疗方案,实施药学监护,提高合理用药和临床疗效。本文就临床药师参与1例鹦鹉热衣原体感染致重症肺炎并发药物性肝损伤老年患者的药学实践报道如下。
1. 病例资料
患者男性,83岁,身高178 cm,体重65 kg。2018-12-07因走路不稳,自觉发冷就诊于某医院急诊(神经内科),查胸部CT示右肺中叶见片状高密度影,边界不清,可见充气支气管影,血检验示血象、C反应蛋白(CRP)均升高,头颅磁共振等检查未见脑梗及脑出血征象,诊断为右肺中叶肺炎,予头孢唑肟(剂量不详)抗感染治疗。2018-12-09患者出现咳嗽、咳少量黄痰,呼吸短促,体温38.8℃,予以莫西沙星0.4 g qd联合头孢唑肟2.0 g q12h抗感染治疗。2018-12-09晚发热39.2℃并发房颤(房颤考虑莫西沙星不良反应),予亚胺培南-西司他丁钠0.5 g q8h抗感染,甲泼尼龙琥珀酸钠80 mg qd抗炎,低分子肝素钠抗凝等治疗。患者仍反复高热,气急加重,痰液不易咳出。2018-12-11复查胸部CT示右肺大片状密度增高影,血气分析示Ⅰ型呼吸衰竭,血象、CRP较前明显升高,加用替考拉宁(剂量不详)抗感染。但仍反复发热,氧合持续恶化。2018-12-12为进一步治疗,以“重症肺炎”转入呼吸重症监护病房。
既往史:患者有糖尿病史,自诉饮食控制,血糖控制尚可,否认其他病史。
辅助检查:①2018-12-07胸部CT:右肺中叶见片状高密度影,边界不清,可见充气支气管影。心脏彩超:右心房、左心室体积增大,心包见少量积液。诊断为右肺中叶肺炎。2018-12-11胸部CT:双肺见斑片状大片状密度增高影,双侧胸腔少量积液。②2018-12-09心电图:心房颤动伴快速心室率,左前分支传导阻滞。③2018-12-12血气:吸氧10 L/min,pH 7.31,PCO2 49.9 mmHg,PO2 69 mmHg,Hct 46%,SO2 96.6%,SBE 1.3 mmol/L。
入院诊断:①重症肺炎,双侧 PSI 183分,Ⅰ型呼吸衰竭;②Ⅱ型糖尿病。
2. 抗感染主要治疗过程
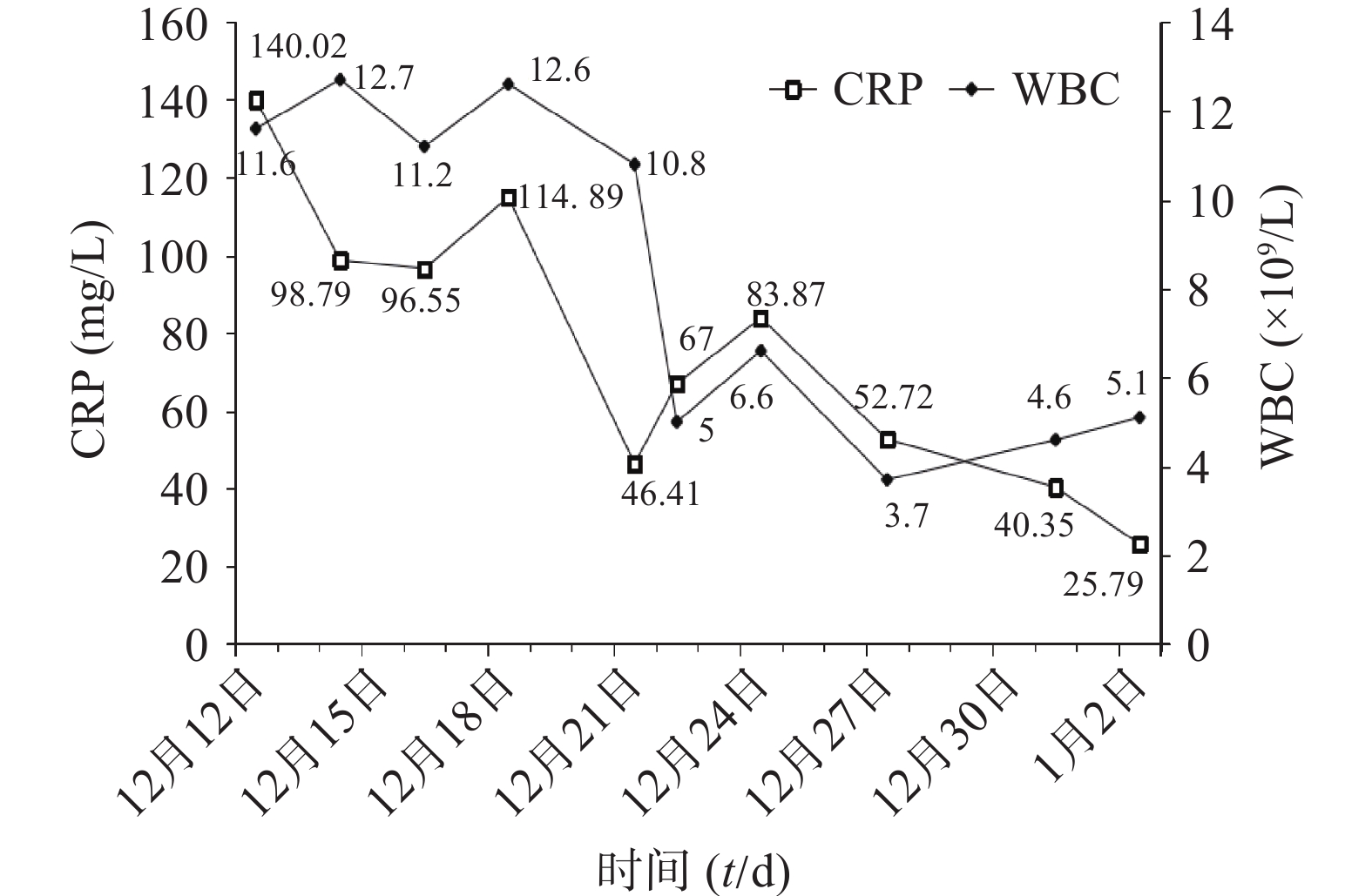
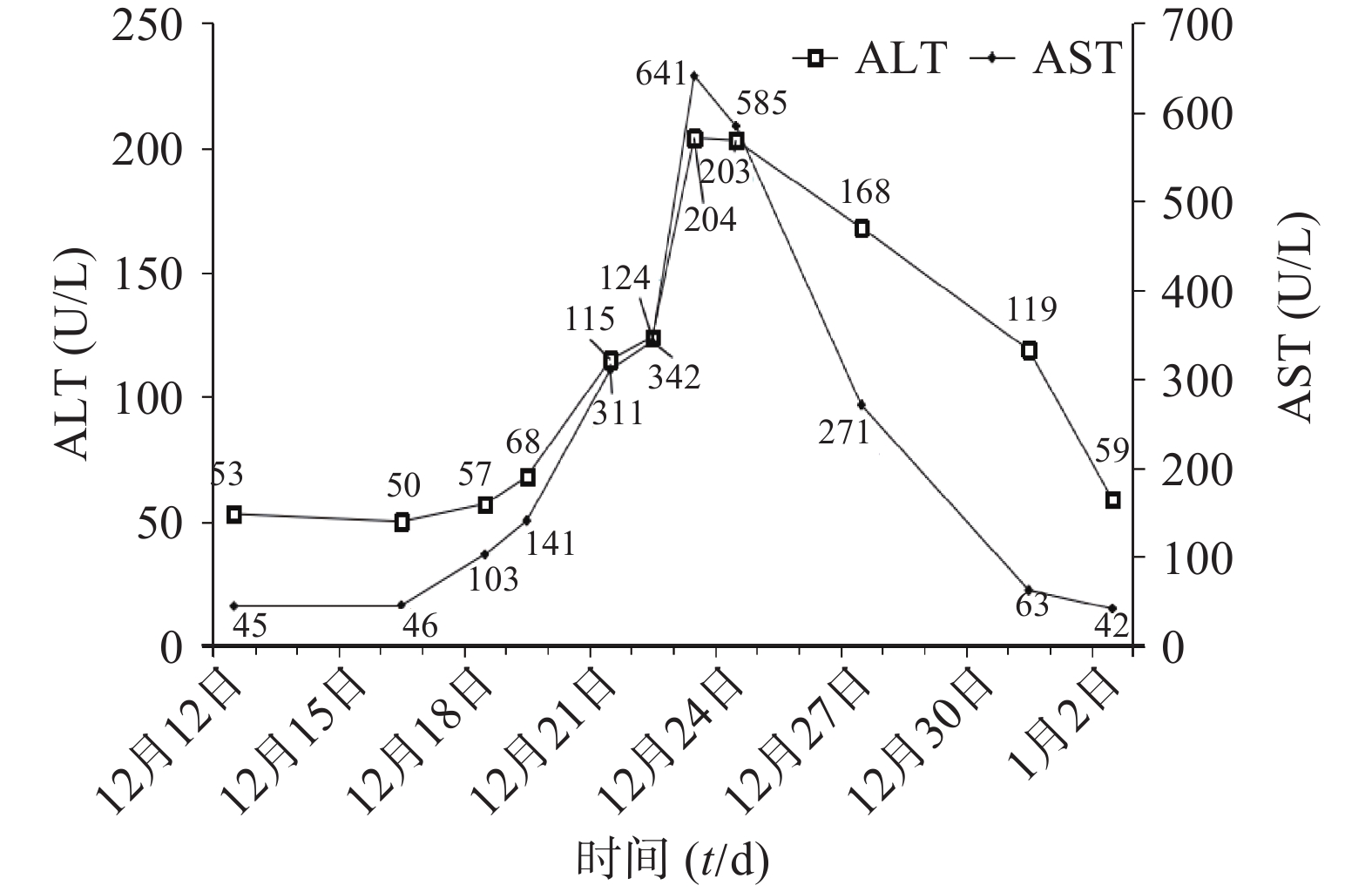
患者入科后完善相关检查(血常规、肝肾功能、电解质、血气、CRP)等,抗感染治疗前留取血培养、痰培养、尿培养行病原学检查。初始经验性予替考拉宁0.2 g qd ivgtt联合亚胺培南-西司他丁钠0.5 g q8h ivgtt抗菌治疗,同时予抗凝、营养支持、补液等对症支持治疗。12月14日(D3),体温较前升高,最高39.1℃,血常规:白细胞(WBC)12.7×109/L,中性粒细胞百分比(N%)95.9%,CRP 98.79 mg/L。呼吸机有创通气,气管镜检查:咽喉部较多黄色痰痂形成,黏膜充血,水肿较明显,尤以右侧气管主支气管及各级支气管炎性改变。患者感染加重,医师和药师共同讨论后,方案调整为亚胺培南-西司他丁钠0.5 g q6h ivgtt联合利奈唑胺0.6 g q12h ivgtt。12月16日(D5),Tmax 39℃,血常规:WBC 11.2×109/L,N% 96.9%,CRP 96.55 mg/L。双肺呼吸音粗,湿啰音较前加重,胸部X线:双肺炎症较前进展。气道分泌物基因二代测序结果回报:鹦鹉热衣原体序列数38。气道吸出物普通培养:白念珠菌。抗感染方案调整为阿奇霉素0.5 g qd ivgtt、多西环素0.1 g q12h 胃管注入(首剂加倍)、氟康唑氯化钠0.4 g qd ivgtt。12月21日(D10),Tmax 37.4℃,化验报告:WBC 10.8×109/L,N% 93.4%,CRP 46.41 mg/L,总胆红素(TBIL)18.4 U/L,丙氨酸氨基转移酶(ALT)115 U/L,天门冬氨酸氨基转移酶(AST)311 U/L。气管吸出物有少量白念珠菌,1,3-β-D葡聚糖检测结果正常,胸部X线:右肺炎症,较前有所吸收。评价治疗有效。但患者肝酶水平持续升高,分析可能药物性肝损伤(DILI),加用多烯磷脂酰胆碱232.5 mg qd ivgtt联合异甘草酸镁200 mg qd ivgtt保肝治疗。12月22日(D11),Tmax 37℃,化验报告:WBC 5×109/L,N% 70.9%,CRP 67 mg/L,ALT 124 U/L,AST 342 U/L,仍维持原方案治疗。12月23日(D12),Tmax 37.7℃,气道吸出物未培养出白念株菌,ALT 204 U/L,AST 641 U/L,ALP 82 U/L,INR 1.79。患者肝酶急剧升高,抗感染方案调整为多西环素0.1 g q12h联合克拉霉素0.5 g q12h,密切监测患者肝功能。1月2日(D22),感染基本控制。出院后继续予多西环素片治疗同时水飞蓟宾葡甲胺片保肝,1周后经回访,预后良好。
其住院期间WBC、CRP指标变化见图1,肝功能变化见图2,主要治疗药物见表1。
表 1 住院期间主要治疗药物药物 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 D15 D16 D17 D18 D19 D20 D21 D22 亚胺培南-西司他丁钠 0.5 g q8h 0.5 g q6h 替考拉宁 0.2 g qd 利奈唑胺 0.6 g q12h 氟康唑氯化钠 400 mg qd 阿奇霉素 0.5 g qd 多西环素片 0.1 g q12h 克拉霉素片 0.5 g q12h 多烯磷脂酰胆碱 232.5 mg qd 异甘草酸镁 200 mg qd 3. 分析讨论
3.1 抗感染治疗方案评价和优化
患者重症社区获得性肺炎,据《中国成人社区获得性肺炎诊断和治疗指南(2016年版)》[3](简称《指南》)和《中国急诊重症肺炎临床实践专家共识》[4]指出,重症肺炎致病菌未能明确时,推荐广谱抗菌药物治疗。初始经验予替考拉宁0.2 g qd ivgtt覆盖G+菌,包括甲氧西林耐药的金黄色葡萄球菌(MRSA),亚胺培南-西司他丁钠0.5 g q8h ivgtt覆盖G-菌,包括产酶耐药菌,从药效学的角度考虑,选药合理。根据《替考拉宁临床应用剂量专家共识》[5],替考拉宁的血清蛋白结合率高,用于肺部感染时,推荐起始负荷剂量为400 mg(或6~12 mg/kg)q12h ivgtt,连用3次,维持剂量为6~12 mg/kg qd ivgtt,该患者肾功能正常,无需调整剂量,根据体重换算,替考拉宁0.2 g qd ivgtt剂量不足,建议给予负荷剂量,维持剂量调整为0.4 g qd ivgtt,医师考虑急诊科已使用过该药,暂不予负荷剂量,且患者年龄较大,有糖尿病史,肾功能指标处于正常范围下限,从安全性考虑,维持剂量仍给予0.2 g qd ivgtt,暂未采纳建议。3 d后,感染加重,医师和药师分析可能原因:①替考拉宁使用剂量不足。②存在MRSA或多重耐药的G+菌感染。考虑到利奈唑胺分子量小,组织穿透力强,肺泡中浓度较高,药师查阅资料发现利奈唑胺治疗G+菌感染尤其是MRSA的有效率及细菌清除率优于替考拉宁,肾功能不全和皮疹的不良反应发生率低于替考拉宁[6-8],但应注意监测患者的血小板、呕吐或腹泻的不良反应[9]。综合治疗效果和安全性考虑,将替考拉宁更换为利奈唑胺。根据《抗菌药物药代动力学/药效学理论临床应用专家共识》[10],重症感染时,亚胺培南-西司他丁钠可增加给药次数或延长滴注时间,以提高药物浓度超过最低抑菌浓度(MIC)的时间占给药间隔的百分率(%T>MIC)。同时,为达到优化治疗的目的,亚胺培南-西司他丁钠用法调整为0.5 g q6h ivgtt。
入院第5天,二代基因测序和气道吸出物培养分别提示鹦鹉热衣原体和白念珠菌感染。《指南》[3]推荐鹦鹉热衣原体感染首选多西环素、米诺环素。文献[11-12]报道,阿奇霉素治疗鹦鹉热衣原体感染的重症肺炎临床效果较好,亦有报道[1]对于鹦鹉热衣原体四环素类是一线治疗。考虑阿奇霉素和多西环素分别作用于核糖体50S和30S亚基,合用可起到协同作用。经查阅文献未发现四环素类联合大环内酯类治疗鹦鹉热衣原体感染的重症肺炎,但有研究表明[13-14]多西环素联合阿奇霉素治疗支原体肺炎的临床效果明显优于单药治疗。阿奇霉素联合多西环素治疗支原体或衣原体感染的非淋菌性尿道炎疗效优于阿奇霉素单药治疗,降低血清中炎症因子的表达,且不会增加不良反应[15]。该患者呼吸衰竭,感染较重,故采用阿奇霉素联合多西环素抗鹦鹉热衣原体治疗,感染控制较好,药师认为此方案合理,可为今后鹦鹉热衣原体重症肺炎患者临床治疗提供参考。
患者气道吸出物培养为白念珠菌,念珠菌是常见的院内条件致病菌,该患者为重症监护患者,行气管插管,免疫力低下,有糖尿病等基础疾病,应予抗真菌治疗。《中国成人念珠菌病诊断与治疗专家共识》[16]推荐选择棘白菌素类药物、氟康唑、伏立康唑或两性霉素B及脂质体。综合患者情况及经济因素,予氟康唑氯化钠0.4 g qd ivgtt。5 d后疗效评价,患者症状及感染指标好转,抗真菌治疗有效,继续维持治疗。
入院第8天至第11天,患者肝酶进行性升高(图2)。药师分析,感染已好转,可排除疾病引起的肝酶升高[17],且无肝炎相关病史及酒精滥用史,可能为DILI。有研究[18]表明抗感染药物(6.08%)是继传统中药/膳食补充剂(26.81%)、抗结核药物(21.99%)、抗肿瘤药物或免疫调节剂(8.34%)之后第4位引起DILI的药物。根据《EASL临床实践指南:药物性肝损伤(2019年)》[19],采用RUCAM量表,判断多西环素、阿奇霉素和氟康唑与DILI的关系为极可能。据《药物性肝损伤诊治指南(2015年)》[20]指出,发生DILI时,应权衡患者病情及用药利弊决定是否停用可疑药物。入院第12天,ALT(204 U/L)>3×ULN(ULN:参考值上限),且INR(1.79)>1.5,达到停药标准。考虑多种药物合用会增加肝脏负担,且抗真菌治疗已1周,患者感染症状明显好转,停用氟康唑。由于抗鹦鹉热衣原体治疗周期较长,保留一线药物多西环素,研究表明[21],克拉霉素的肝胆系统的不良反应低于阿奇霉素,最终抗感染方案调整为多西环素联合克拉霉素。10 d后,患者肝功能、炎症指标基本恢复正常。
3.2 保肝药物应用分析
根据《药物性肝损伤诊治指南(2015年)》[20],基于受损靶细胞类型的分类,该患者ALT(204 U/L)>3×ULN,且R(5.31)>5[R=(ALT实测值/ULN)/(ALP实测值/ULN)],为肝细胞损伤型DILI,可选用抗炎、肝细胞膜修复、解毒类保肝药。异甘草酸镁是第4代甘草酸制剂,NMPA批准治疗ALT急剧升高的急性肝细胞型或混合型DILI,有效减轻炎性细胞浸润及肝细胞变性、坏死[22]。多烯磷脂酰胆碱是肝细胞膜的天然成分,通过影响膜结构使受损的肝功能和酶活力恢复正常,促进肝组织再生。该患者肝损伤进展较快,解毒类还原型谷胱甘肽起效较慢[23],建议多烯磷脂酰胆碱联合异甘草酸镁保肝治疗,医师采纳。
3.3 药学监护及患者教育
患者此次治疗过程中抗菌药物应用较多。利奈唑胺最常见的不良反应为骨髓抑制。替考拉宁具有耳、肾毒性,滴注过快会引起红人综合征。氟康唑和阿奇霉素合用,可导致QT间期延长风险增加。异甘草酸镁可引发假性醛固酮增多症,长期或大剂量使用,可引起低钾血症、水钠潴留及体重增加。药师密切监护,均未出现上述不良反应。多西环素、氟康唑、阿奇霉素、克拉霉素均有肝损伤的不良反应,监护期间发现患者肝酶进行性升高,药师结合患者病情,查阅资料,协助医师及时调整治疗方案,最终,感染控制,肝酶基本恢复正常。
患者服用多西环素片,应大量水送服,并保持体位直立30 min以上,用药期间不要直接暴露于阳光或紫外线下,一旦皮肤有红斑应立即停药。水飞蓟宾葡甲胺片偶可引起头晕、上腹部不适等反应,如不耐受,请及时就医。用药期间注意发生二重感染,定期随访血常规、肝功能及胸部CT。患者是养鸟爱好者,应注意保持养鸟环境卫生,在清洁粪便时,提倡应用“湿式作业”,以免微生物扩散到空气中,被吸入人体而感染。
-
[1] BORTLIK M, DURICOVA D, MALICKOVA K, et al. Infliximab trough levels may predict sustained response to infliximab in patients with Crohn's disease[J]. J Crohns Colitis,2013,7(9):736-743. [2] HIBI T, SAKURABA A, WATANABE M, et al. Retrieval of serum infliximab level by shortening the maintenance infusion interval is correlated with clinical efficacy in crohnʼs disease[J]. Inflamm Bowel Dis,2012,18(8):1480-1487. [3] OH E H, KO D H, SEO H, et al. Clinical correlations of infliximab trough levels and antibodies to infliximab in South Korean patients with Crohn's disease[J]. World J Gastroenterol,2017,23(8):1489-1496. [4] NAKASE H. Optimizing the use of current treatments and emerging therapeutic approaches to achieve therapeutic success in patients with inflammatory bowel disease[J]. Gut Liver,2020,14(1):7-19. [5] 中华医学会消化病学分会炎症性肠病学组. 中国炎症性肠病治疗药物监测专家共识意见[J]. 中华消化杂志, 2018, 38(11):721-727. [6] Division of Therapeutic Drug Monitoring, Chinese Pharmacological Society;Hospital Pharmacy Committee of Chinese Pharmaceutical Association;Evidence-Based Pharmacy Committee of Chinese Pharmaceutical Association;Chinese Pharmacists Association Therapeutic Drug Monitoring Pharmacists Branch;Chinese Pharmacists Association Home-Based Pharmaceutical Care Pharmacists Branch;Writing Group of the Expert Consensus on the Interpretation of Therapeutic Drug Monitoring;. 治疗药物监测结果解读专家共识[J]. 中国医院药学杂志, 2020, 40(23):2389-2395. [7] KEIZER R J, HUITEMA A D, SCHELLENS J H, et al. Clinical pharmacokinetics of therapeutic monoclonal antibodies[J]. Clin Pharmacokinet,2010,49(8):493-507. [8] BRANDSE J F, MOULD D, SMEEKES O, et al. A real-life population pharmacokinetic study reveals factors associated with clearance and immunogenicity of infliximab in inflammatory bowel disease[J]. Inflamm Bowel Dis,2017,23(4):650-660. [9] FASANMADE A A, ADEDOKUN O J, BLANK M, et al. Pharmacokinetic properties of infliximab in children and adults with Crohn's disease: a retrospective analysis of data from 2 phase III clinical trials[J]. Clin Ther,2011,33(7):946-964. [10] DOTAN I, RON Y, YANAI H, et al. Patient factors that increase infliximab clearance and shorten half-life in inflammatory bowel disease: a population pharmacokinetic study[J]. Inflamm Bowel Dis,2014,20(12):2247-2259. [11] FASANMADE A A, ADEDOKUN O J, OLSON A, et al. Serum albumin concentration: a predictive factor of infliximab pharmacokinetics and clinical response in patients with ulcerative colitis[J]. Int J Clin Pharmacol Ther,2010,48(5):297-308. [12] HARTMAN C, ELIAKIM R, SHAMIR R. Nutritional status and nutritional therapy in inflammatory bowel diseases[J]. World J Gastroenterol,2009,15(21):2570-2578. [13] ZACHOS M, TONDEUR M, GRIFFITHS A M. Enteral nutritional therapy for induction of remission in Crohn's disease[J]. Cochrane Database Syst Rev,2007(1):CD000542. 期刊类型引用(2)
1. 杨亚如,宫亚娅,孙洪岩. 肺泡灌洗液tNGS确诊鹦鹉热衣原体肺炎2例并文献复习. 淮海医药. 2024(05): 542-546 .  百度学术
百度学术2. 刘茹悦,闫燕羽,祁梦雷,刘维英. 鹦鹉热衣原体感染重症肺炎1例及文献分析. 中国医药导报. 2022(30): 188-191 .  百度学术
百度学术其他类型引用(0)
-

 点击查看大图
点击查看大图
计量
- 文章访问数: 3067
- HTML全文浏览量: 1701
- PDF下载量: 24
- 被引次数: 2




 下载:
下载:

 下载:
下载:
