-
银屑病,俗称牛皮藓,是一种由多种因素造成自身免疫应答紊乱的慢性炎症性皮肤病[1]。该病在欧美国家的发病率在1%~3%,在中国的发病率为0.5%[2]。目前,银屑病的发病机制尚不清楚,普遍认为与遗传、环境和免疫等因素有关[3]。银屑病发病病程长,难以治愈且易复发。根据发病特征可分为多种类型,其中,以斑块状银屑病最为常见[4]。临床常用生物制剂治疗银屑病,具有起效快和疗效更优的特点。近年来,用于治疗银屑病的生物制剂包括有TNF-α抑制剂、IL-12/23抑制剂、IL-17抑制剂和IL-23抑制剂。代表药物有阿达木单抗(adalimumab)、乌司奴单抗(ustekinumab)以及司库奇尤单抗(secukinumab)等[5-6]。这些药物疗效确切,但有对部分患者无效或者长期使用容易出现耐受的问题[7]。bimekizumab(bim)是优时比制药为克服上述问题开发的第一个针对IL-17A和IL-17F的双重抑制剂,2021年8月在获欧盟批准上市。多项临床研究显示,bim治疗银屑病有良好疗效,但国内外没有关于bim治疗斑块状银屑病的循证医学证据,同时探索bim与已经上市的一些药物的疗效对比差异,笔者期望通过系统评价bim治疗中重度斑块状银屑病的疗效与安全性,为临床使用bim提供更多证据与依据。
-
随机对照试验(RCT),中英文不限。
-
临床被诊断为中、重度斑块状银屑病的18岁以上(含18岁)患者[4],患病时间≥6个月,严重程度指数(PASI)评分≥12,银屑病累及体表面积(BSA)≥10%,研究者总体评估评分(IGA)评分≥3。
-
试验组采用bim,对照组采用安慰剂或其他药物治疗。
-
主要结局指标:第12周或者16周患者经治疗后PASI 90和PASI 100的患者例数;次要结局指标:第12周或者16周IGA达0或1的患者例数;安全性指标:第12周或者16周试验组和对照组患者发生的不良事件。
-
非RCT试验;研究对象为非斑块状银屑病的患者;未提供相关的结局指标。
-
在Cochrane Library、Pubmed、MEDLINE、EMBASE、Web of Science、知网、万方、维普、CBM等数据库检索符合标准的文献并手工检索纳入研究的参考文献,检索截止时间为2022年1月30日,语种仅限中英文。英文以bimekizumab、Psoriasis、randomized controlled trial。中文以bimekizumab、银屑病、随机对照试验为检索词。
-
由两位研究者分别对纳入的研究进行题目、摘要阅读,根据纳入和排除标准筛选文献,若有分歧再由第3位评价者来判定。提取内容包括第一作者、发表年份、研究对象例数、干预措施、研究对象年龄、体重、结局指标等信息。
-
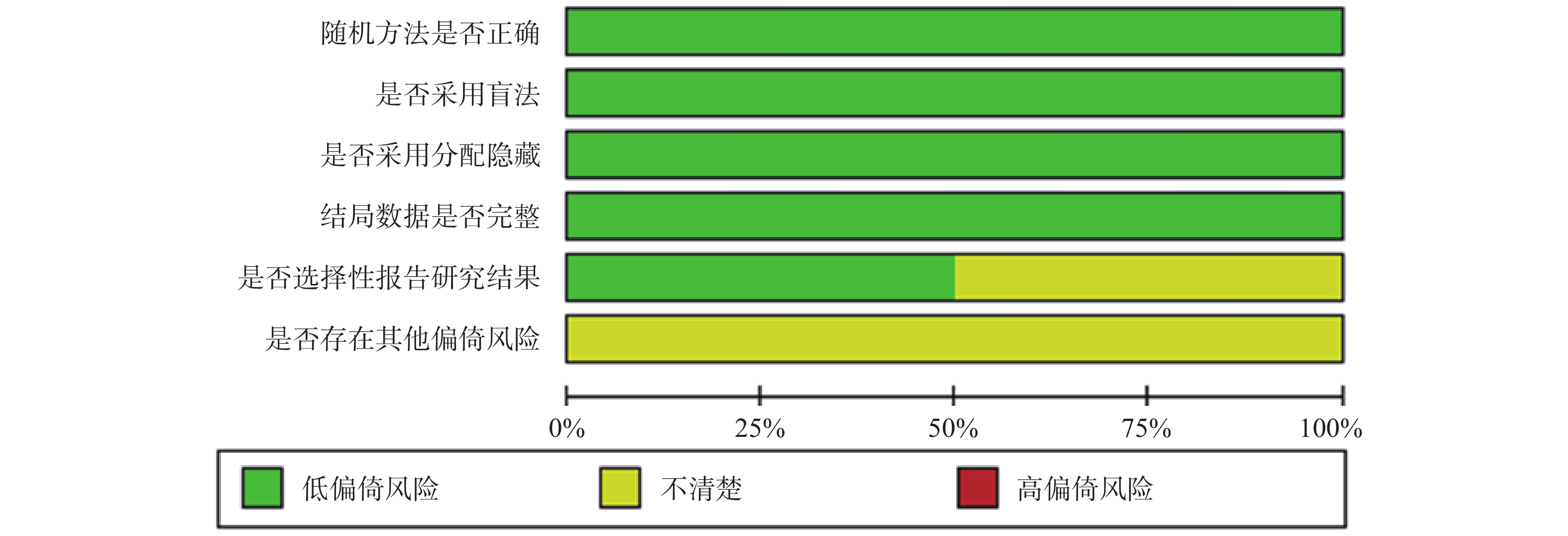
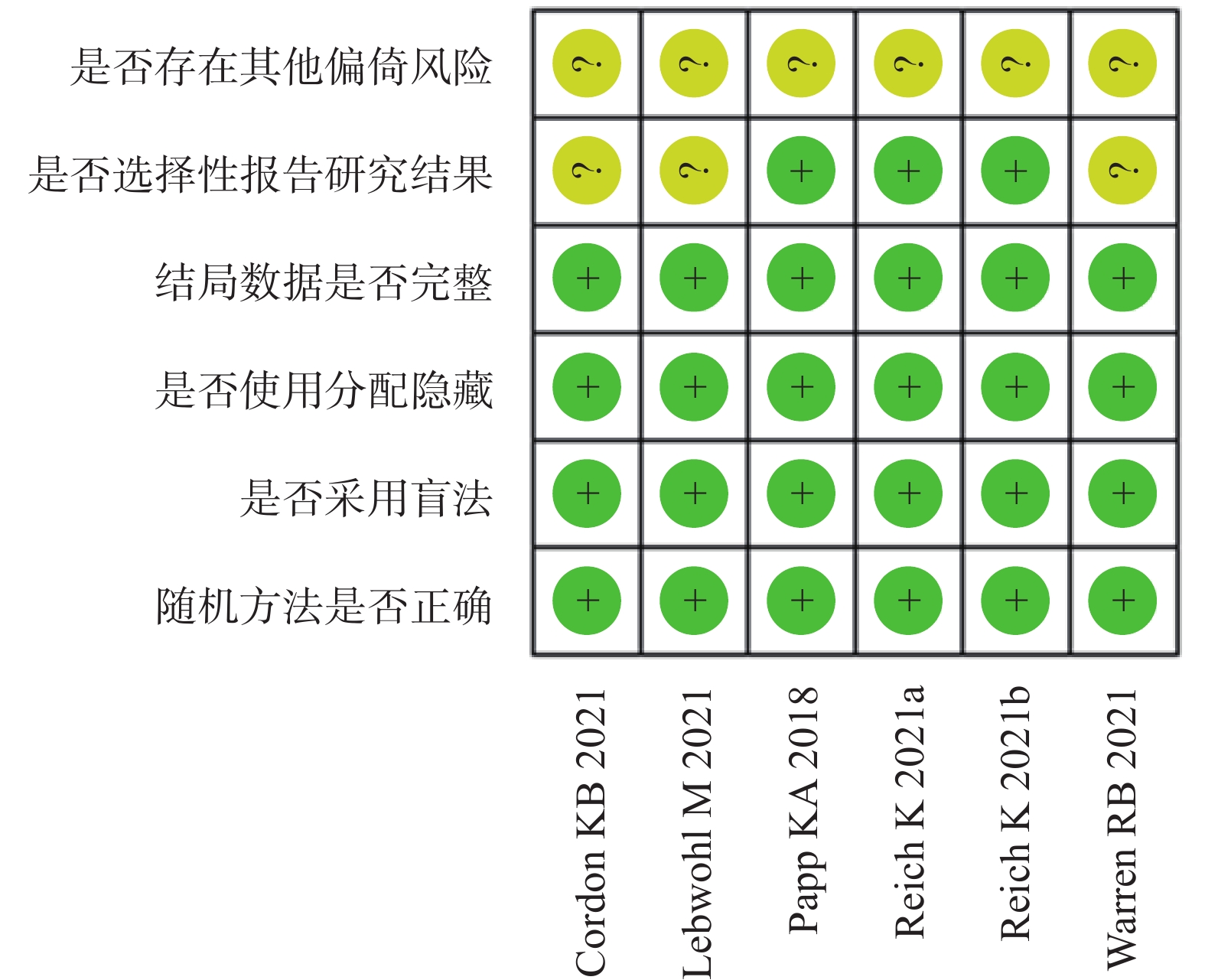
两位研究者独自采用Cochrane系统评价员手册5.1.0提供的偏倚风险评估工具对纳入的研究进行质量评价,从随机分配的产生方法、分配隐藏、双盲、结果数据是否完整、是否存在选择性报道及其他可能的偏倚来源等方面进行评价[8]。
-
采用RevMan 5. 3软件对纳入研究进行系统评价,二分类变量采用风险比(RR)或优势比(OR)表示效应量,连续性变量则采用加权均数差(WMD)表示,用95%可信区间(95%CI)进行区间估计。研究间的异质性用P值和I2检验评价,若P<0.05,I2>50% ,表明研究间具有异质性,分析异质性的可能来源,采用随机效应模型。若P>0.05,I2<50%,采用固定效应模型。
-
根据检索策略共检索到257篇文献,阅读标题和摘要剔除重复文献后得到得到87篇文献,阅读全文后,根据纳入和排除标准最后得到5篇文献[9-13],其中一篇文献报道了安慰剂和阳性药物两种对照组,按两项试验处理。因此,最终纳入5篇文献,6项研究,一共2308例患者,且6项研究均为RCT,发表语种均为英文,所有纳入研究的基线特征基本相似,文献筛选流程见图1,纳入的文献的基本特征见表1。
表 1 纳入研究的基本特点
研究 例数(n) 干预措施 年龄 体重(m/g) 病程/年 PASI/分 结局指标 Warren RB 2021[9] 319
159bim, 320mg, sc
ada, 40mg, sc45.3±13.2
45.5±14.389.6±21.4
90.5±22.120.4±13.2
16.2±11.920.5±6.9
19.0±5.9PASI90/100 IGA0或1
不良反应Reich K 2021a[10] 321
163bim, 320mg, sc
ust,45mg/90mg, sc45.2±14.0
46.0±13.688.7±23.1
87.2±21.116.0±11.6
17.8±11.622.0±8.6
21.3±8.3PASI90/100 IGA0或1
不良反应Reich K 2021b[10] 321
83bim, 320mg, sc
placebo45.2±14.0
49.7±13.688.7±23.1
89.1±26.416.0±11.6
19.7±13.822.0±8.6
20.1±6.8PASI90/100 IGA0或1
不良反应Papp KA 2018[11] 43
42bim, 320mg, sc
placebo42.5±13.6
46.7±12.386.9±21.7
88.8±21.215.9±9.5
15.0±11.819.4±6.4
18.9±5.8PASI90/100 IGA0或1
不良反应Lebwohl M 2021[12] 373
370bim, 320mg, sc
sec, 300mg, sc45.9±14.2
44.0±14.790.1±21.3
88.8±20.018.4±13.1
17.2±12.320.2±7.5
19.7±6.7PASI90/100 IGA0或1
不良反应Gordon K B 2021[13] 349
86bim, 320mg, sc
placebo44.5±12.9
43.5±13.188.7±20.6
91.7±22.219.6±13.3
19.1±12.820.4±7.6
20.1±7.6PASI90/100 IGA0或1
不良反应注:bim:bimekizumab,ada:阿达木单抗,ust:乌司奴单抗,sec:司库奇尤单抗,placebo:安慰剂,sc: 皮下注射,PASI: 银屑病皮损面积和严重程度指数 -
纳入的5[9-13]篇文献,6项研究均报道随机方法是由交互式语音应答系统产生,所有研究都为双盲,结果完整,3项研究未进行选择性报道和所有研究的其他偏倚风险均不清楚,纳入的研究的具体质量评价见表2,偏倚风险评价见图2、图3。
表 2 纳入研究质量评价表
-
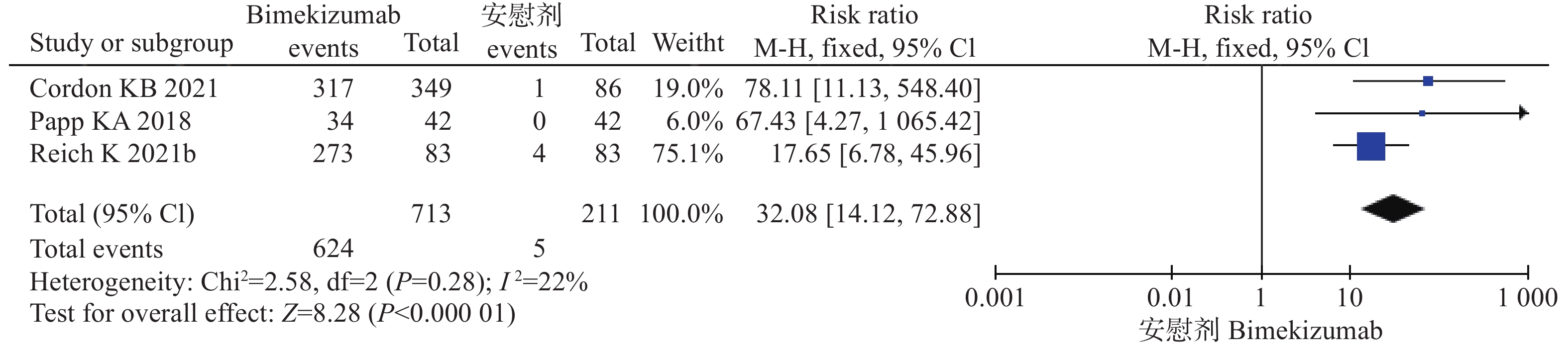
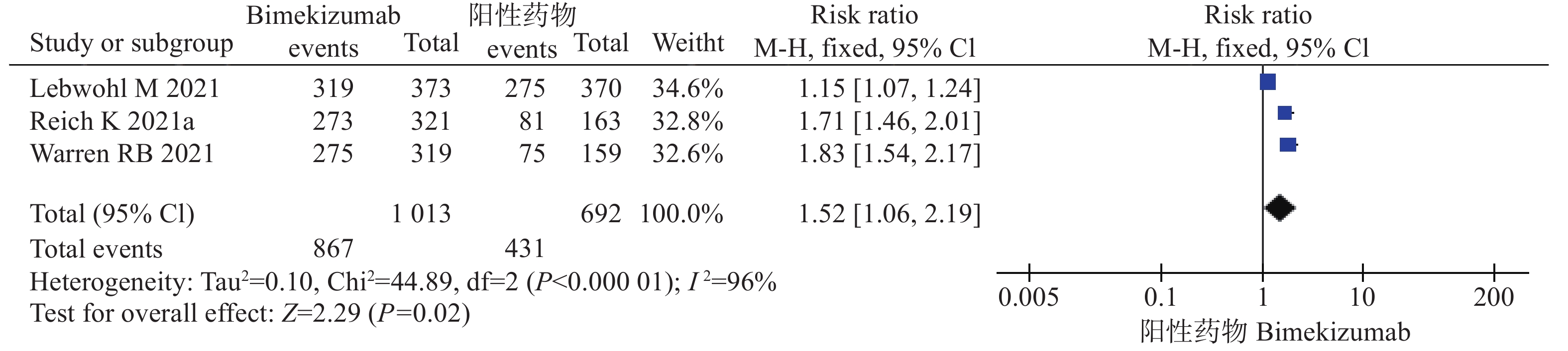
6项试验[9-13]均报道了PASI 90,其中3项研究[10-11,13]均是bim与安慰剂比较,另外3项研究[9-10,12]比较的是bim与阳性药物对PASI 90的作用。因此,将6项研究按照对照组的不同分为两组分别进行系统评价。结果显示,在bim与安慰剂对照中,各研究间不存在统计学异质性( P=0.28),采用固定效应模型进行分析。经过治疗后,bim组达到PASI 90的患者比例多于对照组,差异具有统计学意义(风险比=32.08,95%CI [14.12,72.88],P<0.00001)。在bim与阳性药物对照中,各研究间异质性存在统计学异质性( P<0.05),采用随机效应模型进行分析。经过治疗后,bim组达到PASI 90的患者比例多于阳性药物对照组,差异具有统计学意义(风险比=1.52,95%CI [1.06,2.19],P=0.02),见图4、5和表3。
表 3 有效性结局指标系统评价
结局指标 纳入研究 系统评价结果 异质性 风险比 95%CI P P I2(%) 效应模型 bim与安慰剂 PASI 90 3[10,11,13] 32.08 (14.12,72.88) <0.00001 0.28 22 固定 PASI 100 3[10,11,13] 67.62 (16.43,278.28) <0.00001 0.93 0 固定 IGA0/1 3[10,11,13] 24.19 (11.39,51.37) <0.00001 0.30 44 固定 bime与阳性药物 PASI 90 3[9-10,12] 1.52 (1.06,2.19) 0.02 <0.05 96 随机 PASI 100 3[9-10,12] 2.11 (1.22,3.66) 0.008 <0.05 97 随机 IGA0/1 3[9-10,12] 1.59 (1.00,2.53) 0.05 <0.05 94 随机 -
6项试验[9-13]均报道了PASI 100,将6项研究按照对照组的不同分为两组分别进行系统评价。结果显示,在bim与安慰剂对照中,各研究间不存在统计学异质性( P=0.93),采用固定效应模型进行分析。经过治疗后,bim组达到PASI 100的患者比例多于安慰剂组,差异具有统计学意义(风险比=67.62,95%CI [16.43,278.28],P<0.00001)。在bim与阳性药物对照中,各研究间存在统计学异质性( P<0.05),采用随机效应模型进行分析。经过治疗后,bim组达到PASI 100的患者比例多于对照组,差异具有统计学意义(风险比=2.11,95%CI [1.22,3.66],P=0.008),具体见表3。
-
6项试验[9-13]均报道了IGA评分结果,将6项研究按照对照组的不同分为两组分别进行系统评价。结果显示,在bim与安慰剂对照中,各研究间不存在统计学异质性( P=0.30),采用固定效应模型进行分析。经过治疗后,bim组达到IGA评分0或者1的患者比例多于对照组,差异具有统计学意义(风险比=24.19,95%CI [11.39,51.37],P<0.00001)。在bim与阳性药物对照中,各研究间存在统计学异质性(P<0.05),与阳性药物对比,bim组达到IGA评分0或者1的患者比例相当,差异无统计学意义(P=0.05),见表3。
-
6项试验[9-13]均报道了不良事件发生例数,将6项研究按照对照组的不同分为两组,分别进行系统评价。两组中各研究组间不存在统计学异质性(P=0.75,0.31),均采用固定效应模型进行分析。经过治疗后,与安慰剂对照,bim组不良事件发生率多于安慰剂组,差异具有统计学意义(风险比=1.38,95%CI [1.17,1.64],P=0.0002)。而阳性药物组与bim比较差异无统计学意义(P=0.06),见表4。
表 4 安全性分析结局指标
结局指标 纳入研究 系统评价结果 异质性 风险比 95%CI P P I2(%) 效应模型 bim与阳性药物 3[9-10,12] 1.06 (1.00,1.13) 0.06 0.75 0 固定 总不良事件 严重不良反应 3[9-10,12] 0.90 (0.55,1.45) 0.32 0.61 0 固定 上呼吸道感染 3[9-10,12] 0.92 (0.79,1.07) 0.28 0.95 0 固定 口腔念珠菌感染 3[9-10,12] 8.73 (4.80,15.84) <0.00001 0.30 16 固定 bim与安慰剂 3[10,11,13] 1.38 (1.17,1.64) 0.0002 0.31 13 固定 总不良事件 严重不良反应 3[10,11,13] 0.62 (0.22,1.80) 0.38 0.90 0 固定 上呼吸道感染 3[10,11,13] 0.73 (0.36,1.47) 0.37 0.41 0 固定 口腔念珠菌感染 3[10,11,13] 11.34 (2.11,60.86) 0.005 0.93 0 固定 鼻咽炎 3[10,11,13] 1.40 (0.79,2.48) 0.25 0.54 0 固定 -
6项试验[9-13]均报道了严重不良事件发生例数,将6项研究按照对照组的不同分为两组分别进行系统评价。两组中各研究组间不存在统计学异质性( P =0.90,0.61),均采用固定效应模型进行分析。经过治疗后,与安慰剂和阳性药物对比,bim组严重不良事件发生率差异均无统计学意义(P=0.38,0.32),见表4。
-
6项试验[9-13]报道了上呼吸道感染、口腔念珠菌感染和鼻咽炎,将6项研究按照对照组的不同分为两组分别进行系统评价。两组中各研究组间不存在统计学异质性( P>0.05),均采用固定效应模型进行分析。经过治疗后,与安慰剂和阳性药物对照,上呼吸道感染和鼻咽炎差异均无统计学意义(P>0.05)。但是bim组的口腔念珠菌感染的发生率多于安慰剂组,也多于阳性药物组(与安慰剂对比:风险比=11.34,95%CI [2.11,60.86],P=0.005), 与阳性药物对比:风险比=8.73,95%CI [4.80,15.84],P<0.00001),见表4。
-
对bim与阳性药物对照的有效性指标(异质性较大)进行敏感性分析,去除Lebwohl[12]研究,结果变化见表5,IGA评分0或1的患者比例有所改变,由与对照组相比无统计学差异变为优于对照组,其他结果无变化(试验组优于对照组),去除权重大的研究并未改变系统评价得到的结论。
表 5 敏感性分析
指标 剔除前 剔除后 风险比 95%CI P 风险比 95%CI P PASI 90 1.52 (1.06,2.19) 0.02 1.77 (1.57,1.98) <0.00001 PASI 100 2.11 (1.22,3.66) 0.008 2.66 (2.15,3.30) <0.00001 IGA 0或1 1.59 (1.00,2.53) 0.05 1.96 (1.06,3.62) 0.03 -
银屑病作为一种系统性免疫炎症皮肤疾病,机制不明,难以治愈。银屑病发生过程中T细胞过度活化,其中,Th17细胞可特异性表达IL-17A和IL-17F引起炎症反应,bim可同时作用与IL-17A和IL-17F,发挥抗炎作用抑制银屑病的发展[14]。bim作为首个双重靶点抑制剂,临床研究中展现了良好的疗效和安全性。为了进一步分析bim的疗效,本次研究对bim的临床研究进行系统评价。结果显示,经过治疗后,bim组达到PASI 90,PASI 100和IGA评分达到0或1的患者比例均多于安慰剂组,提示bim对中重度的斑块状银屑病的疗效远优于安慰剂,疗效确切。同时与阳性药物对比,bim组达到PASI 90,PASI 100的患者多于对照组,IGA评分达到0或1的患者比例则无统计学差异,提示bim治疗中重度斑块状银屑病的疗效优于阿达木单抗、乌司奴单抗和司库奇尤单抗。出现此结果的可能原因,阿达木单抗通过作用于TNF发挥作用[15],乌司奴单抗通过抑制IL-12/23[16],司库奇尤单抗通过抑制IL-17A发挥作用[17],bim则是通过抑制双靶点IL-17A和IL-17F发挥作用,这种双靶点作用机制使得bim表现出更为强大的疗效,但系统评价结果中的IGA评分达到0或1的患者比例仅显示疗效相当,因此还需更多的与阳性药物对比的临床试验来证实结论。值得注意的是,在进行系统评价过程中,研究的异质性较高,可能与3项研究分别使用乌司奴单抗、阿达木单抗和司库奇尤单抗作为阳性对照有关,将异质性高的指标进行敏感性分析,试验组IGA评分达到0或1的患者比例优于阳性药物组,但并未改变本次系统评价得到的结论。
安全性方面结果显示,bim的总不良反应事件的发生率多于安慰剂,与阳性药物相当。在严重不良反应事件发生率上,bim与安慰剂和阳性药物对比无统计学差异。在导致上呼吸道感染和鼻咽炎方面,bim与安慰剂和阳性药物对比无统计学差异。但在导致口腔念珠菌感染方面,bim的发生率高于安慰剂组,也高于阳性药物对照组,提示bim的安全性良好,但口腔念珠菌感染率较高。有研究显示针对IL-17靶点的生物制剂会导致口腔念珠菌的感染率提高[18],而bim正是通过双重抑制IL-17发挥作用,其口腔念珠菌感染率确实相较于其他药物也有所提高,侧面印证本次研究结果。有综述认为IL-17的拮抗剂在严格监测下使用还是较为安全,严重不良反应罕见[19]。针对bim引起的念珠菌感染,使用过程中定期监测念珠菌发生的口腔感染,一般不良反应轻微,也可进行抗念珠菌治疗来保障患者的用药安全。
本研究的局限性:①纳入文献的语种限定为中文和英文,可能存在发表偏倚。②本次纳入的与阳性药物对照的研究不多,还需更多大样本,多中心的临床研究来进一步证实本次研究得到的结论。
综上所述,bim在治疗中重度斑块状银屑病的疗效显著,不良反应轻微可耐受,但临床使用过程中要注意口腔念珠菌的感染。
Efficacy and safety of bimekizumab in treatment of moderate/severe plaque psoriasis: a systematic review
-
摘要:
目的 探讨bimekizumab治疗中/重度斑块状银屑病的有效性和安全性。 方法 检索自建库以来到2022年1月Cochrane Library、Pubmed、MEDLINE、EMBASE、Web of Science、CBM、知网、万方、维普数据库关于bimekizumab治疗银屑病的随机对照试验(RCT),并使用RevMan5.3软件进行系统评价。 结果 共纳入5篇文献,6项研究,共有2308例中/重度银屑病患者。在有效性方面,与阳性药物相比,Bimekizumab组银屑病皮损面积和严重程度指数(PASI)改善大于90%(PASI 90),PASI 100的患者多于对照组,研究者总体评估评分(IGA)评分达到0或1的患者比例则无统计学差异(P=0.05)。与安慰剂组相比,Bimekizumab组达到PASI 90,PASI 100和IGA评分达到0或1的患者比例均多于安慰剂组。在安全性方面,Bimekizumab的总不良反应事件的发生率多于安慰剂(P=0.000 2),与阳性药物相当(P=0.06)。严重不良反应事件发生率,在呼吸道感染和鼻咽炎方面,Bimekizumab与安慰剂和阳性药物对比,无统计学差异(P>0.05)。但在导致口腔念珠菌感染方面,Bimekizumab的发生率高于安慰剂组(P=0.005),也高于阳性药物对照组(P<0.000 01)。 结论 Bimekizumab可安全、有效地治疗中/重度斑块状银屑病,但临床使用过程中需要注意监测口腔念珠菌的感染。 -
关键词:
- Bimekizumab /
- 银屑病 /
- 疗效 /
- 安全性 /
- 系统评价
Abstract:Objective To evaluate the efficacy and safety of bimekizumab in the treatment of moderate/severe plaque psoriasis. Methods Literatures from Cochrane Library, PubMed, Embase, CNKI, VIP databases from the establishment time to January of 2022 were retrieved. The Review manager 5.3 statistical software was used to systematical review. Results 5 publications, 6 RCTs met the inclusion criteria, which involved 2308 participants. In terms of efficacy, patients in the experimental group were more than positive medicine control group in PASI 90, PASI 100, no significantly statistical difference in IGA 0 or 1 cases (P=0.05). PASI 90, PASI 100 and IGA 0 or 1 cases of patients in the experimental group were higher than that of the placebo group . In the safety evaluation, the incidence of adverse reaction in experimental group was higher than the placebo group (P=0.000 2), which was the same as the positive medicine control group (P=0.06). The experimental group was no statistical difference compared with positive medicine control and the placebo group in the incidence of serious adverse events including upper respiratory tract infection and nasopharyngitis (P>0.05). But the rate of oral candidiasis in experimental group was higher than the positive medicine control group (P<0.000 01) and the placebo group (P=0.005). Conclusion bimekizumab could treat moderate/severe plaque psoriasis effectively and safely, and the oral candidiasis during the treatment should be noticed. -
Key words:
- Bimekizumab /
- psoriasis /
- efficacy /
- safety /
- systematic review
-
我国已经进入老年化社会,骨质疏松症的发病率也不断上升,因此,对骨质疏松疾病的预防、治疗和预后研究是骨科领域的重点[1]。骨质疏松的治疗方式以药物治疗为主,包括雌激素、双磷酸盐、降钙素等,实践证明上述药物能够提高患者的骨密度,但是不良反应较多,容易诱发免疫反应及血管扩张,不利于预后的恢复[2]。近年来,诸多研究中使用复方骨肽注射液对胸腰椎骨质疏松性骨折患者进行治疗,效果比较明确,能够作用于人体刺激新骨形成,且刺激成骨细胞增殖,调节钙、磷代谢,维持骨代谢的平衡,增加骨密度,进而可以改善关节周围的组织营养微循环,有效发挥抗炎镇痛效用,明显促进了患者的身体恢复[3-4]。但关于复方骨肽注射液应用于腰椎骨质疏松的腰椎功能恢复以及整体治疗有效率评价的研究还鲜有报道。本研究选取了96例骨质疏松患者为研究对象,通过探究复方骨肽注射液在骨质疏松治疗中对患者中医症状评分、骨代谢指标、骨质疏松程度、骨密度、疼痛程度以及腰椎功能恢复情况,为临床上应用与推广复方骨肽注射液提供科学理论依据。
1. 资料与方法
1.1 临床资料
选取2018年1月至2020年1月海警总队医院收治的96例胸腰椎骨质疏松性骨折患者为研究对象。所有患者随机被分为甲组(接受钙尔奇D治疗联合复方骨肽注射液)和乙组(接受钙尔奇D治疗),各48例。纳入条件:①患者符合胸腰椎骨质疏松的诊断标准[5];②患者的资料完整,且同意参与临床研究;③患者均有运动后加重腰背疼痛症状;④患者对本研究的药物不过敏。排除条件:①患者伴有其他因素导致的腰椎骨折;②患者及其家属拒绝签署知情同意书;③患者伴有影响骨代谢的疾病;④患者存在精神障碍,不适合参与研究。
甲组患者中,男性20例,女性28例,年龄58~80岁,平均(71.23±3.05)岁;病程3~11年,平均(6.01±0.58)年。乙组中,男性21例,女性27例,年龄59~80岁,平均(71.44±3.69)岁;病程3~12年,平均(6.36±0.57)年。两组的资料在性别、年龄、病程上差异无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准,患者和家属均对研究知情,自愿参与研究,已签署知情同意书。
骨质疏松症诊断标准[5]:根据世界卫生组织1994年制定的相关标准进行判定:①检测出骨密度较同年龄、性别、种族的成人骨峰值低于1个标准为正常;②检查出骨密度低于1~2.5个标准,判定为骨量减少;③若检测出骨密度降低超过2.5个标准,则为骨质疏松;在判定严重骨质疏松时,若患者符合以上标准,且同时伴有一处骨折即可。
1.2 方法
乙组患者在确诊疾病后,接受钙尔奇D(批准文号:国药准字H10950029,惠氏制药有限公司)治疗,口服600 mg/次,2次/d。
甲组在乙组的基础上,接受复方骨肽注射液(批准文号:国药准字H32020004,南京新百药业有限公司)静脉滴注,用法:将10 ml药液加入250 ml 0.9%氯化钠注射液中,1次/d。两组连续治疗45 d后,进行各项指标的对比。
1.3 观察指标
(1)统计患者治疗前、后的腰背痛手术评分[6],依据腰背痛中医症状评分表对患者实施判定,按照中华骨科学会脊柱学组的腰背痛评分标准:≥16分为优,11~15分为良,6~10分为可,0~5分为差。内容包含:大小便无力与会阴麻木感、腰背部疼痛感、下肢疼痛与麻木感、工作与生活能力、下肢功能、临床症状等,评分越高,则意味着身体恢复越好。
(2)对比两组的骨代谢生化指标,抽取患者空腹静脉血3 ml,离心处理后,采集血清样本,使用免疫分析法检测骨碱性磷酸酶(BALP)和Ⅰ型前胶原氨基端前肽(PIINP)水平。
(3)分析两组经过治疗后的骨质疏松程度[7],按照日本慈惠医大标准进行评估,腰3椎体骨小梁可分为4个等级,即0~3级,其中,0级代表骨小梁正常,3级代表纵行的骨小梁变模糊,而水平的骨量消失明显。
(4)使用骨密度检测仪,对两组用药前、后的骨密度指标进行对比。
(5)在患者治疗前、后采用视觉模拟评分表(VAS)对两组的腰背疼痛情况进行评估[8],使用方法:在一张纸上画一条长为10 cm的横线,一端用0表示(无痛),另一端用10表示(剧烈疼痛),指导患者凭借主观感受进行标记;使用腰椎疾患治疗成绩评分表[9](JOA)对患者的腰椎恢复情况进行对比,包含自觉症状、临床检查、日常活动等,总分29分,得分越高,意味着患者的腰椎功能恢复越好。
1.4 统计学分析
用SPSS 25.0软件分析数据,连续性资料采用(
$\bar x \pm s$ )描述,t检验进行分析,分类变量采用[n(%)]描述,χ2检验进行分析,单向有序资料采用秩和检验进行分析。所有统计数据以P<0.05表示差异有统计学意义。2. 结果
2.1 两组患者中医症状评分比较
两组患者,治疗后评分均高于治疗前(P<0.05);治疗后,两组患者中医症状评分差异有统计学意义,甲组优于乙组(P<0.05,表1)。
表 1 两组患者中医症状评分比较(n=48,$\bar x \pm s$ ,分)组别 治疗前 治疗后 t P 甲组 11.36±1.48 19.44±2.44*# 19.616 <0.05 乙组 11.66±1.69 14.33±2.01* 7.044 <0.05 t 0.767 11.199 P >0.01 <0.05 *P<0.05,与治疗前比较;#P<0.05,与乙组治疗后比较。 2.2 两组患者骨代谢指标水平比较
治疗后,两组患者骨代谢指标水平较治疗前下降,差异有统计学意义(P<0.05);其中,甲组患者治疗后BALP、PIINP水平低于乙组(P<0.05,表2)。
表 2 两组患者骨代谢水平指标比较(n=48,$\bar x \pm s$ )骨代谢指标 甲组 乙组 治疗前 治疗后 治疗前 治疗后 BALP(U/L) 368.34±25.07 211.69±19.55*# 368.96±24.88 289.23±20.52* PIINP(ng/ml) 58.44±13.55 38.11±5.02*# 58.66±13.58 46.63±4.58* t 85.518 59.581 75.845 79.942 P <0.05 <0.05 <0.05 <0.05 *P<0.05,与同组治疗前比较;#P<0.05,与乙组治疗后比较。 2.3 两组患者骨质疏松程度比较
治疗后,两组患者同等级骨质疏松程度差异有统计学意义(P<0.05),甲组3级骨质疏松患者比例低于乙组(P<0.05,表3)。
表 3 两组患者骨质疏松程度比较[例数(%)]组别 0级 1级 2级 3级 甲组(n=48) 28(58.33) 13(27.08) 5(10.42) 2(4.17)* 乙组(n=48) 20(41.67) 11(22.92) 9(18.75) 8(16.67) *P<0.05,与乙组3级骨质疏松患者比较。 2.4 两组患者治疗前后的骨密度比较
治疗后,两组患者骨密度差异有统计学意义(P<0.05),甲组的骨密度水平高于乙组(表4)。
表 4 两组患者治疗前、后的骨密度比较(n=48,$\bar x \pm s$ ,g/cm2)组别 治疗前 治疗后 t P 甲组 0.82±0.23 0.97±0.22* 3.625 <0.05 乙组 0.81±0.22 0.87±0.18 1.462 >0.01 t 0.218 2.437 − − P >0.01 <0.05 − − *P<0.05,与同组治疗前比较。 2.5 两组患者VAS、JOA评分
治疗后,甲组的VAS评分低于乙组(P<0.05),而JOA评分高于乙组(P<0.05),见表5。
表 5 两组患者的VAS、JOA评分(n=45,$\bar x \pm s$ ,分)组别 VAS JOA 治疗前 治疗后 治疗前 治疗后 甲组 7.38±0.35 3.19±0.41*# 16.01±2.32 25.66±1.44* 乙组 7.44±0.32 4.01±0.39* 15.66±3.15 21.22±1.88* t 0.877 10.040 0.620 12.990 P >0.01 <0.05 <0.05 <0.05 *P<0.05,与同组治疗前比较;#P<0.05,与乙组治疗后比较。 3. 讨论
3.1 骨质疏松疾病介绍
骨质疏松是以骨组织微结构破坏、骨量低而导致骨骼脆性增加为主要特征的一种全身性疾病,在老年人中高发[9]。绝经后女性中也有较大部分可发生骨质疏松,与绝经后骨吸收速度明显高于骨质生成的速度,引发了骨质的丢失有关[10]。
3.2 钙尔奇D在骨质疏松患者中的作用
机体内的胶原蛋白三重螺旋分子结构会跟随人的年龄增长而水解,当遭到重大破坏时,钙盐无法有效沉积,可导致骨矿流失增加,引起骨代谢异常发生。钙尔奇D中含有的钙质属于骨矿化的底物,可以满足机体对钙的需求,继而提高骨钙内环境的稳定性,也利于骨形成速度的增加,明显缓解骨质疏松的临床症状,在一定程度上避免了骨折的发生[11]。当前钙尔奇D已经在临床上被广泛应用,例如,治疗妊娠期妇女缺钙、佝偻病等。有研究[12]指出,钙尔奇D可以促进骨胶原的合成,有效抑制胶原的降解,显著增加骨密度,且对骨微结构进行改善。
3.3 复方骨肽注射液在骨质疏松患者中的作用
骨肽注射液中含有多肽类骨代谢因子、无机钙、有机钙、氨基酸、微量元素等,且同时含有多种骨生长因子,作用于人体后,可促进成骨细胞的增殖,也能够促进骨代谢水平的改善,随着时间的推移,新骨形成,且钙、磷代谢、骨代谢平衡改善明显,明显促进骨折的愈合[13]。另外,该药物能够将关节周围的组织营养微循环加以改善,能起到消炎镇痛的效用。
3.4 联合用药对骨密度、骨代谢的作用
骨密度是当前临床上用以评估骨骼情况的重要指标,其反映了骨质疏松的程度,且可以预测骨折的危险性,血清骨钙素属于成骨细胞合成以及分泌的元素,具有不受骨吸收因素影响的特点,稳定性较强,因此,临床上应用该指标对成骨细胞活动、骨细胞活动状态进行判定[14]。有研究[15]指出,机体的骨更新率高时,则血清骨钙素水平增加明显,而老年患者由于骨质疏松等原因,为低转换型,故而血清骨钙素水平增加的幅度一般。BALP、PIINP是反应骨代谢的生化指标,能够评价骨质疏松的程度,其中,PIINP是骨组织中的唯一胶原,占骨基质的90%以上,能够有效反映骨细胞活动及骨形成;而BALP属于ALP同工酶之一,属于成骨细胞,可以较为敏感地反映骨质疏松情况。
本研究中,两组患者骨密度、骨代谢水平治疗后均较治疗前改善(P<0.05),乙组患者BALP、PINP、骨密度水平均较甲组高(P<0.05)。钙尔奇D可以促进胶原合成,抑制胶原的降解,继而增加了骨密度,改善了骨结构。复方骨肽注射液作为一种复方制剂,含有较多有益成分,且含丰富的骨生长因子,对骨代谢水平具有较好的调节作用,两者联合能够更好地刺激骨细胞增殖,加快细胞的生长,故而促进了骨密度增加。
3.5 联合用药有效缓解骨质疏松的临床症状
骨痛是骨质疏松患者常见的临床症状之一,严重骨痛的患者被迫减少了日常活动,不仅影响生活质量,还可加重骨质疏松程度。本研究中,两组患者在中医症状评分、VAS、JOA评分上差异有统计学意义(P<0.05),复方骨肽注射液联合钙尔奇D治疗较单纯钙尔奇D治疗,对骨质疏松患者中医症状评分、VAS、JOA评分改善更好。在维生素D补充的基础上联合骨肽注射液治疗,较大程度地改善了骨密度以及骨代谢水平,缓解了临床症状,促进腰椎功能的恢复。此外,复方骨肽注射液中的成分还能够发挥消肿止痛作用,减轻疼痛程度,减少对生活自理能力的影响,有利于患者预后康复。
综上所述,复方骨肽注射液治疗骨质疏松患者具有较好效果,能够改善骨代谢、骨密度指标及骨质疏松程度,有利于缓解临床症状,可在骨质疏松治疗中应用推广。
-
表 1 纳入研究的基本特点
研究 例数(n) 干预措施 年龄 体重(m/g) 病程/年 PASI/分 结局指标 Warren RB 2021[9] 319
159bim, 320mg, sc
ada, 40mg, sc45.3±13.2
45.5±14.389.6±21.4
90.5±22.120.4±13.2
16.2±11.920.5±6.9
19.0±5.9PASI90/100 IGA0或1
不良反应Reich K 2021a[10] 321
163bim, 320mg, sc
ust,45mg/90mg, sc45.2±14.0
46.0±13.688.7±23.1
87.2±21.116.0±11.6
17.8±11.622.0±8.6
21.3±8.3PASI90/100 IGA0或1
不良反应Reich K 2021b[10] 321
83bim, 320mg, sc
placebo45.2±14.0
49.7±13.688.7±23.1
89.1±26.416.0±11.6
19.7±13.822.0±8.6
20.1±6.8PASI90/100 IGA0或1
不良反应Papp KA 2018[11] 43
42bim, 320mg, sc
placebo42.5±13.6
46.7±12.386.9±21.7
88.8±21.215.9±9.5
15.0±11.819.4±6.4
18.9±5.8PASI90/100 IGA0或1
不良反应Lebwohl M 2021[12] 373
370bim, 320mg, sc
sec, 300mg, sc45.9±14.2
44.0±14.790.1±21.3
88.8±20.018.4±13.1
17.2±12.320.2±7.5
19.7±6.7PASI90/100 IGA0或1
不良反应Gordon K B 2021[13] 349
86bim, 320mg, sc
placebo44.5±12.9
43.5±13.188.7±20.6
91.7±22.219.6±13.3
19.1±12.820.4±7.6
20.1±7.6PASI90/100 IGA0或1
不良反应注:bim:bimekizumab,ada:阿达木单抗,ust:乌司奴单抗,sec:司库奇尤单抗,placebo:安慰剂,sc: 皮下注射,PASI: 银屑病皮损面积和严重程度指数 表 2 纳入研究质量评价表
表 3 有效性结局指标系统评价
结局指标 纳入研究 系统评价结果 异质性 风险比 95%CI P P I2(%) 效应模型 bim与安慰剂 PASI 90 3[10,11,13] 32.08 (14.12,72.88) <0.00001 0.28 22 固定 PASI 100 3[10,11,13] 67.62 (16.43,278.28) <0.00001 0.93 0 固定 IGA0/1 3[10,11,13] 24.19 (11.39,51.37) <0.00001 0.30 44 固定 bime与阳性药物 PASI 90 3[9-10,12] 1.52 (1.06,2.19) 0.02 <0.05 96 随机 PASI 100 3[9-10,12] 2.11 (1.22,3.66) 0.008 <0.05 97 随机 IGA0/1 3[9-10,12] 1.59 (1.00,2.53) 0.05 <0.05 94 随机 表 4 安全性分析结局指标
结局指标 纳入研究 系统评价结果 异质性 风险比 95%CI P P I2(%) 效应模型 bim与阳性药物 3[9-10,12] 1.06 (1.00,1.13) 0.06 0.75 0 固定 总不良事件 严重不良反应 3[9-10,12] 0.90 (0.55,1.45) 0.32 0.61 0 固定 上呼吸道感染 3[9-10,12] 0.92 (0.79,1.07) 0.28 0.95 0 固定 口腔念珠菌感染 3[9-10,12] 8.73 (4.80,15.84) <0.00001 0.30 16 固定 bim与安慰剂 3[10,11,13] 1.38 (1.17,1.64) 0.0002 0.31 13 固定 总不良事件 严重不良反应 3[10,11,13] 0.62 (0.22,1.80) 0.38 0.90 0 固定 上呼吸道感染 3[10,11,13] 0.73 (0.36,1.47) 0.37 0.41 0 固定 口腔念珠菌感染 3[10,11,13] 11.34 (2.11,60.86) 0.005 0.93 0 固定 鼻咽炎 3[10,11,13] 1.40 (0.79,2.48) 0.25 0.54 0 固定 表 5 敏感性分析
指标 剔除前 剔除后 风险比 95%CI P 风险比 95%CI P PASI 90 1.52 (1.06,2.19) 0.02 1.77 (1.57,1.98) <0.00001 PASI 100 2.11 (1.22,3.66) 0.008 2.66 (2.15,3.30) <0.00001 IGA 0或1 1.59 (1.00,2.53) 0.05 1.96 (1.06,3.62) 0.03 -
[1] YANG Y W, KELLER J J, LIN H C. Medical comorbidity associated with psoriasis in adults: a population-based study[J]. Br J Dermatol,2011,165(5):1037-1043. doi: 10.1111/j.1365-2133.2011.10494.x [2] RACHAKONDA T D, SCHUPP C W, ARMSTRONG A W. Psoriasis prevalence among adults in the United States[J]. J Am Acad Dermatol,2014,70(3):512-516. doi: 10.1016/j.jaad.2013.11.013 [3] 朱雨雨, 宋承霖, 孙洋. 银屑病发病机制及药物调控研究进展[J]. 药学学报, 2020, 55(7):1393-1400. doi: 10.16438/j.0513-4870.2019-1071 [4] 中华医学会皮肤性病学分会银屑病专业委员会. 中国银屑病诊疗指南(2018完整版)[J]. 中华皮肤科杂志, 2019, 52(10):667-710. [5] RADKE B. Psoriasis: pathogenesis and treatment[J]. Med Monatsschr Pharm,1993,16(10):312-313. [6] 马晓蕾, 周城, 蔡林, 等. 生物制剂治疗银屑病的研究进展[J]. 临床皮肤科杂志, 2012, 41(9):577-579. doi: 10.3969/j.issn.1000-4963.2012.09.031 [7] REIS J, VENDER R, TORRES T. Bimekizumab: the first dual inhibitor of interleukin (IL)-17A and IL-17F for the treatment of psoriatic disease and ankylosing spondylitis[J]. BioDrugs,2019,33(4):391-399. doi: 10.1007/s40259-019-00361-6 [8] HIGGINS J P T, ALTMAN D G, GØTZSCHE P C, et al. The Cochrane Collaboration's tool for assessing risk of bias in randomised trials[J]. BMJ,2011,343:d5928. doi: 10.1136/bmj.d5928 [9] WARREN R B, BLAUVELT A, BAGEL J, et al. Bimekizumab versus adalimumab in plaque psoriasis[J]. N Engl J Med,2021,385(2):130-141. doi: 10.1056/NEJMoa2102388 [10] REICH K, PAPP K A, BLAUVELT A, et al. Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52-week, multicentre, double-blind, active comparator and placebo controlled phase 3 trial[J]. Lancet,2021,397(10273):487-498. doi: 10.1016/S0140-6736(21)00125-2 [11] PAPP K A, MEROLA J F, GOTTLIEB A B, et al. Dual neutralization of both interleukin 17A and interleukin 17F with bimekizumab in patients with psoriasis: results from BE ABLE 1, a 12-week randomized, double-blinded, placebo-controlled phase 2b trial[J]. J Am Acad Dermatol,2018,79(2):277-286.e10. doi: 10.1016/j.jaad.2018.03.037 [12] REICH K, WARREN R B, LEBWOHL M, et al. Bimekizumab versus secukinumab in plaque psoriasis[J]. N Engl J Med,2021,385(2):142-152. doi: 10.1056/NEJMoa2102383 [13] GORDON K B, FOLEY P, KRUEGER J G, et al. Bimekizumab efficacy and safety in moderate to severe plaque psoriasis (BE READY): a multicentre, double-blind, placebo-controlled, randomised withdrawal phase 3 trial[J]. Lancet,2021,397(10273):475-486. doi: 10.1016/S0140-6736(21)00126-4 [14] 沈盛县. Bimekizumab单抗双重中和白细胞介素-17A和IL-17F治疗中重度斑块状银屑病[J]. 实用皮肤病学杂志, 2019, 12(3):170. [15] 安富荣, 崔岚, 王勤. 阿达木单抗治疗自身免疫疾病的临床研究进展[J]. 中国新药与临床杂志, 2010, 29(6):410-415. [16] 王理, 李兵, 杨森. 乌司奴单抗治疗银屑病的研究进展[J]. 国际皮肤性病学杂志, 2013, 39(6):384-387. [17] 朱冠男, 王刚. 白细胞介素17A在银屑病发病及治疗中的研究进展[J]. 中华皮肤科杂志, 2020, 53(5):390-394. [18] 陈小利, 王萍, 白根龙, 等. 古塞奇尤单抗治疗中重度斑块状银屑病疗效与安全性的meta分析[J]. 重庆医学, 2021, 50(6):1023-1028. doi: 10.3969/j.issn.1671-8348.2021.06.026 [19] 王若珺, 李若瑜. 白细胞介素17A及其受体拮抗剂治疗银屑病的不良反应[J]. 中华皮肤科杂志, 2021, 54(2):170-173. 期刊类型引用(3)
1. 李长秀,李振山,张晗,高菲,李晋,王婧,侯大鹏,刘燕琳. 基于蒙特卡洛模拟和药动学/药效学模型评价替加环素脑室注射治疗泛耐药鲍曼不动杆菌颅内感染的给药方案. 中华神经医学杂志. 2024(04): 379-386 .  百度学术
百度学术2. 刘晓芹,李涛,董华,李文. 新型二维色谱系统建立重症医院获得性肺炎患者中替加环素含量的测定方法研究. 中国实用医药. 2023(19): 170-172 .  百度学术
百度学术3. 夏利新,毛知兰,苏秋平,罗旭蔚,谭莲,颜加岭,刘文辉. 颅内鲍曼不动杆菌感染患者脑脊液中替加环素的药物浓度监测. 中国处方药. 2021(11): 46-48 .  百度学术
百度学术其他类型引用(0)
-







 下载:
下载:



 下载:
下载: