-
糖尿病是一种由遗传和环境因素共同引起的糖代谢紊乱综合征,根据文献报告,全世界大约有4.35亿人被诊断患有糖尿病,预计到2040年这一数字将超过6.42亿[1]。糖尿病在我国患病率逐渐增高,居世界首位,严重影响人民生活健康,且与炎症密切相关。目前以肠组织为靶器官的研究相对较少,尤其是肠道免疫系统和肠道微生物的研究[2-4]。中药材黄精,是中国传统的大宗药材[5],在民间又是一种使用面非常广的药食同源植物,《中国药典》2015年版记载为滇黄精P. kingianum Coll. et Hemsl.、黄精P. sibiricum Red.或多花黄精P. cyrtonema Hua的干燥根茎[6];黄精在抗氧化和抗衰老、降血糖、调节免疫力、调血脂、抑制老年痴呆和改善记忆力、抗肿瘤、扩张血管、抗菌和抗病毒等方面显示出潜在的药用价值[7-8]。本研究以高脂高糖饲料喂养和一次性注射链脲菌素复制糖尿病模型,比较高、中、低剂量黄精多糖对小鼠降血糖以及对肠道组织结构的改善作用,旨在为中药治疗糖尿病提供理论依据,为黄精药材的开发应用奠定基础。
-
ICR小鼠,雄性,体重18~22 g,购于重庆腾鑫生物技术有限责任公司,合格证号:SCXK(京)2019-0010,伦理编号:伦审〔2021〕2-077号,饲养于遵义医科大学动物中心。饲养环境为光照,通风良好,温度(23±2) ℃。试验开始前分笼饲养,适应环境7 d,整个试验过程自由进食和饮水。普通饲料(碳水化合物占65.08%,脂肪占11.85%,蛋白质占23.07%),高脂饲料的重量组成以 67%普通饲料为基料,添加10%猪油、20%蔗糖、2.5%胆固醇、0.5%胆酸钠,购自北京科奥协力饲料有限公司。
黄精多糖(批号:TZR200714,陕西天之润生物科技有限公司);链脲佐菌素(Sigma公司);甲醛(批号:2018080201,成都科隆化学品有限公司);柠檬酸(批号:2020052090)、柠檬酸钠(批号:2019072051)购自天津市致远化学试剂有限公司。
-
ME104E/02 电子天平[梅特勒-托利多仪器(上海)有限公司];DW-86L386 立式超低温保存箱(青岛海尔特种电器有限公司);GA-3型血糖仪及配套试纸(三诺生物传感股份有限公司);Multifuge X1R 冷冻离心机[赛默飞世尔科技(中国)有限公司];DM400B 显微镜、PELORIS型脱水机、YB-9LF型包埋机、RM 2235切片机(德国莱卡公司);202-1AB型电热恒温干燥箱、DK-98-IIA 电热恒温水浴锅(天津市泰斯特仪器有限公司)。
-
分别称取0.625、1.25、2.5 g黄精多糖溶于50ml 蒸馏水,配置成12.5、25、50 mg/ml的低、中和高剂量黄精多糖溶液,备用。
-
称取柠檬酸2.1g加入双蒸水至100 ml中配成柠檬酸溶液,称取柠檬酸钠2.94 g加入100 ml双蒸水配成柠檬酸钠溶液,将柠檬酸溶液和柠檬酸钠溶液按1∶1.1的比例混合,用柠檬酸钠溶液调节pH至4.4,配制浓度1%的链脲佐菌素,现配现用。
-
将小鼠饲养于小鼠笼中,温度(23±2) ℃,昼夜12 h条件下饲养。适应性喂养7 d,整个试验过程自由进食和饮水,之后开始建立2型糖尿病小鼠模型。除正常对照组外,其余小鼠均高糖高脂饲料喂养6周,一次性给予40 mg/kg 链脲佐菌素腹腔注射,继续喂养高糖高脂饲料;尾静脉取血检测小鼠血糖值,血糖值≥11.1mmol/L的小鼠则造模成功。将小鼠分为5组,每组10只,正常对照组:正常饲养;模型组:给予高脂高糖饲料并灌胃20ml/kg生理盐水;黄精多糖低、中、高剂量组:给予高脂高糖饲料并分别灌胃125、250、500 mg/kg[9]黄精多糖;每天早上九点灌胃,连续4周,每周测一次小鼠体重和血糖值,实验结束使用浓度为2%的戊巴比妥钠,以50 mg/kg腹腔注射麻醉后颈椎脱位法处死小鼠。
-
小鼠禁食不禁水,每周称取体重,观察小鼠生长情况。
-
每周进行小鼠尾静脉取血测血糖。
-
实验结束前收集各组小鼠的粪便于冻存管,立即存放至液氮中,委托诺禾致源生物科技有限公司进行16S rRNA 基因高通量测序工作。
-
依据文献所述方法[10-11],末次给药1 h后结束实验,解剖小鼠,取5 cm小肠用生理盐水轻轻冲洗,固定于10%甲醛溶液中,进行梯度酒精脱水、石蜡包埋、组织切片制备、HE染色及中性树胶封片,至光学显微镜下观察小肠组织各部分结构。
-
数据分析采用SPSS 22.0 统计软件,计量资料以均数±标准差(
$ \bar x \pm s $ )表示,多组比较用单因素方差分析,两两比较用 LSD-t 检验,P<0.05为差异有统计学意义,P<0.01为差异极显著。 -
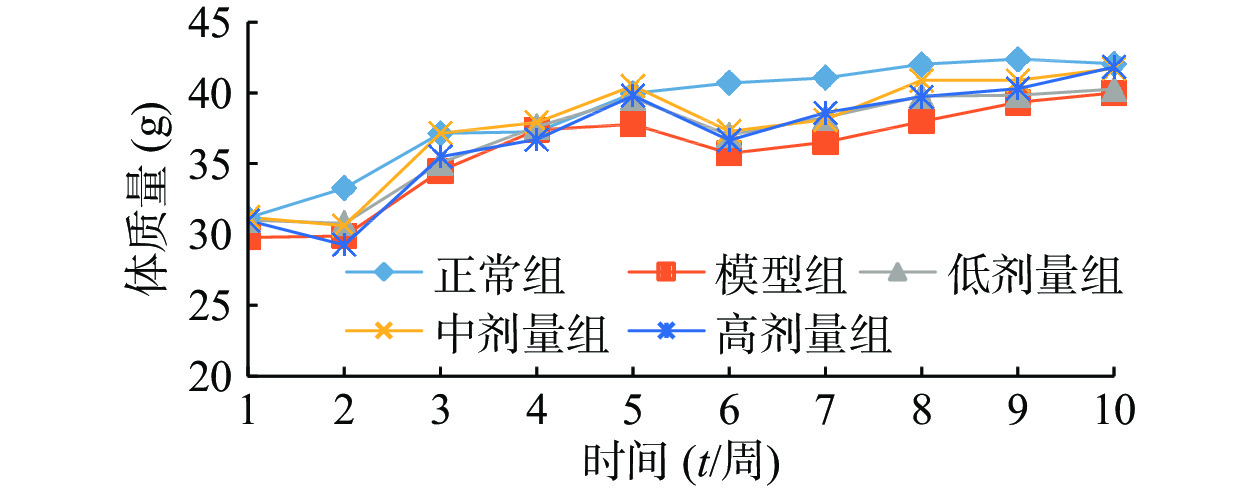
由图1可知,正常组小鼠体重整个实验中一直呈增长趋势,但随着饲养时间增长,增长幅度变小;其余组小鼠在给予高脂高糖饲料一周后体质量下降,随后呈上升趋势分别增长26%、29%、32%和36%,而正常组增长率约为20%,第6周一次性注射STZ后,小鼠体重均急速下降,模型组小鼠体重下降5.31%,黄精多糖高、中、低剂量组分别下降7.85%、7.91%和6.18%,如图2;模型组给予生理盐水灌胃,继续添加高脂高糖饲料饲养,体重呈缓慢增长趋势,给药组分别以高、中、低剂量黄精多糖给予灌胃,继续喂养高脂高糖饲料,各组小鼠体重分别增加14.24%、11.97%、8.78%,如图3。由此可见,糖尿病影响小鼠体重变化,灌胃黄精多糖溶液后,各组小鼠体重均有恢复,且高剂量效果明显。
-
实验过程中,给予充足的饮水和饲料,正常对照组小鼠活动正常,精神状态良好,色泽光亮,粪便呈浅墨绿色;模型组小鼠给予高脂高糖饲料第一周食欲下降,体重减轻,注射STZ后体重下降,表现不活泼、精神状态不好,竖毛,尿液呈深黄色,粪便呈黄棕色。黄精多糖组小鼠灌胃相应剂量后精神、饮食活动改善,尿液颜色变淡等,说明黄精多糖可以改善糖尿病小鼠的不良症状。结果表明,可能是STZ与高脂高糖饮食联合,破坏胰腺组织β细胞,并致胰岛素分泌发生不足,进而使体内糖代谢絮乱,发生胰岛素抵抗 [11-12]。
-
如表1所示,建模前血糖无显著差异(P>0.05),建模成功后的7 d和14 d时,与正常对照组相比,模型组小鼠血糖极显著升高(P<0.01);与模型组相比,黄精多糖各剂量组均无显著差异(P>0.05)。在21 d时,与正常对照组相比,模型组差异极显著(P<0.01) ;与模型组相比,黄精多糖低剂量和中剂量组无显著差异(P>0.05),高剂量组具有极显著性差异(P<0.01)。在28 d时,与正常对照组相比,模型组差异极显著(P<0.01);与模型组相比,黄精多糖各剂量组小鼠血糖值均降低,差异极显著(P<0.01)。
表 1 黄精多糖对糖尿病小鼠空腹血糖的影响(
$ \overline{x}\pm s $ , n=10)组别 血糖含量 建模前 建模后7 d 建模后14 d 建模后21 d 建模后28 d 正常组 5.67±0.33 5.95±0.24 5.95±0.21 5.97±0.22 5.99±0.24 模型组 5.6±0.43 15.85±0.28** 15.79±0.15** 15.59±0.16** 15.25±0.13** 黄精多糖低剂量组 5.76±0.36 15.88±0.40 15.45±0.18 14.75±0.11 13.77±0.11## 黄精多糖中剂量组 5.44±0.25 15.86±0.23 14.7±0.11 13.69±0.16 12.32±0.12## 黄精多糖高剂量组 5.57±0.29 15.85±0.21 13.81±0.10 12.3±0.16## 11.63±0.36## *P<0.05、**P<0.01,与正常对照组比较;#P<0.05、##P<0.01,与模型对照组比较 -
小鼠小肠病理组织切片HE染色结果显示,正常组小鼠小肠绒毛较长,结构完整,排列整齐;模型组小鼠小肠绒毛明显缩短,小肠绒毛断裂不完整,排列不紧密,与正常组比较差异显著;黄精多糖各剂量组小鼠小肠呈明显恢复状态,绒毛增长,排列较整齐,效果随黄精多糖剂量升高而表现明显,见图4。
-
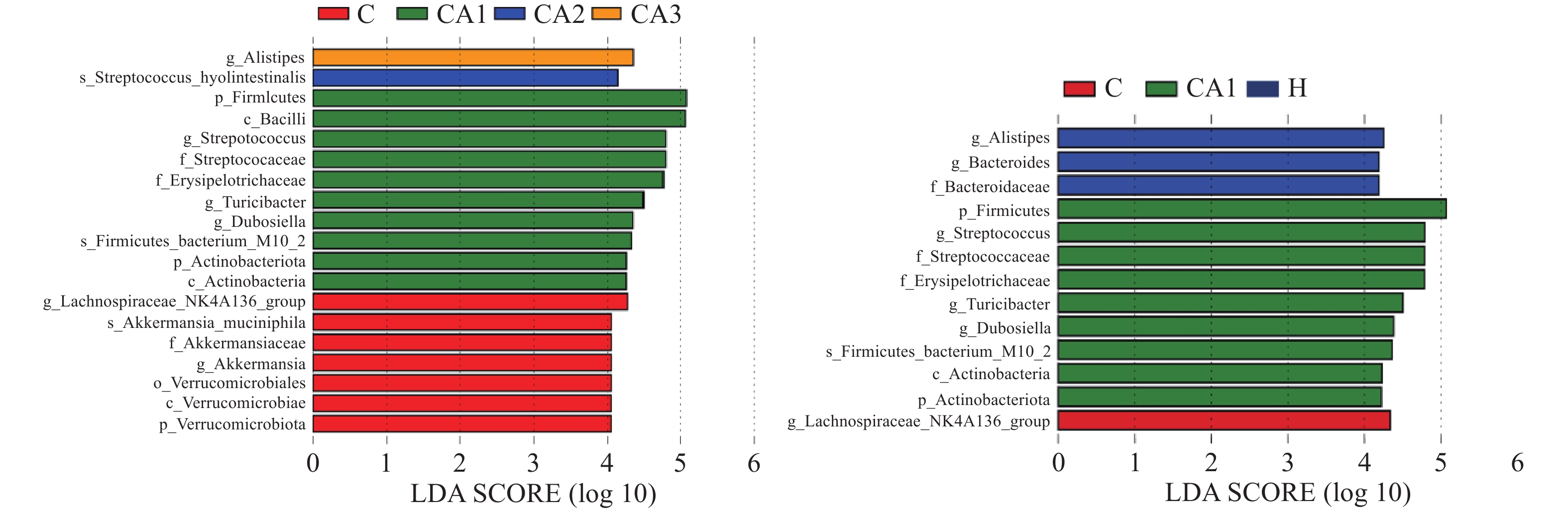
生物信息学分析结果表明,肠道微生物组成丰富,如图5,健康组和黄精多糖灌胃组中厚壁菌门和拟杆菌门丰富,而这两种菌是人类肠道内的优势有益菌,对人体健康起着重要作用,而糖尿病模型组中疣微菌门增多,这种菌可能会损害子代的消化和代谢能力,糖尿病造成了肠道菌群的紊乱。由此可推测,黄精多糖可以调节小鼠肠道微生物组成,增加有益菌丰富度,从而保护肠道。
-
糖尿病动物模型可通过高脂高糖饲料饲养和注射链脲佐菌素等多种方法制备,复制成功率高。本实验中发现,小鼠对高脂高糖饲料有一段过渡期,一开始饲喂高脂高糖饲料会影响小鼠食欲,导致体重下降,后体重迅速增长,小鼠肥胖,肥胖高脂的小鼠更容易患糖尿病。黄精多糖是中药材黄精的主要活性成分,已被证实具有治疗糖尿病的作用。黄精多糖可通过多种保护机制对糖尿病动物的各器官进行保护[13],但目前以肠组织为靶点的研究很少,且随着黄精属药用植物的广泛应用以及价格不断上涨,出现混用、滥用现象,黄精的临床规范应用受到一定程度的限制。黄精多糖可显著改善老龄鼠肠组织病理状态[14],本实验结果证实,黄精多糖可降低糖尿病小鼠血糖,恢复糖尿病小鼠代谢能力,改善其小肠绒毛排序结构,对肠道黏膜免疫功能可能存在一定作用,但目前未作进一步研究。肠道结构是肠道屏障功能的一部分,肠道微生物是影响代谢性疾病的关键因素,改变肠道微生物的群落结构,会引起代谢功能紊乱,肠道菌群与糖尿病存在密切关系,调节肠道菌群可以在一定程度上缓解患者症状,减轻黏膜炎症,有实验证明通过服用蜂胶、蒲公英、党参等,可调节小鼠肠道微生物,从而改善其肠道屏障功能[15-16]。肠道微生物区系组成的调节方法可能有助于糖尿病的治疗[17],本研究结果提示,糖尿病模型组中疣微菌门增多,可能会损害子代的消化和代谢能力,而健康组和黄精多糖灌胃组中厚壁菌门和拟杆菌门丰富,而这两种菌是人类肠道内的优势有益菌,且黄精多糖可调节肥胖小鼠的肠道菌群[18-19],这为进一步将肠道微生物和肠道免疫调控作为预防和治疗糖尿病的靶点提供理论基础,对临床治疗具有重要指导意义,为中药材黄精在糖尿病患者饮食辅助的治疗应用中提供重要的参考价值。
Study on hypoglycemic effect and intestinal effect of Polygonatum sibiricum polysaccharides in diabetic mice
-
摘要:
目的 研究黄精多糖对2型糖尿病小鼠降血糖作用及其对肠道菌群和小肠病理结构的影响。 方法 雄性小鼠50只,除10只正常饲养外,其余以高脂高糖饲料喂养6周,腹腔注射链脲佐菌素制备2型糖尿病小鼠模型,建模成功后随机分为4组:模型组、黄精多糖高、中、低(500、250、125 mg/kg)组,模型组小鼠给予生理盐水。记录各组小鼠体重和血糖值变化。4周后,收集粪便,进行16S rRNA高通量测序,HE染色观察小肠组织病理结构变化。 结果 小鼠在糖尿病状态下体重下降,给予黄精多糖高、中、低剂量后小鼠体重分别增加14.24%、11.97%和8.78%,血糖值分别降低26.6%、22.3%和13.3%。此外,小肠病理组织学排列错乱和肿胀现象有所改善。模型组和黄精多糖组之间的肠道微生物存在显著差异,模型组中疣微菌门显著增多,而健康组和黄精多糖灌胃组中厚壁菌门和拟杆菌门的微生物丰度更高。 结论 黄精多糖对糖尿病小鼠具有显著的降血糖作用,且对其肠道具有一定保护作用,其机制可能通过增加有益菌丰富度,提高小鼠免疫功能来实现的,且呈一定剂量效应关系,其免疫功能有待进一步研究。 Abstract:Objective To study the hypoglycemic effect of Polygonatum sibiricum polysaccharides on type 2 diabetic mice and its effects on intestinal flora and pathological structure of small intestine. Methods Fifty male mice were used, except 10 were fed normally, the others were fed with high-fat and high-sugar diet for 6 weeks, and then injected with streptozotocin intraperitoneally to make type 2 diabetes mice model. After successful modeling, they were randomly divided into model group and Polygonatum sibiricum polysaccharides (500, 250, 125 mg/kg) group and the model group mice were given normal saline. The changes of bodyweight and blood glucose of mice in each group were recorded. After 4 weeks, feces were collected and sequenced by a 16S rRNA high-throughput sequencing, and the pathological changes of small intestine were observed by HE staining. Results In diabetic mice, the weight decreased. After given Polygonatum sibiricum polysaccharides, the weight of mice increased by 14.24%,11.97% and 8.78%, and the blood glucose decreased by 26.6%, 22.3% and 13.3%, respectively after high, medium and low doses of Polygonatum sibiricum polysaccharides were administered. In addition, the pathological disorder and swelling of intestinal histopathology were improved. There were significant differences in intestinal microorganisms between the model group and the Polygonatum sibiricum polysaccharides. Verrucomicrobiae in the model group increased significantly, while the microorganism abundance of Firmicutes and Bacteroidetes in the healthy group and Polygonatum sibiricum polysaccharides group was higher. Conclusion Polygonatum sibiricum polysaccharides has a significant hypoglycemic effect on diabetic mice and a certain protective effect on their intestines, the mechanism may be achieved by increasing the richness of beneficial bacteria and improving the immune function of mice, it’s in a certain dose-effect relationship, and its immune function needs further study. -
在美国疾病预防控制中心耐碳青霉烯类肠杆菌(CRE)控制指南(2012年版)中,定义耐碳青霉烯肺炎克雷伯菌 (CRKP),是指在药敏试验中至少对厄他培南、美罗培南或亚胺培南其中之一者耐药,且对头孢曲松、头孢噻肟及头孢他啶耐药的肺炎克雷伯菌(KP)。CRKP引发的血流感染 (BSI) 因药物选择有限,致死率高达54.3%[1]。长期规律血液透析(HD)的尿毒症患者CRKP血流感染时,因HD的特殊性,更增加了治疗难度,特别是使用氨基糖苷类药物开展治疗时。临床药师需要根据HD患者代谢和排出的实际情况,结合药动学/药效学(PK/PD)理论对药物选择、剂量计算、以及给药时间进行优化。本文以1例 HD尿毒症患者为例,探讨阿米卡星在治疗合并CRKP血流感染的透析患者时的经验和体会。
1. 病史简介
1.1 基本信息
患者男性,64岁,农民,身高176 cm,体重65 kg。主诉“间断发热2 d”,于2019年10月21日入院。既往高血压病史20余年,多囊肾、多囊肝病史30余年,癫痫病史1年余,尿毒症病史4年,无尿状态,规律血液透析4年(每周一、三、五,2次血液透析+1次血液透析滤过),右侧颈静脉留置导管。2019年1月至9月,患者因“多囊肝伴感染”多次入院治疗,血培养多次报告超广谱β内酰胺酶(ESBLs)阳性的KP,曾多次接受哌拉西林他唑巴坦、替加环素、米诺环素、美罗培南、法罗培南等治疗。入院前2 d,患者再次无明显诱因出现发热,体温最高37.5 ℃,伴畏寒寒战,腰痛及呃逆,无明显咳嗽咳痰,服用“法罗培南”无明显改善,为求进一步诊治再次入院。入院查体:体温(T)38.6 ℃、脉搏(P)112次/min、呼吸频率(R)22次/min、血压(BP)117/97 mmHg。患者呈慢病面容,被动体位,查体欠合作,双肺呼吸音清,未闻及干湿啰音,腹部膨隆,无压痛及反跳痛,移动性浊音阳性,肝肾区无叩痛。辅助检查:血常规:白细胞计数(WBC) 10.74×109/L、中性粒细胞百分比(N%) 85.8%、血红蛋白(Hb) 109 g/L、血小板(PLT) 117×109/L;血生化:尿素氮(BUN) 30.8 mmol/L、肌酐(Cr) 912μmol/L、丙氨酸氨基转移酶(ALT) 6 U/L、天冬氨酸氨基转移酶(AST) 8 U/L;C-反应蛋白(CRP) 254 mg/L、降钙素原(PCT) 17.35 ng/ml、血沉(ESR) 95 mm/h。腹部核磁示肝右叶多发片状DWI异常信号影,多囊肝,双侧多囊肾。胸部CT未见异常。入院诊断:肝囊肿合并感染、尿毒症、血液透析状态、慢性左心功能不全、心功能Ⅲ级、心律失常、阵发性房颤。
1.2 治疗经过
入院当日抽取静脉血做细菌培养,经验性给予美罗培南0.5 g,1次/d。治疗期间,患者仍间断发热,体温在37~38 ℃波动。10月26日化验结果显示:WBC 5.35×109/L、N% 71.2%、BUN 18.41 mmol/L、Cr 631μmol/L、CRP 179 mg/L、PCT 16.97 ng/ml、ESR 96 mm/h。10月26日细菌血培养为产丝氨酸碳青霉烯酶(KPC)的CRKP (药敏见表1)。导管内血培养阴性。临床药师对导管相关感染进行评估:患者导管处皮肤干燥,无渗液,考虑血流感染与多囊肝伴发的感染可能性更大。药敏结果示病原菌对氨基糖苷类药物敏感。经确认,患者本人及家族成员无氨基糖苷类药物的过敏史与不良反应史。临床药师建议:选择美罗培南联合敏感药物阿米卡星抗感染治疗。美罗培南剂量增加至0.5 g每12 h给药1次,延长滴注时间至2 h。阿米卡星首次剂量给予0.8 g,维持剂量0.2 g,于每次透析后给药,滴注时间不少于30 min。
表 1 患者肺炎克雷伯菌血培养和药敏结果抗生素 敏感度(mg/L) 抗生素 敏感度(mg/L) 复方新诺明 ≤20敏感 美罗培南 ≥16耐药 粘菌素 ≤0.5敏感 亚胺培南 ≥16耐药 替加环素 ≥8耐药 氨曲南 ≥64耐药 米诺环素 ≥16耐药 头孢泊肟酯 ≥32耐药 多西环素 ≥16耐药 头孢哌酮舒巴坦 ≥64耐药 左氧氟沙星 ≥8耐药 头孢他啶 ≥32耐药 环丙沙星 ≥4耐药 哌拉西林他唑巴坦 ≥128耐药 妥布霉素 ≤1敏感 替卡西林克拉维酸钾 ≥128耐药 阿米卡星 ≤2敏感 10月27日,患者体温恢复正常,病情缓解,查体:T 35.9 ℃、P 60次/min、R 16次/min、BP 148/93 mmHg。10月29日WBC 5.7×109/L、N% 59%、CRP 30.25 mg/L、PCT 3.92 ng/ml、ESR 67 mm/h。10月30日,患者血培养结果阴性,病情平稳,未诉不适。11月4日,患者体温、炎性指标等检测指标均正常,在院期间,患者未出现头晕、耳鸣等不良反应。11月8日,患者遵医嘱出院。两周后电话随访,患者未再出现发热。
2. 讨论
2.1 氨基糖苷类药物在CRKP-BSI中的治疗地位
CRKP是一类具有较厚荚膜且大多数存在菌毛的
${\rm{G}}^- $ 菌,较厚的荚膜与高耐药性相关[2]。近5年来,CRKP的抗菌治疗一般局限于头孢他啶/阿维巴坦、美罗培南/维博巴坦、多粘菌素、替加环素、磷霉素、碳青霉烯类以及氨基糖苷类等药物[3-7]。氨基糖苷类药物因存在神经毒性和肾毒性,较少用于一线治疗,因此对许多耐药菌仍有一定的敏感性,常常用于耐药${\rm{G}}^- $ 菌的联合治疗。多项研究表明,氨基糖苷类与β-内酰胺类药物联合治疗${\rm{G}}^- $ 菌感染的休克患者时,尤其以碳青霉烯类药物为基础的联合方案与任何一种单药治疗方案相比可显著降低患者病死率[8-9, 10-11]。根据药敏结果,药师建议美罗培南抗感染治疗联合药敏敏感且价格低廉的阿米卡星作为治疗方案。阿米卡星可破坏KP胞浆膜的完整性,通过抑制致病菌蛋白质的合成发挥抑菌作用,对KP的敏感率为85.7%[12]。2.2 规律血液透析(HD)患者阿米卡星剂量如何调整
2.2.1 氨基糖苷类药物药动学/药效学(PK/PD)特点及给药方式
氨基糖苷类药物是浓度依赖性的静止期杀菌剂,有3个PK/PD特点:①预测疗效的PK/PD指标主要为血药峰浓度/最小抑菌浓度(cmax/MIC)≥8~10[13]或0~24 h药时曲线下面积/最小抑菌浓度(AUC0~24/MIC) ≥100[14];②抗菌药物后效应(PAE)较长,阿米卡星对KP的PAE>12 h[15];③有耐药适应性,即接触药物暴露后细菌杀灭率降低,可能是细菌对药物的摄取下调导致的[9]。氨基糖苷类药物最理想的体内过程,是获得高的cmax,以及一段时间的无药期,以减少适应耐药性。这是氨基糖苷类药物提高给药剂量、延长给药间隔的理论基础。对于肾脏功能正常的人群,氨基糖苷类药物推荐的给药方式多为每日剂量一次给予[9, 14]。
2.2.2 氨基糖苷类药物HD患者的给药时机选择
氨基糖苷类药物是中等分子量(465~600)的化合物,蛋白结合低,分布体积较小。HD可以有效清除氨基糖苷类药物。HD患者,传统的给药方式是首剂给予肾功能正常患者的推荐剂量,每次透析后补充正常剂量的一半。有新的观点提倡,每次HD之前给予正常剂量[16-17],或在透析过程中给药,以获得体内较高的cmax,随后由透析过程将体内药物浓度降低。但是这种给药方式也有局限性:①必须依赖于准确的HD疗程将药物浓度降低,否则,会导致药物蓄积,加重不良反应。②对于可能因意外情况而中断HD的患者以及不能进行血药浓度监测的医疗机构,有一定的风险。③HD患者无法完全排出体内的氨基糖苷类药物,不存在无药期,不能减少细菌获得性耐药产生[18]。临床药师结合本例患者的癫痫病史,且我院尚未开展阿米卡星血药浓度监测的实际情况,仍建议选择传统的透析后补充低剂量的策略,医生采纳。
2.2.3 阿米卡星HD患者给药剂量计算
根据桑德福《抗微生物指南》(第48版)推荐,阿米卡星尿毒症患者行血液透析的给药方案为:①2次/d给药方案:7.5 mg/kg,间隔48 h再次给药,做透析后额外增加3.75 mg/kg。②1次/d给药方案:首剂(推荐剂量15 mg/kg),间隔72 h+透析后额外补充3 mg/kg。根据PK/PD理论,本例患者选择1次/d的给药方式。
Hideo[19]等对阿米卡星PK/PD评价发现:对于MIC≤2 mg/L,10 mg/kg可获得>90%的治疗目标。本例患者校正体重68.8 kg,负荷剂量选择10 mg/kg给药,给药剂量0.69 g。根据制剂规格0.2 g/支,给予0.8 g(11.6 mg/kg),每日一次。维持剂量:每周一、三、五规律血透,每次透析后给药0.2 g(3 mg/kg)。患者用药后,第2天体温下降至正常。
2.3 尿毒症患者使用阿米卡星安全性及相关监护指标
氨基糖苷类药物可导致听觉、前庭毒性和肾脏毒性以及神经肌肉阻滞。氨基糖苷类耳毒性发生率为15%~20%,通常表现为听力下降或损失,以及前庭损害,同时使用其他肾毒性药物时[20],须关注耳毒性反应。
氨基糖苷类药物存在肾损害、神经肌肉病、食物中毒、低钙血症,同时使用肌松药时,需关注可能出现呼吸衰竭等严重不良反应[21]。神经肌肉阻滞的发生与滴速有关,滴注时间至少30 min以上。本例患者未出现听力损伤及神经肌肉阻滞不良反应。
-
表 1 黄精多糖对糖尿病小鼠空腹血糖的影响(
$ \overline{x}\pm s $ , n=10)组别 血糖含量 建模前 建模后7 d 建模后14 d 建模后21 d 建模后28 d 正常组 5.67±0.33 5.95±0.24 5.95±0.21 5.97±0.22 5.99±0.24 模型组 5.6±0.43 15.85±0.28** 15.79±0.15** 15.59±0.16** 15.25±0.13** 黄精多糖低剂量组 5.76±0.36 15.88±0.40 15.45±0.18 14.75±0.11 13.77±0.11## 黄精多糖中剂量组 5.44±0.25 15.86±0.23 14.7±0.11 13.69±0.16 12.32±0.12## 黄精多糖高剂量组 5.57±0.29 15.85±0.21 13.81±0.10 12.3±0.16## 11.63±0.36## *P<0.05、**P<0.01,与正常对照组比较;#P<0.05、##P<0.01,与模型对照组比较 -
[1] YU F, HAN W, ZHAN G F, et al. Abnormal gut microbiota composition contributes to the development of type 2 diabetes mellitus in db/db mice[J]. Aging,2019,11(22):10454-10467. doi: 10.18632/aging.102469 [2] 董荣荣, 洪浩. 肠道相关抗糖尿病靶点及药物的研究进展[J]. 医药前沿, 2016, 6(15):14-15. [3] 刘静, 朱德锐. 肠道微生物与糖尿病关系的研究进展[J]. 青海医学院学报, 2016, 37(3):202-207. doi: 10.13452/j.cnki.jqmc.2016.03.012 [4] 刘卓群, 吴露露. 肠道微生物与疾病的关系[J]. 世界最新医学信息文摘, 2016, 16(69):46-47,50. [5] 姜程曦, 张铁军, 陈常青, 等. 黄精的研究进展及其质量标志物的预测分析[J]. 中草药, 2017, 48(1):1-16. doi: 10.7501/j.issn.0253-2670.2017.01.001 [6] 任群利, 刘建国, 胡欢, 等. 黄精多糖对糖尿病动物模型的保护机制研究进展[J]. 山西中医药大学学报, 2020, 21(6):465-468. [7] 王慧, 袁德培, 曾楚华, 等. 黄精的药理作用及临床应用研究进展[J]. 湖北民族学院学报(医学版), 2017, 34(2):58-60,64. doi: 10.13501/j.cnki.42-1590/r.2017.02.018 [8] 任洪民, 邓亚羚, 张金莲, 等. 药用黄精炮制的历史沿革、化学成分及药理作用研究进展[J]. 中国中药杂志, 2020, 45(17):4163-4182. doi: 10.19540/j.cnki.cjcmm.20200522.601 [9] 赵宏丽, 许燕, 赵红岩, 等. 黄精多糖对2型糖尿病大鼠SREBP-1c和SCD-1蛋白表达的影响[J]. 中药药理与临床, 2015, 31(1):106-109. doi: 10.13412/j.cnki.zyyl.2015.01.034 [10] 陈刚, 谭明亮. 茶多酚对高尿酸血症小鼠尿酸产生与排泄的影响及机制研究[J]. 中国药理学通报, 2017, 33(2):218-222. doi: 10.3969/j.issn.1001-1978.2017.02.015 [11] 王语聪, 谢智鑫, 张学艳, 等. 黄芪对2型糖尿病大鼠碱性磷酸酶与炎症反应的影响[J]. 食品工业科技, 2021, 42(13):351-357. doi: 10.13386/j.issn1002-0306.2020080311 [12] ZHOU L, HU Y H, LI C Y, et al. Levo-corydalmine alleviates vincristine-induced neuropathic pain in mice by inhibiting an NF-kappa B-dependent CXCL1/CXCR2 signaling pathway[J]. Neuropharmacology,2018,135:34-47. doi: 10.1016/j.neuropharm.2018.03.004 [13] WANG Y, QIN S C, PEN G Q, et al. Original Research: potential ocular protection and dynamic observation of Polygonatum sibiricum polysaccharide against streptozocin-induced diabetic rats' model[J]. Exp Biol Med (Maywood),2017,242(1):92-101. doi: 10.1177/1535370216663866 [14] 冯鑫. 黄精多糖的制备及其对老龄鼠肠道和肺的作用研究[D]. 四川农业大学, 2020. [15] XUE M, LIU Y, XU H, et al. Propolis modulates the gut microbiota and improves the intestinal mucosal barrier function in diabetic rats[J]. Biomed Pharmacother,2019,118:109393. doi: 10.1016/j.biopha.2019.109393 [16] 谷巍, 孙明杰, 王丽荣, 等. 4味常见中药对免疫抑制小鼠免疫功能及肠道菌群的影响[J]. 中国畜牧兽医, 2019, 46(1):147-156. doi: 10.16431/j.cnki.1671-7236.2019.01.017 [17] EJTAHED H S, HOSEINI-TAVASSOL Z, KHATAMI S, et al. Main gut bacterial composition differs between patients with type 1 and type 2 diabetes and non-diabetic adults[J]. J Diabetes Metab Disord,2020,19(1):265-271. doi: 10.1007/s40200-020-00502-7 [18] 卫钰成, 杨敏敏, 施琳, 等. 滇黄精水提物联合间歇性禁食通过调节肠道菌群改善高脂饮食诱导的小鼠肥胖及肝损伤[J]. 食品与发酵工业, 2022, 48(13):91-102. doi: 10.13995/j.cnki.11-1802/ts.029607 [19] 张智, 包智影, 孙家佳, 等. 发酵黄精多糖对肥胖小鼠肠道菌群的影响[J]. 华南理工大学学报(自然科学版), 2021, 49(03):95-105+113. 期刊类型引用(4)
1. 孙慧珠,王晓蕾,刘永利. UPLC/MS/MS法同时测定肾衰宁胶囊中9种成分及一致性分析. 中成药. 2023(01): 29-34 .  百度学术
百度学术2. 张芦燕,杨洁,钱一鑫,王庆. 基于HPLC法和指纹图谱的桑菊感冒片质量评价研究. 医学信息. 2023(07): 139-142 .  百度学术
百度学术3. 周辉. 海昆肾喜胶囊联合肾衰宁胶囊对肾衰竭患者肾功能及炎性因子的影响. 临床合理用药. 2023(11): 116-118 .  百度学术
百度学术4. 曹舒兴,宋永周,王进. 肾衰宁片的HPLC特征图谱及9个成分的含量测定. 药物分析杂志. 2023(07): 1172-1182 .  百度学术
百度学术其他类型引用(0)
-





 下载:
下载:

 下载:
下载: