-
河豚毒素(TTX)是一种海洋生物毒素。TTX首次在河豚中提取得到,而后在多个海洋动植物和陆地部分动物中发现。TTX是一种电压门控钠通道(VGSCs)的阻滞剂,能够选择性地与VGSCs外前庭上的α-亚基结合,阻止钠离子进入通道,从而产生药理活性。TTX具有镇痛、戒毒、抗心律失常等作用,此外,还有降低心血管药物不良反应的作用。目前已经有许多TTX在研制剂,研究者也正在针对TTX的剂型进行研究。本文就TTX的来源、结构性质、作用机制、药理活性、在研剂型进行综述,旨在为下一步TTX的药用开发提供参考。
-
1894年,日本学者田原良纯在日本药物学会的月度会议上介绍了从河豚卵巢水提取物中分离出的毒素,这是TTX的首次面世。1909年他提出河豚只含有1种有毒物质,并将其命名为河豚毒素[1]。1950-1957年间,横尾晃、津田藤介等人首先从红鳍东方鲀、紫色东方鲀卵巢中分离得到结晶态的TTX [2-4]。目前河豚毒素的实验室合成已经实现[5],但尚未实现产业化。
起初,人们认为TTX只存在于河豚科的河豚中,但自不同纲属的两栖动物中发现TTX,打破了以往认为它仅存在于鲀科鱼类中的学说[6]。此后,在多个种类的海洋动植物和陆地动植物中都发现了TTX的存在,如甲藻、红色石灰质藻类、节肢动物、棘皮动物、软体动物、蝾螈和青蛙等。在海洋和淡水环境的沉积物中也发现了TTX[7],进而产生了生物体内发现的TTX到底是内源性的(由河豚自身产生)还是外源性的(从外部获取并积累)争议。
对于TTX的来源,目前有两种理论:外因说和内因说。日本的清水、松居是最早提出“外因说”的学者。他们用含有TTX的饲料来喂养人工养殖的无毒河鲀,结果河鲀由无毒转变为有毒,由此推论河豚体内的TTX可能是外源性的[8]。2005年,Cheng和Wu 等[9-10]提出TTX是由外界细菌产生的,他们从河豚体内提取出36种细菌,包括弧菌、芽孢杆菌、假单胞菌等。Simidu等[11]通过实验发现溶藻弧菌和互生单胞菌属产TTX较多,但细菌能否产生TTX取决于菌株。Noguchi等[12]的研究表明河豚内的TTX可能来源于其体内的共生细菌,产生TTX的是这些共生细菌而非河豚本身。
内因说认为河豚鱼体内的TTX来源于河豚体内的微生物或是某些生理过程的产物。1998年,Matsumura等[13]以星点东方鲀成熟的卵细胞进行人工授精及胚胎培育,发现胚胎中TTX含量在孵化过程中有所增加,由此认为TTX是河豚胚胎发育的产物。有报道认为河豚体内的TTX可能不是直接来自细菌,也有可能是河鲀鱼与共生细菌共同的产物,并随生长发育逐渐积累[14]。目前大多数研究者认为河豚体内的TTX是由食物链累积和体内微生物产生这两种方式共同形成的。
-
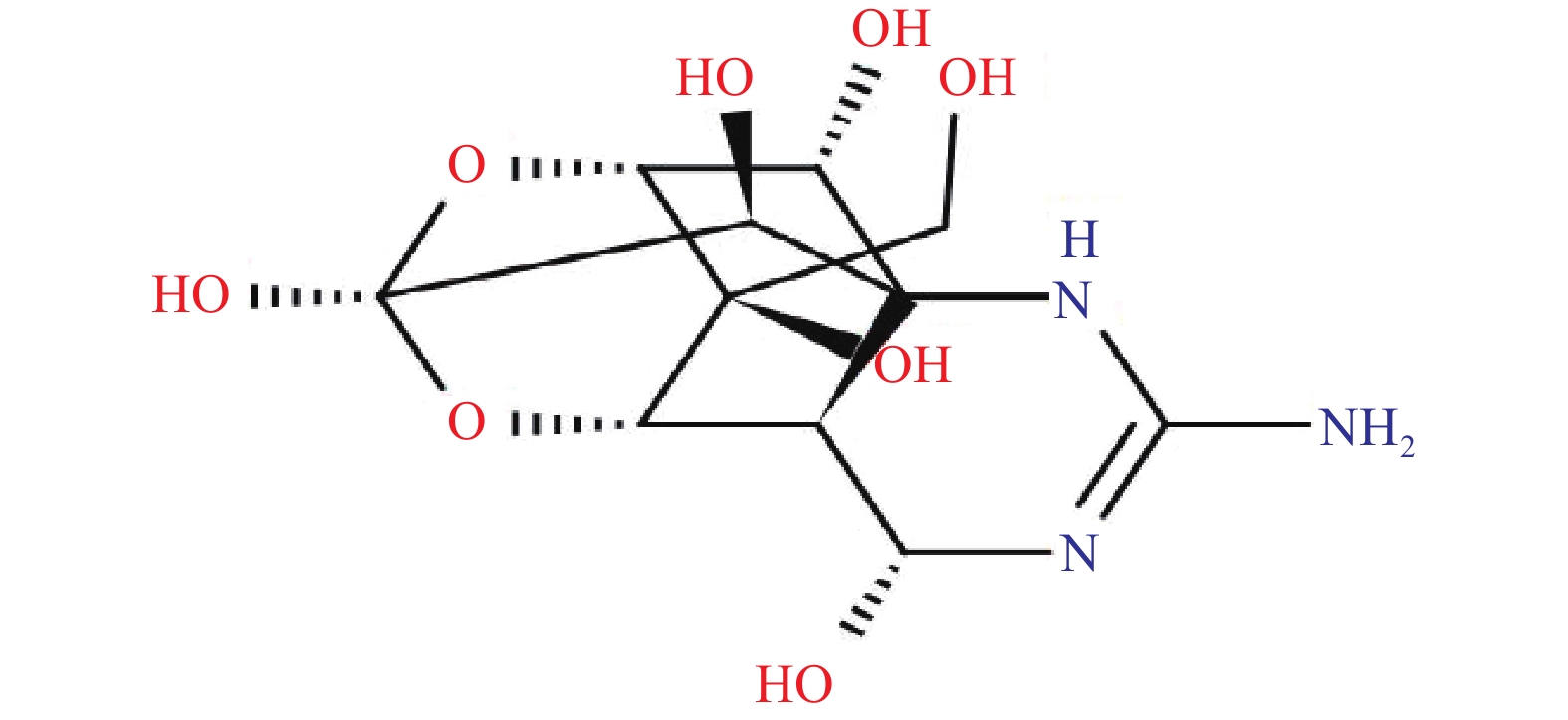
河豚毒素(TTX)的分子式为C11H17O8N3,分子量为319.27,为氨基全氢化喹唑啉型化合物,呈独特的笼形结构(见图1),杂环含2个氮母核,含有1个碳环、1个胍基、6个羟基,在C-5和C-10位有1个与半醛糖内酯连接的分开的环[15]。热性质稳定,在碱性溶液中易降解,微溶于水、无水乙醇、乙醚,几乎不溶于其他有机溶剂,易溶于有机酸和无机酸水溶液,log Kow=−6.21(est),25 ℃时的比旋度为−8.64°(在8.55%稀醋酸中),其pKa在水中为8.76,在50%乙醇中为9.4[16]。
TTX毒性很强,经腹腔注射对小鼠的LD50为8 μg/kg,目前没有特效解毒剂。常温下,提取获得的TTX为无色晶状固体,固体状态很稳定,但其水溶液易水解,温度越高分解速度越快;当助溶剂为pH 4.05醋酸溶液时,放置30 天的常规TTX注射液含量由99.20%下降到93.88%(25 ℃)或65.57%(40 ℃)[17]。
-
TTX是一种电压门控钠通道(VGSCs)的阻滞剂,它能够选择性地结合到VGSCs外前庭上的α-亚基,阻止钠离子进入通道,从而产生抑制兴奋的作用[18]。从结构上看,TTX的胍基与钠离子通道内受体蛋白的羰基相互作用,阻滞离子进入通道,继而产生神经、肌肉的麻痹。TTX与钠离子通道是1∶1的结合,即1分子毒素结合1个钠通道,其结合是可逆的,并且与K+、Mg2+、Ca2+等带正电荷的离子竞争受体。根据对河豚毒素的敏感性,VGSCs可分为 TTX 敏感型(TTX-s)和 TTX 耐受型(TTX-r)[19],分别介导激活电压较低、失活较快的快钠电流和激活电压高、失活较慢的慢钠电流。
研究表明,TTX对钠离子通道的影响可能是其镇痛的机制。在 VGSC家族中有6个 TTX-s 钠离子通道成员(Nav 1.1 ~1.4,1.6,1.7)可以被 TTX阻断,而其他的钠离子通道亚型是 TTX-r 钠离子通道,不能被TTX阻断[20]。TTX可以选择性抑制膜电压,使通道难以打开,从而抑制神经冲动的发生和传导,造成神经肌肉丧失传递兴奋的能力。有基因研究表明,在河豚体内有非芳香族氨基酸(Asn)和Cys残基存在于河豚Nav1.4通道的域I,这与河豚的TTX抗性相关,将这2个残基引入到对TTXs敏感的大鼠Nav1.4通道后,大鼠也具有了抗性[21]。
-
镇痛是目前TTX在临床应用上研究最多的方向。作为典型的钠离子通道阻滞剂,TTX可以与吗啡等多种镇痛药联用,以发挥出比单一镇痛药更好的效果。陈学军等[22]进行了TTX和吗啡单独或联用对腹腔注射醋酸小鼠的扭体实验,考察其镇痛效果。结果显示当TTX剂量范围在0.0312~4 μg/kg时能剂量依赖性地抑制醋酸扭体小鼠的疼痛;固定TTX用量在0.125 μg/kg,联合使用剂量范围在1.95~31.2 μg/kg的吗啡,各剂量组与TTX和吗啡单一使用比较,扭体抑制率差异均有统计学意义(P<0.01)。这说明两者联用使得低剂量吗啡镇痛效应增强,降低了其不良反应,比单一使用具有更好的镇痛效果。TTX与因得克(indoxacarb)联用证明了TTX能够抑制甲醛引起的炎症性疼痛和水肿[23]。TTX在临床上使用也效果显著,以它为主药用于癌症晚期患者镇痛的注射剂曾于加拿大进行了24例志愿者实验,通过单盲实验确定TTX与阿片类药物相比具有良好的镇痛作用,且在停止注射后有长效镇痛的作用。这个附加的镇痛作用在第10天左右达到峰值,随后开始减小[24]。后来他们进行了Ⅱ期临床试验,通过对更大样本量的志愿者群体进行更详细的实验,对不同分组给予不同给药方案,结果表明肌内注射TTX的一般耐受性良好,在每日30 mg、分2次给药时,4 天内是安全的[25]。
-
将TTX应用于戒毒和药物成瘾性戒断的治疗中,在临床上也有良好的表现。中等成瘾程度的戒毒者每日1次注射10 μgTTX,5~7天为1个疗程就能很好地控制毒瘾,并大大减轻了常规戒毒方法中常出现的戒毒综合征[26]。随后还出现了喷雾剂型的TTX戒毒制剂,改善了毒瘾患者用药时的便携度和及时性[27]。
-
相比较于常用的抗心律失常药,TTX能够选择性地阻断Na+通道而不影响其他离子通道,减少了引起不良反应的概率,降低了用药风险。朱成华等[28]通过建立小鼠BaCl2心律失常模型和大鼠乌头碱心律失常模型,将微量TTX与心得安、利多卡因等抗心律失常药合用,TTX可增强抗心律失常药的疗效而不产生毒性影响。现国内已有以TTX为主药制成的抗心律失常药[29]。
对于心血管疾病,由于TTX的毒性反应中存在低血压反应,实验显示5×10−4 μg/g剂量就有明显的降压反应[30]。有研究者对多种动物进行了在体或离体实验,静脉注射一定剂量TTX后发现它对各种动物均有不同程度的降压作用。TTX没有直接扩张血管的作用,但可抑制心脏,其降压作用与抑制心脏有关[31]。
-
①预防肾功能衰竭。Bergman等[32]建立了单侧大鼠肾切除模型,对大鼠进行60 min缺血处理后再灌注,肌内注射不同剂量TTX。结果显示,2~4 μg/kg的TTX对急性缺血性肾衰具有保护作用,分组实验则证明肾衰前后注射TTX都具有同样作用,但作用机制尚不明确。②用作皮肤瘙痒症状的止痒剂,能止痒并促进恢复。③治疗前列腺病症。TTX对多种细菌都有抑制作用,能够有效缓解细菌感染引起的前列腺炎症[33]。④对肺癌具有一定治疗作用。将河豚肝脏加水煎煮2~2.5 h,收集上层河豚肝油,将TTX溶于河豚肝油并加入香叶油、白术油和鸦胆子油等辅料制备成药,通过构建免疫缺陷型模型鼠来验证其对肿瘤生长的影响,结果与对照组相比该药物抑制肿瘤细胞生长效果明显,但起作用的具体成分难以判断[34]。
-
根据TTX不同药理作用,可将它制备成多种剂型以发挥或提高其有效性,目前已报道的包括口服制剂、喷雾剂、气雾剂、注射剂、可植入式渗透微泵或栓剂等。
-
口服制剂是最常见的给药剂型之一,但对TTX而言,液态口服制剂需要达到注射剂数十倍的剂量才能起到相同的效果。研究证实TTX在小肠液中稳定,故可将其制成胶囊剂或片剂,根据情况填充液体或半固体,成药辅料以乳糖、硬脂酸盐、微晶纤维素、交联羧甲纤维素等为优选[35]。口服制剂不仅增加了患者服用便捷性,而且患者无需住院就可安全使用,也更利于药物的储藏和运输[36]。有研究者制备了载河豚毒素的微囊[37],使用挤出滚圆(Ex-Sp)和流化床处理制得,样品在2~12 h持续释放,累计释放率达80%,在40 μg/kg剂量取得最优镇痛效果。研究者测得河豚毒素注射液6 μg/kg静脉注射的t1/2为0.92 h,载药微囊150 µg/kg灌胃给药,测得cmax为0.88 ng/ml,t1/2约14.5 h,tmax约为5 h。
-
呼吸道给药途径包括鼻腔、口腔和舌下黏膜等部位,其吸收率也不低于肌内或静脉注射,现有气雾剂、喷雾剂和粉末吸入剂等形式。通过混合稀释剂、抛射剂、稳定剂、皮肤助渗剂等多种药用辅料使TTX在喷射装置内保持稳定,制成喷雾剂形式的戒毒、镇痛用TTX制剂,使用十分方便[27]。
-
国外早以TTX注射剂作为局麻剂和戒毒剂,如TTX与吗啡联用作为手术所需局麻剂。加拿大WEX制药公司研制了TTX注射剂,其申请的专利中虽未公开特定溶剂,但最有可能为极性溶剂,如氢氧化物和醇化物。该TTX注射剂用于缓解化疗和晚期癌症患者的剧烈疼痛,临床试验效果良好,在每日不超过30 μg的剂量条件下表现出非常好的镇痛效果。在30 μg给药剂量时,其cmax为0.58 ng/ml,tmax约为1.5 h,t1/2约为4.5 h[38],现已进入Ⅲ期临床试验[39]。该公司在国内申请的专利中也列出了其对于TTX可能的剂型制备方法,包括片剂、颗粒剂、胶囊剂、贴剂、乳膏剂等多种剂型,同时TTX与多种药物联合使用有协同治疗作用,如抗癌药顺铂、卡铂、奥沙利铂和长春新碱等[40]。
TTX水溶液对温度敏感,可将其制成冻干制剂,以获得稳定的可注射制剂,但其用于临床的剂量均为微克级。微量的TTX冻干脱水后无法形成所需要的固态残留物,因此需要添加必需的赋形剂,作为TTX附着的支架以形成固态物。已有的解决办法有采用等渗调节剂氯化钠,以甘露醇为成型骨架辅料,以海藻糖作稳定剂并在冷冻干燥前调节pH值至3.5~4.5,可获得质量稳定性好、安全性高的冻干粉针制剂[41]。
-
TTX极具开发潜力,尤其在医药领域。它作为典型的钠离子通道阻断剂在很多方面都表现出药用功效,但可能仍有许多作用未被发现。在已知的一些功效中尚未明确其作用机制,作用于人体的给药途径也仍需探索以获得更好的给药形式和治疗效果,需要多个领域的合作研究才能进一步挖掘TTX对人类的有益作用。
Advances in medicinal research on tetrodotoxin
-
摘要: 河豚毒素(TTX)是在河豚鱼和其他海洋动物中发现的一种神经毒素。它是一种电压门控钠通道(VGSCs)阻滞剂,能够选择性地与VGSCs外前庭上的α-亚基结合,阻止钠离子进入通道,从而产生药理活性。作为典型的钠离子通道阻滞剂,TTX具有显著的镇痛作用。TTX能够选择性地阻断Na+通道而不影响其他离子通道,减少了常用抗心律失常药物引起不良反应的概率,降低了用药风险。此外,TTX在戒毒等方面亦有显著作用。因此,TTX具有很大的成药潜力。本文对河豚毒素的结构与性质、作用机制、药理活性和在研制剂进行综述,为其成药性评价研究和在药学领域的应用提供概要性支撑。Abstract: Tetrodotoxin (TTX) is a neurotoxin found in puffer fish and other marine organisms. It has been used as an inhibitor of voltage-gated sodium channels (VGSCs), which could selectively bind to the α-subunit on the outer vestibule of VGSCs, preventing sodium ions from entering the channel, resulting in pharmacological activities. As a typical sodium channel blocker, TTX shows a significant analgesic effect. TTX could selectively block Na+ channels without affecting other ion channels, therefore it could reduce the probability of adverse reactions caused by commonly used antiarrhythmic drugs. In addition, TTX has a significant role in detoxification and prevention of renal failure, so TTX has great potential as a medicine. The structure and physicochemical properties, mechanism of action, pharmacological activities and preparations of tetrodotoxin have been reviewed in this paper, so as to provide a general support for the evaluation of its druggability and application in the field of pharmacy.
-
Key words:
- tetrodotoxin /
- neurotoxin /
- analgesic effect /
- pharmacological activity /
- preparation
-
西红花为名贵药材,来源于鸢尾科植物番红花Crocus sativus L.的干燥柱头。原产于地中海地区、希腊、小亚细亚和伊朗,后经西藏传入国内,故又名藏红花[1]。《本草纲目》中记载番红花“主治心忧郁积、气闷不散,活血,亦治惊悸”[2]。2020版《中国药典》描述西红花具有活血化瘀、凉血解毒、解郁安神的功效[3]。越来越多的现代药理研究表明,西红花具有抗肿瘤、抗血小板聚集与凋亡、抗心血管细胞凋亡、降血脂和降血糖等活性[4–6],在健康和医疗领域具有重要作用。
世界卫生组织国际癌症研究机构(IARC)发布的最新数据,2020年全球癌症新发患者病例数超过1 930万例,癌症死亡患者接近1 000万例[7]。天然活性成分是抗肿瘤药物研发的重要来源[8]。有研究表明,西红花中特有的西红花酸、西红花苷等具有抗肿瘤活性[9],已有学者在西红花治疗结直肠癌、乳腺癌等的抗肿瘤作用方面进行了相关研究[10-11],但其主要活性成分及抗肿瘤作用机制仍需进一步探索。
网络药理学[12]将系统生物学、生物信息学、计算生物学、网络科学和靶向药理学相结合,从系统层次和生物网络的整体角度探讨成分—靶标—通路的相互作用关系,为中药多靶点、多成分、系统性、整体性的作用机制研究提供了有力的技术支撑,从而指导新药研发和临床诊疗。因此,本研究应用网络药理学结合反向分子对接的方法,对西红花的抗肿瘤作用成分及靶点机制进行研究,为深入探索西红花抗肿瘤药效物质基础及作用机制提供参考。
1. 方法
1.1 西红花化学成分获取
利用TCMSP平台获取西红花化学成分,口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL) 是药物筛选的关键参数,一般设置OB≥30%和DL≥0.18的化学成分作为候选药效成分,并结合文献报道[13–15]补充4个西红花化学成分。
1.2 西红花活性成分和肿瘤疾病相关靶点整理
应用TCMSP平台和PharmMapper[16]工具获取西红花活性成分的作用靶点,并借助UniProt数据库将靶点转换为对应基因。以“tumor”、“cancer”为关键词,在GeneCards(https://www.genecards.org/)、OMIM数据库(https://www.omim.org/)和TTD数据库(http://db.idrblab.net/ttd/)进行检索。将得到的疾病靶点和药物靶点取交集,作为药物作用于疾病的预测靶点。
1.3 “成分-靶点”网络的构建
根据预测的西红花药效成分、交集靶点,使用Cytoscape 3.9.1软件建立“成分-靶点”的网络图。
1.4 蛋白质相互作用网络(protein-protein interaction,PPI)的构建与分析
将药物疾病交集靶点输入String数据库构建PPI网络进行初步筛选,再将PPI网络导入Cytoscape 3.9.1中,以半数degree为参考标准,选取关键靶点。
1.5 基因功能注释和富集通路分析
将筛选获得的37个核心靶点录入Metascape平台(http://metascape.org/gp/index.html),物种设置为人,选择Custom Analysis,设置P<0.01,进行基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.6 分子对接
将筛选出的西红花主要活性成分通过PubChem下载SDF格式;利用RCSB PDB数据库下载关键蛋白靶点,优先选择有配体、结构相对完整的晶体结构,并采用AutoDock Tools对获取的PDB蛋白分子进行除水、加氢、计算电荷预处理;使用AutoDock Vina进行分子对接,计算结合能;选取最优构象,使用PyMOL软件做出3D结合模式图。
2. 结果
2.1 西红花化学成分获取
通过TCMSP获得70个西红花化学成分,设置OB≥30%且DL≥0.18进行筛选,再添加文献检索相关成分,共获得9个西红花活性成分,见表1。
表 1 西红花活性成分序号 化合物编号 化合物英文名 中文名 OB (%) DL 1 MOL001389 n-heptanal 庚醛 79.74 0.59 2 MOL001406 crocetin 西红花酸 35.3 0.26 3 MOL000354 isorhamnetin 异鼠李素 49.6 0.31 4 MOL000422 kaempferol 山柰酚 41.88 0.24 5 MOL000098 quercetin 槲皮素 46.43 0.28 6 MOL001405 crocin Ⅰ 西红花苷Ⅰ 2.54 0.12 7 MOL001407 crocin Ⅱ 西红花苷Ⅱ 1.65 0.21 8 MOL000720 safranal 藏红花醛 39.56 0.04 9 MOL001409 picrocrocin 苦番红花素 33.71 0.04 2.2 西红花活性成分和肿瘤疾病靶点
将TCMSP平台和PharmMapper获取结果进行整理,并借助UniProt数据库进行靶基因匹配,获得201个潜在靶点。以“tumor”和“cancer”为关键词,在GeneCards、OMIM和TTD数据库进行预测整理,剔除重复,筛选得到5896个潜在疾病靶点。将得到的疾病靶点和药物靶点取交集,共得到可作为药物作用于疾病的179个预测靶点。
2.3 “成分-靶点”网络的构建与分析
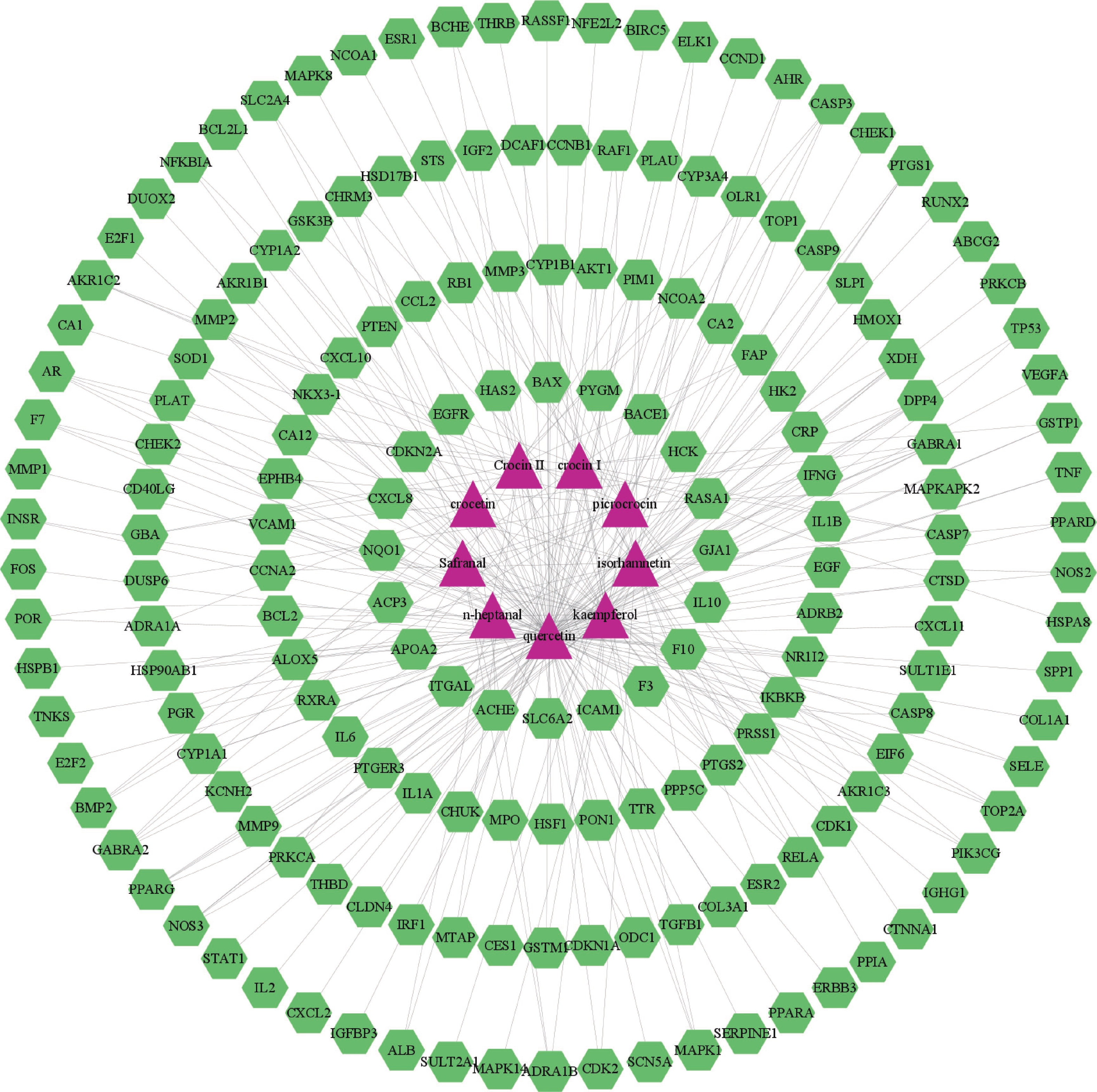
将西红花的9个活性成分与预测到的179个潜在靶点导入Cytoscape 3.9.1软件,构建“药物-活性成分-靶点”网络(图1),网络中绿色代表药物作用于疾病的靶点,蓝色代表西红花活性成分,全图包括189个节点、299条边,其中degree值排名靠前的活性成分为槲皮素、山柰酚、异鼠李素、苦番红花素和西红花苷Ⅰ,这些可能是西红花发挥抗肿瘤作用的潜在活性成分。
2.4 蛋白相互作用PPI的构建与分析
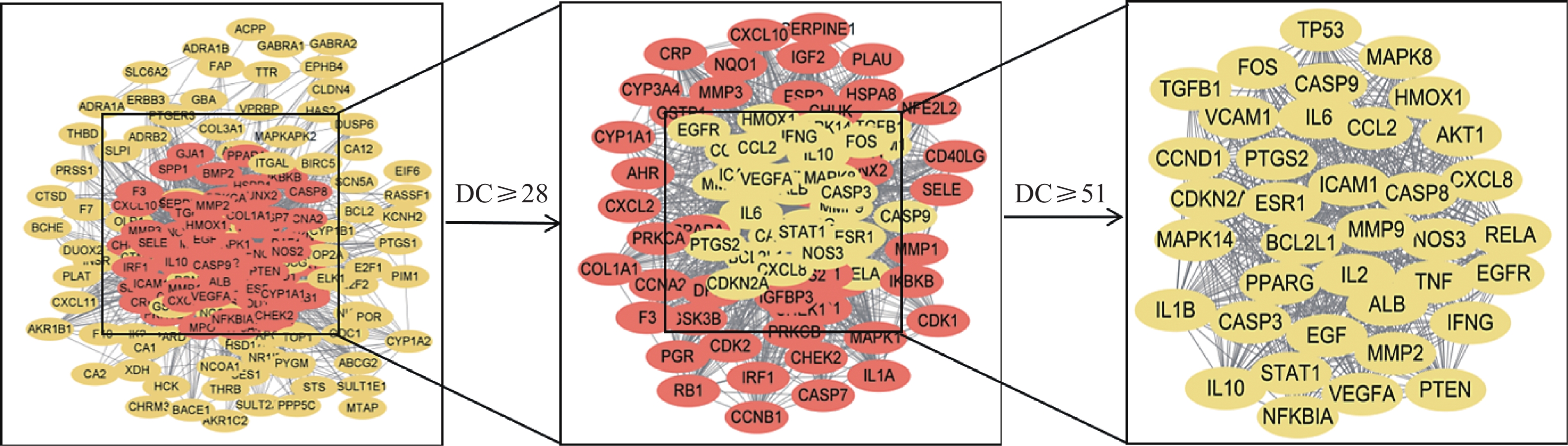
将疾病与活性成分的潜在靶点导入String数据库,采用Cytoscape 3.9.1软件绘制PPI网络图,依据degree值进行排序,以大于半数degree值为标准进行两次筛选,获取核心靶点37个(图2)。度值排名前5的靶点分别为EGF、MMP9、NFKBIA、IL-1B和IL-10,提示这些靶点可能是西红花发挥抗肿瘤作用的关键潜在靶点。
2.5 基因功能注释和富集通路分析
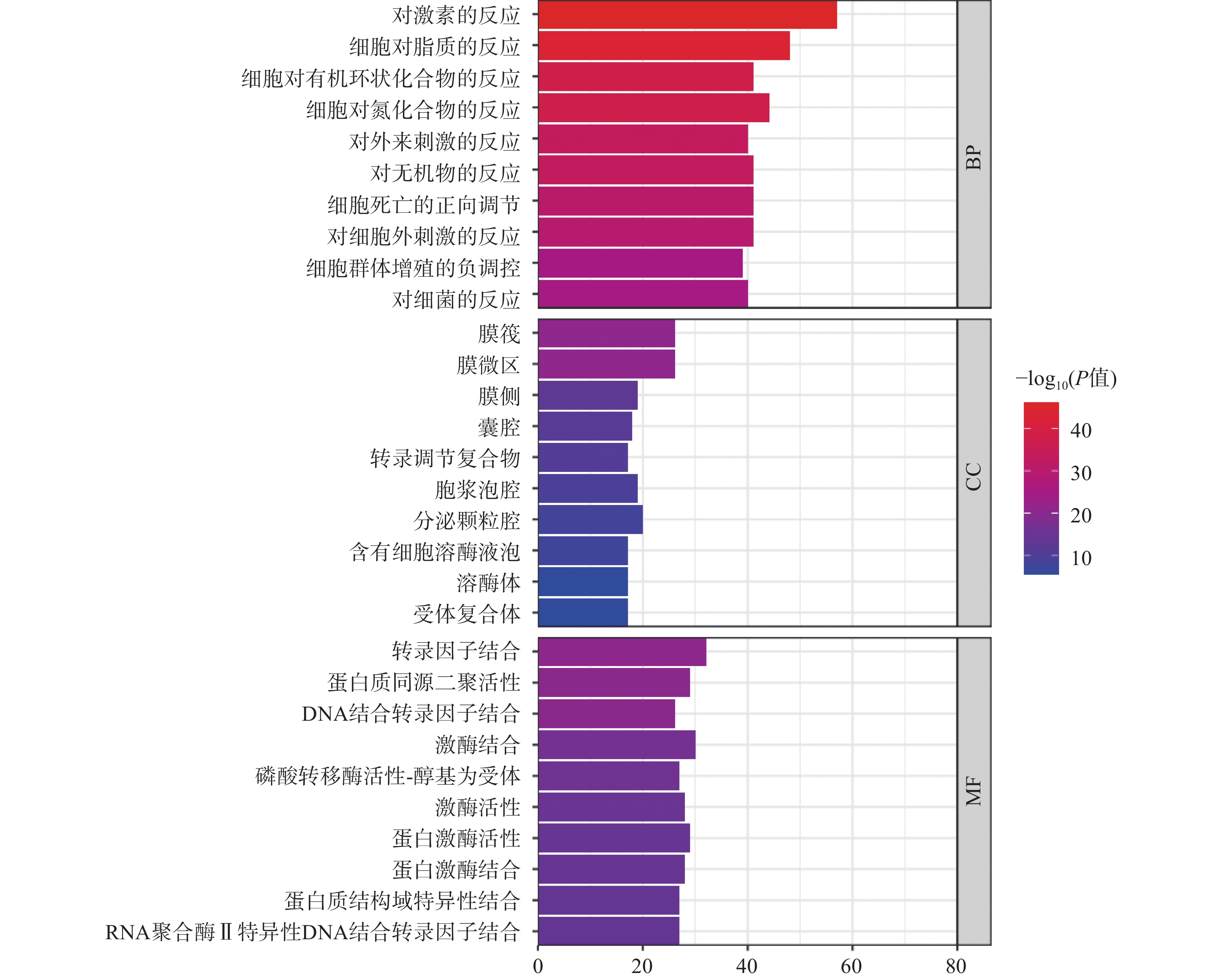
GO分析常用于注释基因和基因产物生物功能,分析包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)三部分。此次GO富集分析共得到BP富集结果193个、CC富集结果83个和MF富集结果123个,选取排名前10的条目绘制GO功能分析图(图3)。如图3所示,BP主要涉及对激素的反应、对脂质的反应、对异源刺激的反应等;CC主要涉及膜筏、膜微区、囊腔、细胞质囊泡腔等;MF主要涉及转录因子结合、DNA结合转录因子结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合等。通过比较发现,细胞生物过程富集的基因数较多,说明西红花可能主要通过调节生物过程发挥抗肿瘤作用。
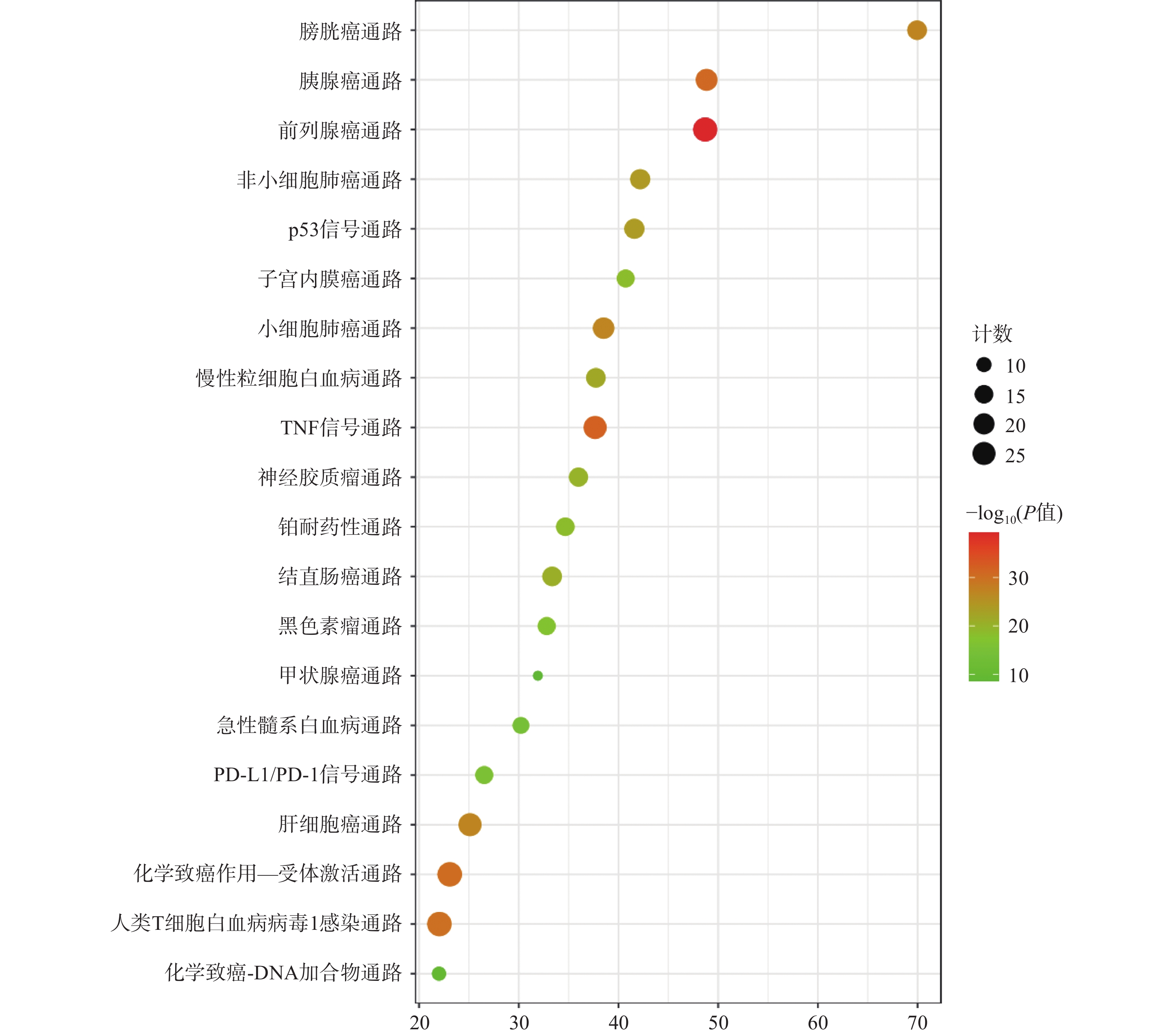
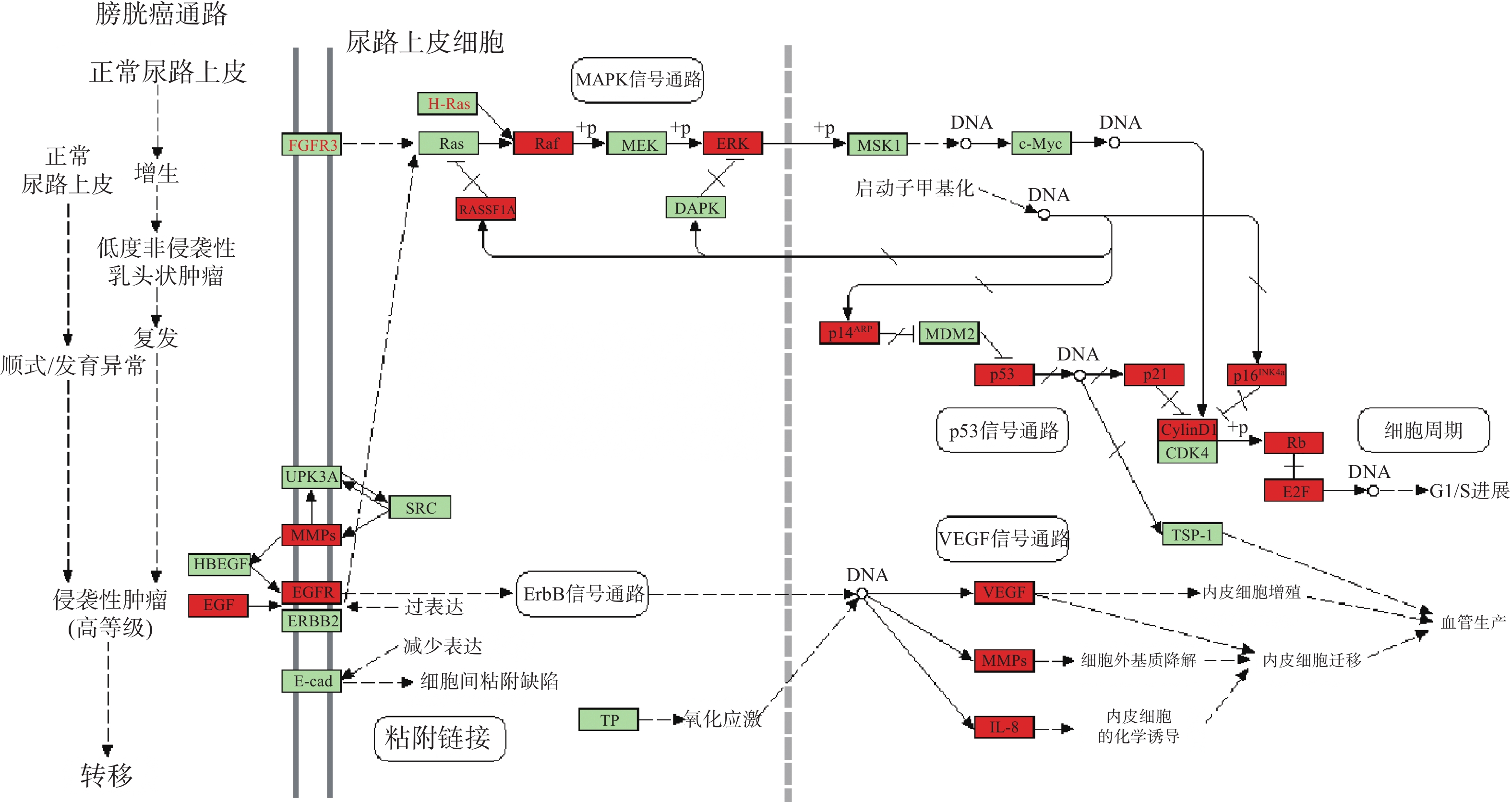
KEGG分析共富集到194条信号通路,其中34条癌症相关通路,并对前20条通路绘制气泡图(图4)。依据KEGG分析,西红花可能通过p53信号通路、TNF通路发挥抗肿瘤作用,可能对膀胱癌、胰腺癌、前列腺癌、非小细胞肺癌等肿瘤具有治疗作用,西红花靶点-通路相互作用网络见图5,红色三角形代表与肿瘤相关的信号通路,蓝色矩形代表关键靶点。其中,西红花通过膀胱癌信号通路调控EGF、MMPs、Raf、VEGF、ERK等基因发挥抗肿瘤作用(图6),红色矩形代表西红花可能干预的关键靶点。
2.6 分子对接
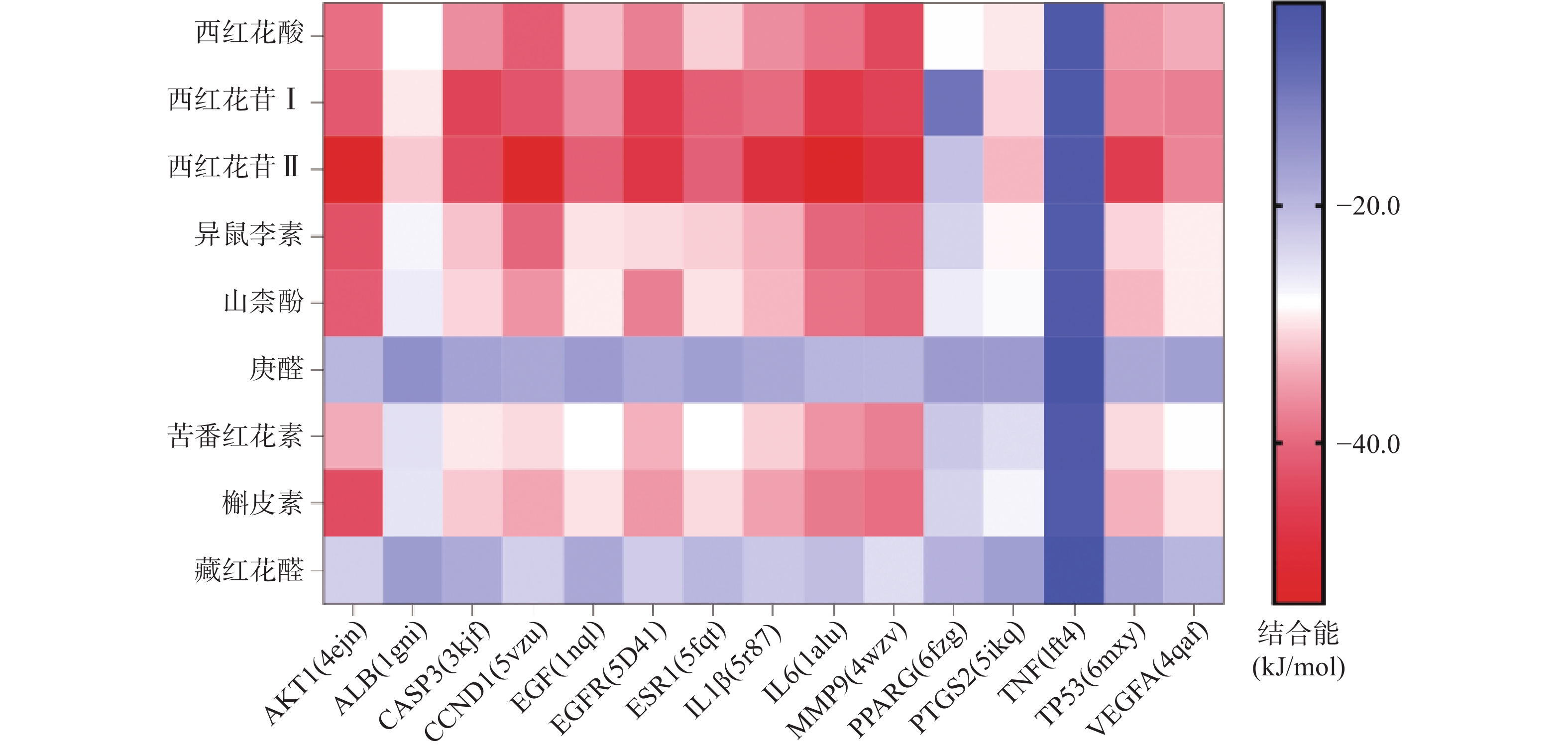
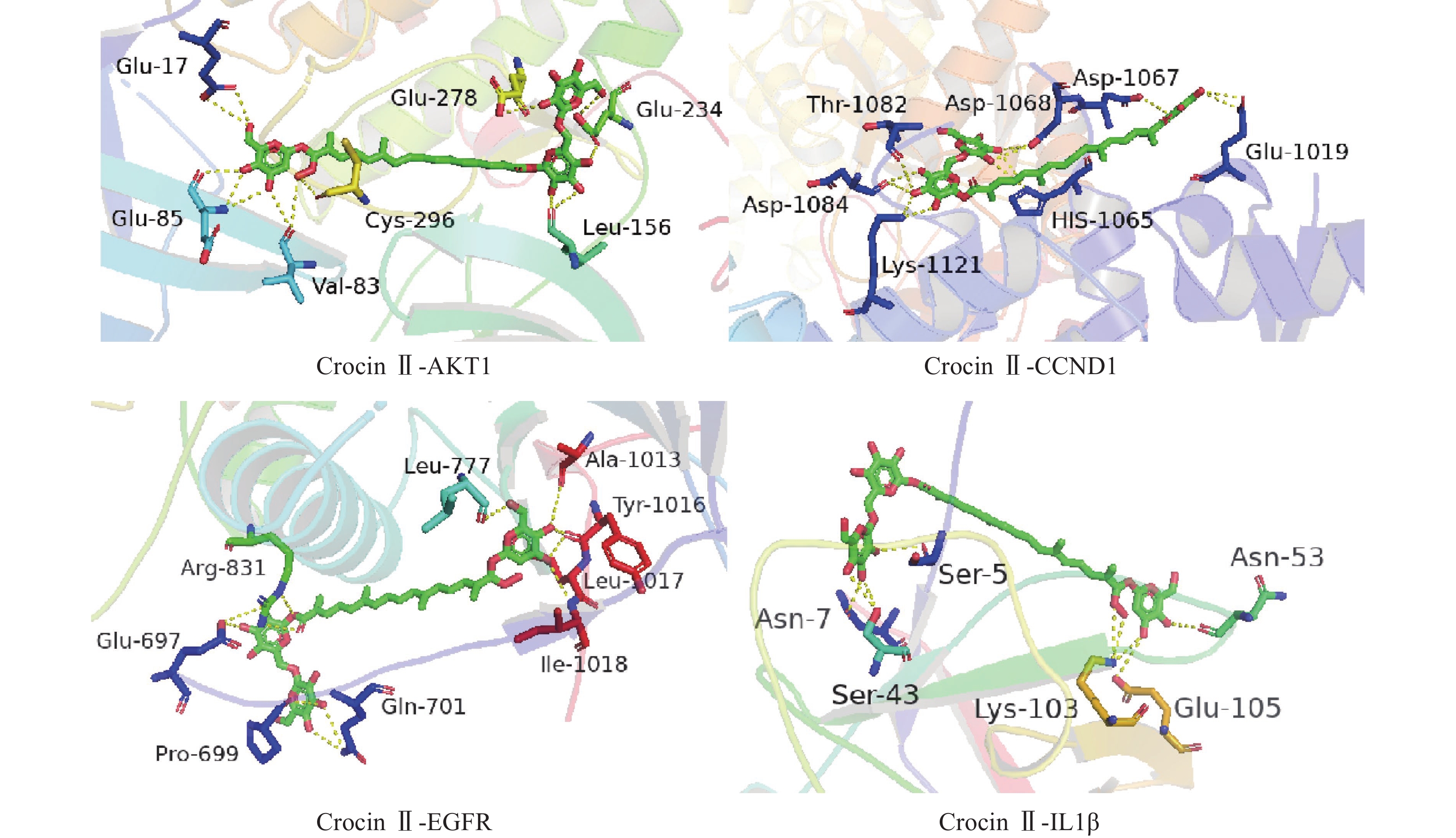
将前15个潜在核心靶点与西红花活性成分进行分子对接。结合能(affinity)<0表明配体分子能够与受体蛋白自发结合,结合能≤−17.78 kJ/mol表明配体与受体有一定的结合活性,结合能≤−20.92 kJ/mol 表明配体与受体有较好的结合活性,结合能≤−29.29 kJ/mol 表明配体与受体有强的结合活性[17],且结合能越低,表明对接的效果越好,结合的构象越稳定[18]。经AutoDock Vina对接,将得到的结合能数据使用热图展示(图7)。本研究结合自由能小于−20.92kJ/mol 的活性成分有102个,占75.6%;小于−29.29kJ/mol 的活性成分有73个,占54.1%,可见这些核心化合物与受体结合活性较高,结构相对稳定。选取结合能力最好的4个组合用Pymol软件进行可视化处理(图8)。
3. 讨论
肿瘤的发生和发展是多基因、多步骤的结果。中药多成分、多靶点的特点使其在肿瘤治疗方面有独特的优势。大量的临床实践表明,中药在治疗肿瘤中能够改善症状、提高患者生存质量、延长生存期等,有着其他治疗药物及手段不可替代的作用[19-20]。以中药黄芪为例,不仅可以通过Wnt5/β-catenin信号通路抑制肿瘤生长[21],同时具有通过PD-L1下调诱导耐药黑色素瘤的干性抑制和化疗敏感性增强的作用,可以减少化疗药物用量[22],还能充当免疫佐剂,提高患者免疫力,改善生存质量[23]。网络药理学最大的优势在于可以运用系统生物学的分析,为中药多成分、多靶点、多通路的机制研究提供有力的技术支撑[12],其分析理念和技术路径又与中医药治疗疾病的整体观相契合,已用于多种中药和中药复方作用机制的研究,如灯盏细辛、半枝莲等中药和茵陈蒿汤、桃红四物汤等中药复方,利用网络药理学的方法得到治疗机制的详细阐述和证明[24–27],为中药药理作用机制的探索提供了很好的参考。
本研究发现西红花中多种成分,如西红花酸、西红花苷等可与IL-6、AKT1、CCND1、IL-1β、MMP9、EGFR、TP53靶点产生适度结合,提示这些靶点可能是西红花中活性成分发挥抗肿瘤作用的关键靶点。研究发现,AKT1是PI3K-AKT-mTOR信号通路中的重要靶点,被磷酸化激活后可以促进细胞的增殖与存活,与肿瘤细胞的生长密切相关[28]。多项研究表明,通过抑制AKT1可以治疗肺癌、结肠癌、卵巢癌等多种实体癌[29]。EGFR与一些全球发病率和致死率高的癌症发病机制直接或间接相关,包括肺癌、乳腺癌和结直肠癌等[30]。当EGFR过度表达时,细胞表面会出现过量的受体,诱导正常的细胞转化为癌细胞,并为癌细胞持续生存提供条件[31]。CCND1是细胞周期家族的一员[32],公认的原癌基因,在甲状旁腺瘤、乳腺癌、肝癌及食管、肺、头颈部鳞状细胞癌的发生、发展过程中均起着重要作用[33-34]。西红花苷是由西红花酸和龙胆二糖或葡萄糖结合形成的二萜苷类化合物,西红花苷Ⅰ和西红花苷Ⅱ的差别在于分子中糖苷基数目的多少 [35]。西红花酸已具有抗肿瘤作用,以其为苷元形成的西红花苷同样也表现出较好的抗肿瘤活性,其中西红花苷Ⅱ的表现最好。西红花苷可以通过P53途径下调细胞周期蛋白d1和p21的表达,诱导细胞凋亡和细胞周期停滞,从而抑制肿瘤生长[36]。分子对接的结果与GO富集分析、KEGG通路富集分析结果一致,验证了网络药理学分析结果的正确性。
Buyun等学者在肝癌Hep3B和HepG2细胞中使用西红花苷抑制了IL-6对STAT3以及细胞周期蛋白D1的激活,验证了西红花对肝癌细胞的抗增殖,凋亡和阻断入侵作用[37]。在转移性乳腺癌的研究中,Ali等研究人员在体内和体外实验中均证明了西红花苷可以通过VEGF和MMP9下调发挥抗肿瘤作用,而且对乳腺癌的转移扩散有较好的抑制作用[38]。这些研究成果在一定程度上验证了利用网络药理学探究发现的西红花抗肿瘤作用机制的可行性。
综上所述,本研究利用网络药理学结合分子对接技术,探究西红花抗肿瘤作用的活性成分、作用靶点及信号通路。发现西红花抗肿瘤的作用具有多成分、多靶点、多通路、多机制的特点,其中以西红花苷为代表的西红花特有化学成分显示出了良好的抗肿瘤活性,可以在多条肿瘤发生通路中发挥作用,为西红花治疗肿瘤的深入研究提供了理论基础。但这些结果受限于各个数据库信息的片面性,而且只关注了成分,没有考量到成分的含量及其之间是否存在相互作用,预测的结果存在一定的片面性和局限性,需要进一步进行体内、外实验验证。
-
[1] SUEHIRO M. Historical review on chemical and medical studies of globefish toxin before World War II[J]. Yakushigaku Zasshi,1994,29(3):428-434. [2] KALAITZIS J A, CHAU R, KOHLI G S, et al. Biosynthesis of toxic naturally-occurring seafood contaminants[J]. Toxicon,2010,56(2):244-258. doi: 10.1016/j.toxicon.2009.09.001 [3] SATO K, AKAI S, SHOJI H, et al. Stereoselective and efficient total synthesis of optically active tetrodotoxin from D-glucose[J]. J Org Chem,2008,73(4):1234-1242. doi: 10.1021/jo701655v [4] CHAU J, CIUFOLINI M A. The chemical synthesis of tetrodoxin: an ongoing quest[J]. Mar Drugs,2011,9(10):2046-2074. doi: 10.3390/md9102046 [5] MURAKAMI K, TOMA T, FUKUYAMA T, et al. Total synthesis of tetrodotoxin[J]. Angew Chem,2020,132(15):6312-6316. doi: 10.1002/ange.201916611 [6] MOSHER H S, FUHRMAN F A, BUCHWALD H D, et al. Tarichatoxin: tetrodotoxin: a potent neurotoxin[J]. Science,1964,144(3622):1100-1110. doi: 10.1126/science.144.3622.1100 [7] LEHMAN E M, BRODIE E D Jr, BRODIE E D 3rd. No evidence for an endosymbiotic bacterial origin of tetrodotoxin in the newt Taricha granulosa[J]. Toxicon,2004,44(3):243-249. doi: 10.1016/j.toxicon.2004.05.019 [8] NOGUCHI T, ARAKAWA O, TAKATANI T. TTX accumulation in pufferfish[J]. Comp Biochem Physiol D Genom Proteom,2006,1(1):145-152. [9] CHENG C A, HWANG D F, TSAI Y H, et al. Microflora and tetrodotoxin-producing bacteria in a gastropod, niotha clathrata[J]. Food Chem Toxicol,1995,33(11):929-934. doi: 10.1016/0278-6915(95)00061-6 [10] WU Z L, YANG Y, XIE L P, et al. Toxicity and distribution of tetrodotoxin-producing bacteria in puffer fish Fugu rubripes collected from the Bohai Sea of China[J]. Toxicon,2005,46(4):471-476. doi: 10.1016/j.toxicon.2005.06.002 [11] SIMIDU U, KITA-TSUKAMOTO K, YASUMOTO T, et al. Taxonomy of four marine bacterial strains that produce tetrodotoxin[J]. Int J Syst Bacteriol,1990,40(4):331-336. doi: 10.1099/00207713-40-4-331 [12] NOGUCHI T, ARAKAWA O. Tetrodotoxin: distribution and accumulation in aquatic organisms, and cases of human intoxication[J]. Mar Drugs,2008,6(2):220-242. doi: 10.3390/md6020220 [13] MATSUMURA K. Reexamination of tetrodotoxin production by bacteria[J]. Appl Environ Microbiol,1995,61(9):3468-3470. doi: 10.1128/aem.61.9.3468-3470.1995 [14] 黄军, 严美姣, 陈国宏. 河豚毒素的起源及其研究进展[J]. 生物技术通讯, 2006, 17(6):998-1000. doi: 10.3969/j.issn.1009-0002.2006.06.047 [15] CHAU R, KALAITZIS J A, NEILAN B A. On the origins and biosynthesis of tetrodotoxin[J]. Aquat Toxicol,2011,104(1-2):61-72. doi: 10.1016/j.aquatox.2011.04.001 [16] WILLIAMS M. The Merck index: an encyclopedia of chemicals, drugs, and biologicals[J]. Choice Reviews Online,2007,44(10). [17] ZHANG X, HUANG X Y, LIN W Y. Stable pharmaceutical composition of freeze-dried tetrodotoxin powder: US8124608[P]. 2012-02-28. [18] 杨春, 苏秀榕, 李太武, 等. 低毒河豚鱼毒素的提取和检测[J]. 天然产物研究与开发, 2003, 15(5):398-400. doi: 10.3969/j.issn.1001-6880.2003.05.006 [19] HERZOG R I, CUMMINS T R, WAXMAN S G. Persistent TTX-resistant Na+ current affects resting potential and response to depolarization in simulated spinal sensory neurons[J]. J Neurophysiol,2001,86(3):1351-1364. doi: 10.1152/jn.2001.86.3.1351 [20] 殷芹, 刘岩, 宫庆礼. 河豚毒素的理论及应用研究进展[J]. 海洋通报, 2008, 27(6):95-100. doi: 10.3969/j.issn.1001-6392.2008.06.014 [21] VENKATESH B, LU S Q, DANDONA N, et al. Genetic basis of tetrodotoxin resistance in pufferfishes[J]. Curr Biol,2005,15(22):2069-2072. doi: 10.1016/j.cub.2005.10.068 [22] 陈学军, 王陈, 石童, 等. TTX和吗啡对醋酸扭体小鼠联合镇痛效应的研究[C]//中国毒理学会. 中国毒理学会第九次全国毒理学大会论文集. 太原: 中国毒理学会, 2019: 13 [23] 张凤云, 库宝善, 姚海燕, 等. 河豚毒素单用及与indoxacarb联合应用的镇痛抗炎作用[J]. 中国临床康复, 2006, 10(34):115-118. [24] HAGEN N A, DU SOUICH P, LAPOINTE B, et al. Tetrodotoxin for moderate to severe cancer pain: a randomized, double blind, parallel design multicenter study[J]. J Pain Symptom Manag,2008,35(4):420-429. doi: 10.1016/j.jpainsymman.2007.05.011 [25] HAGEN N A, FISHER K M, LAPOINTE B, et al. An open-label, multi-dose efficacy and safety study of intramuscular tetrodotoxin in patients with severe cancer-related pain[J]. J Pain Symptom Manage,2007,34(2):171-182. doi: 10.1016/j.jpainsymman.2006.11.008 [26] 王开业. 一种用于戒毒、镇痛的河豚毒素制剂: CN101317846A[P]. 2010-11-10. [27] 潘心富, 刘助国, 黄致强. 用于戒毒, 镇痛的河豚毒素呼吸道给药制剂: CN1459286A[P]. 2003-12-03. [28] 朱成华, 王桂兰, 李蕴山, 等. 河鲀毒素(TTX)对抗心律失常药疗效和毒性的影响[J]. 河北渔业, 1985(2):46-48. [29] 洪碧红, 易瑞灶, 陈永强, 等. 具有抗心律失常作用的河豚毒素复方制剂及其制备方法: CN105030782A[P]. 2019-11-08. [30] BOWER D J, HART R J, MATTHEWS P A, et al. Nonprotein neurotoxins[J]. Clin Toxicol,1981,18(7):813-863. doi: 10.3109/15563658108990310 [31] 蔡志基, 李密, 王越, 等. 国产河豚毒素的药理研究(摘要)[J]. 河北水产科技, 1983(1):1-3. [32] LI W J, BERGMAN S M, HOLMES R P, et al. Tetrodotoxin protects against acute ischemic renal failure in the rat[J]. J Urol,1992,147(2):519-522. doi: 10.1016/S0022-5347(17)37292-0 [33] 刘皓, 刘延东. 河豚毒素在制备治疗前列腺病症药物组合物中的应用、药物组合物及制备方法: CN107308166A[P].2017-11-03. [34] 徐跑, 赵继红, 蒋火金, 等. 河豚毒素在制备抑制肺癌细胞或肿瘤增长的药物中的应用: CN108524521A[P]. 2018-09-14 [35] W·林, 克劳德·卡迪纳尔, F·H·沈. 河豚毒素的固体口服制剂: CN1972689A[P]. 2007-05-30. [36] KAVOOSI M, O'REILLY T E, KAVOOSI M, et al. Safety, tolerability, pharmacokinetics, and concentration-QTc analysis of tetrodotoxin: a randomized, dose escalation study in healthy adults[J]. Toxins (Basel),2020,12(8):E511. doi: 10.3390/toxins12080511 [37] 赵继红, 汤波澜. 一种河豚毒素口服液态制剂及其制备方法: CN102784102A[P]. 2015-01-21. [38] HAGEN N A, CANTIN L, CONSTANT J, et al. Tetrodotoxin for moderate to severe cancer-related pain: a multicentre, randomized, double-blind, placebo-controlled, parallel-design trial[J]. Pain Res Manag,2017,2017:7212713. [39] HONG B, HE J, SUN J, et al. Analgesia effect of enteric sustained-release tetrodotoxin pellets in the rat[J]. Pharmaceutics,2020,12(1):E32. doi: 10.3390/pharmaceutics12010032 [40] H·H·布希曼, J·M·维拉·赫尔南德斯, J·M·贝扬斯. 钠通道阻滞剂治疗由于化疗而产生的神经病理性疼痛的用途: CN 101563079 A[P]. 2013-09-04. [41] 易瑞灶, 陈晖, 洪碧红, 等. 河豚毒素冻干粉针制剂及其制备方法: CN101352422A[P]. 2009-01-28. -





 下载:
下载:

 下载:
下载:


