-
隐丹参酮(CTS)是中药丹参的有效成分之一,国内外研究证明CTS具有抗肿瘤、抗炎、神经保护、心血管保护、抗纤维化和调节代谢紊乱等药理特性,具有广阔的临床应用前景。抗肿瘤作用是近年来隐丹参酮药理活性研究的热点问题之一[1]。隐丹参酮对肺癌、肝胆癌、胃癌、食管癌、乳腺癌、前列腺癌、胰腺癌、结直肠癌、骨肉瘤癌、黑色素瘤、横纹肌瘤、食管鳞状癌等多种恶性肿瘤表现出一定的抑制活性,其抗肿瘤机理包括抑制肿瘤细胞增殖、迁移和侵袭,诱导细胞凋亡,调节免疫以及抑制包括STAT3在内的多种信号通路[2-4]。由于CTS中等强度的药理活性和选择性,近年来研究人员对CTS进行了大量结构修饰,期望获得靶点明确且药理活性更强的CTS衍生物,从而开发并应用于临床治疗。本文就隐丹参酮及其衍生物在抗肿瘤方面的作用及其机制进行综述。
-
癌细胞的主要特点是具有无限的增殖能力。研究表明,CTS可以抑制多种肿瘤细胞增殖,包括胰腺癌细胞BxPC-3、慢性髓性白血病细胞K562/ADR、胶质瘤细胞U87、人卵巢癌细胞Hey、前列腺癌细胞DU145、乳腺癌细胞MCF7、食管鳞状细胞癌ESCC等[5]。
-
细胞凋亡又称细胞程序性死亡,对于维持组织稳态和消除不需要或受损细胞起重要作用。研究发现,CTS可以诱导多种肿瘤细胞凋亡,包括骨髓瘤细胞U266、人结肠癌细胞系SW620 Ad300和HCT116、人胃癌细胞MKN-45、肝癌细胞Hepa1-6、非小细胞肺癌细胞A549 和H460 、黑色素瘤细胞A375、横纹肌肉瘤细胞Rh30等[6]。
-
高侵袭性和转移是癌细胞恶性特征,转移是癌症死亡的主要原因。因此,抑制癌细胞转移能有效降低癌症死亡率。研究发现,CTS能够抑制卵巢癌细胞A2780的迁移和侵袭[7]。此外,CTS还可以抑制食管癌细胞EC109、膀胱癌细胞T24、人舌鳞癌细胞CAL27、小鼠结肠癌细胞CT26等多种肿瘤细胞的迁移和侵袭[5]。
-
隐丹参酮不仅能够直接抑制多种肿瘤细胞的生长,还可以诱导机体产生抗肿瘤免疫反应,从而间接发挥抗肿瘤效应。研究发现,隐丹参酮能够通过增加CD4+T细胞的细胞毒作用,抑制人非小细胞肺癌H446细胞和乳腺癌MCF7细胞的生长[8]。此外,隐丹参酮还可以通过诱导小鼠树突状细胞成熟,促进抗原提呈功能,进而诱导T细胞活化增殖,抑制Lewis肺癌细胞的增殖[9]。肿瘤相关巨噬细胞 (TAM) 是肿瘤组织中浸润的巨噬细胞,具有异质性,可分为M1和M2表型。M2表型的TAM能够促进肿瘤生长和转移,相反,M1表型则具有肿瘤抑制和促炎特性。研究发现,隐丹参酮和PD-L1联合治疗能够诱导巨噬细胞向M1极化,从而抑制小鼠肝癌Hepa1-6移植瘤的生长[10]。
-
耐药是导致肿瘤复发和治疗失败的主要原因。研究表明,CTS能够逆转慢性骨髓性白血病细胞K562对伊马替尼的耐药性[11],改善A549细胞对顺铂的耐药性[12]。此外,CTS还可以逆转P-糖蛋白(p-gp)过表达的结肠癌细胞SW620 Ad300对多柔比星和伊立替康的多重耐药[13]。
-
除了具有以上活性之外,CTS还可以与其他不同抗癌药物或细胞因子协同发挥抗肿瘤作用。例如,CTS和紫杉醇的联合用药比单独用药更能有效诱导舌鳞状细胞癌CAL27和SCC-9细胞的凋亡[14]。新近研究发现,CTS与小剂量的抗PD-L1抗体合用对小鼠Lewis 肺癌的生长抑制作用明显优于CTS单独应用[9]。
-
自噬,即Ⅱ型程序性细胞死亡,作为凋亡之外的另一种可以杀死细胞的途径,是一种抑制癌细胞生长的新方法。研究显示,CTS可通过诱导结肠癌SW620 Ad300细胞和A549细胞自噬促进细胞死亡[15-16]。
-
CTS抑制肿瘤细胞增殖、迁移和侵袭,诱导细胞凋亡,以及调节免疫等作用的机制十分广泛,涉及靶点STAT3、酪氨酸蛋白磷酸酶SHP2、DNA拓扑异构酶和信号通路磷酸酰肌醇3-激酶(PI3K)/丝氨酸/苏氨酸激酶Akt等。
-
STAT3由Janus激酶(JAKs)激活,参与肿瘤增殖、凋亡、血管生成及免疫逃逸等。STAT3在大多数恶性肿瘤中被组成性激活,异常的STAT3信号传导是肿瘤恶性进展的重要过程。当705位酪氨酸残基磷酸化后,STAT3被激活,单体STAT3通过其SH2结构域形成二聚体,并从细胞质转移到细胞核中,调节其靶基因的表达,例如,上调cyclin D1、survivin、Mcl-1、MYC、BCL-XL表达,下调 p53表达,促进肿瘤细胞增殖和存活;上调MMP2/9、Twist1、Vimentin表达,促进肿瘤转移;上调TGF-β、IL-6/10、PD-1、PD-L1、VEGF表达,下调CD80/86、MHCII、TNF、IL-12、CCL5、CXCL10等表达,抑制肿瘤微环境免疫功能[17]。研究发现,CTS能够直接与STAT3的SH2结构域结合,特异性抑制STAT3 Tyr705的磷酸化,抑制STAT3二聚化[18-19],相比之下,姜黄素还能抑制Jak2的表达[20]。在人胰腺癌BxPC-3细胞中,CTS能够抑制BxPC-3细胞的STAT3信号通路进而抑制细胞增殖,诱导细胞凋亡,达到抗肿瘤的作用[21]。另外,CTS作为p-STAT3抑制剂,能够有效阻断IL-6介导的STAT3活化,抑制肿瘤增殖,逆转BCR-ABL激酶非依赖性耐药途径[11]。此外,CTS和紫杉醇联合治疗能够有效地抑制舌鳞状癌TSCC细胞增殖和迁移,其作用机制同样与抑制STAT3信号通路相关[14]。沉默信息转录调控因子3(SIRT3)是一种蛋白质去乙酰化酶,参与癌症、心血管、神经系统等疾病的发展过程。研究发现CTS能够通过抑制STAT3/SIRT3 信号通路抑制人卵巢癌A2780 细胞增殖[22]。 上述研究表明,抑制STAT3信号通路对于CTS抗肿瘤至关重要,且CTS是一种特异性的STAT3抑制剂。
-
含Src同源2结构域蛋白酪氨酸磷酸酶(SHP2)由基因PTPN11编码,PTPN11突变引起SHP2催化活性异常增加。研究发现,肺癌、结肠癌、黑色素瘤、神经母细胞瘤、肝癌和急性髓性白血病等病人均发现有PTPN11突变[23]。SHP2是一种非受体蛋白酪氨酸磷酸酶,参与Ras-Erk、PI3K-Akt、Jak-Stat和NF-κB多条信号通路传导,调控细胞的增殖、迁移和凋亡等过程[24]。研究证明,CTS能与SHP2直接结合,是一个混合型蛋白酪氨酸磷酸酶抑制剂,抑制SHP2 的IC50为22.50μmol/L,抑制SHP1的IC50为39.50μmol/L。用SHP2 siRNA敲减Hela细胞中SHP2后,CTS抑制Hela细胞生长的敏感性降低,提示SHP2是CTS的一个靶点,但是,CTS仍然可以进一步抑制SHP2敲减细胞生长,说明CTS还有其它作用靶点[25]。此外,有研究发现,CTS能够上调胶质瘤细胞 U87 SHP2蛋白酪氨酸磷酸酶活性,抑制STAT3 Tyr705的磷酸化,从而在体内外表现出抑制恶性胶质瘤活性[26]。
-
DNA拓扑异构酶 (topos),包括DNA拓扑异构酶1(topo1)和DNA拓扑异构酶2(topo2),其中topo2因其在有丝分裂中的关键作用被认为是抗癌治疗的重要靶点[27]。研究表明,CTS能够显著降低前列腺癌PC3细胞中topo 2a的mRNA、蛋白和酶活性水平,并且在裸鼠异种移植模型中表现出良好的抗肿瘤作用[28]。
-
活性氧与肿瘤的发展密切相关,其过度产生可诱导多种生物学效应,包括抑制细胞增殖、诱导细胞凋亡和自噬等[29]。研究发现,CTS能够促进胃癌MKN-28 细胞ROS的累积,通过调控MAPK和AKT信号通路诱导G2/M周期阻滞[30];通过ROS-线粒体途径,上调cleaved caspases-3、促凋亡蛋白Bax和下调抗凋亡蛋白Bcl-2,从而诱导黑色素瘤细胞凋亡[31];诱导横纹肌肉瘤Rh30细胞ROS产生,激活JNK/p-38,抑制Erk1/2,导致细胞凋亡[32];刺激SW620 Ad300细胞中的ROS产生,诱导p38 MAPK激活,导致NF-κB从细胞质转移到细胞核中,最终导致自噬发生[15];刺激HepG2和MCF-7细胞产生ROS,激活内质网(ER)应激,增强不同抗癌药物或细胞因子(Fas/Apo-1、TNF-α、顺铂、依托泊苷或5-FU)诱导的细胞凋亡[33]。
-
雄激素受体(AR)和雌激素受体(ER)分别是治疗前列腺癌PCa和乳腺癌的主要靶点。研究发现CTS可以通过抑制AR二聚化有效抑制AR活性,从而抑制AR+ PCa细胞的生长[34];在异种移植动物模型中,CTS可以有效抑制人前列腺癌CWR22Rv1细胞的生长和AR靶基因的表达[35]。此外,CTS还能够抑制乳腺癌细胞的生长,通过竞争性地结合ERα抑制E2诱导的ER转录活性和ER靶基因的表达[36];同时,CTS可以有效地抑制体内异种移植瘤模型中ER信号,发挥抗肿瘤作用[37]。
-
磷酸肌醇3-激酶(PI3K)/蛋白质丝氨酸苏氨酸激酶(Akt)信号通路参与肿瘤的发生、生长、存活和转移。有研究发现CTS可抑制PI3K/AKT信号通路,增加caspase-3、caspase-9、PARP和Bax的表达,降低Bcl-2、survivin、细胞凋亡抑制蛋白的表达,诱导非小细胞肺癌细胞的凋亡[38-39]。酪氨酸激酶胰岛素生长因子1受体(IGF-1R)在肿瘤细胞的生长、分化和进展中起关键的作用。研究表明,CTS能够通过下调IGF-1R/PI3K/Akt信号通路抑制人肺癌细胞的增殖[40]。此外,有文献报导CTS可以通过调节PI3K/Akt/mTOR信号,抑制结肠癌CT26细胞的侵袭[41]。在裸鼠异种移植实验中,CTS能够显著抑制小鼠体内异种移植物的生长,其作用机制与抑制PI3K/AKT/NF-κB信号通路有关[42]。以上研究表明PI3K/AKT信号通路可能是CTS抗肿瘤的有效信号通路之一。
-
CTS虽然具有广谱的抗肿瘤活性,但是其药理作用中等,疏水性强且难吸收,口服生物利用度只有2.1%,这些缺点严重阻碍了其开发和应用[43]。近年来,针对CTS存在的问题,人们尝试对CTS进行结构改造,期望获得生物活性高、水溶性好的化合物。刘航[44]等基于CTS是一种STAT3抑制剂,通过对CTS及其骨架类似物进行修饰,设计合成了CTS衍生物62个,其中新化合物46个,通过报告基因法检测发现有27个新化合物对STAT3转录抑制效果优于CTS,IC50最低0.5976 μmol/L。Wang等基于STAT3的药物设计策略,设计合成了一种亲和力和抑制活性更强的新型CTS衍生物LYW-6,该化合物与STAT3结合解离常数Kd约为6.6μmol/L,能够显著抑制STAT3磷酸化、二聚化、核转位以及转录活性。在细胞水平上,LYW-6能选择性抑制高STAT3活性的结肠癌细胞增殖、迁移,促进凋亡,体内可抑制结肠癌的生长和转移,是一个具有开发前景的抗肿瘤活性化合物[45]。为了改善CTS的水溶性,Xu等合成了几种CTS的钠盐衍生物,结果发现这些衍生物比CTS更易溶解,同时保留了CTS的生物活性,其中钠盐衍生物PTS33可以有效地抑制二氢睾酮DHT诱导AR反式激活和PCa细胞生长[46]。
-
CTS具有广谱的抗肿瘤活性,该活性与抑制肿瘤细胞增殖、迁移和侵袭,诱导细胞凋亡,逆转耐药性,诱导自噬等作用相关。除直接作用于肿瘤细胞外,CTS还可以通过增强CD4+T细胞的细胞毒作用、诱导DC细胞成熟和促使巨噬细胞M1型极化,间接杀伤肿瘤细胞。分子机制研究表明,CTS可直接结合STAT3和SHP2,有效调节JAK/STAT3、NF-κB、PI3K/AKT和IGF-1R等信号通路发挥抗肿瘤作用。隐丹参酮特异性抑制STAT3信号通路,而不抑制STAT家族中的其他蛋白,是其一大特点。因为尽管其他天然产物也有抗肿瘤作用,但不是特异性STAT3抑制剂,例如姜黄素,是一种STAT抑制剂,但在治疗24 h后降低了STAT3的表达。虽然CTS表现出良好的药理活性,但水溶性差和生物利用度低等问题限制了其广泛应用。因此,基于靶点STAT3,以CTS作为先导化合物,设计并合成一系列CTS衍生物,有望开发出新型STAT3抑制剂用于癌症治疗。
Progress on the antitumor activity of cryptotanshinone and its derivatives
-
摘要: 隐丹参酮是中药丹参的有效成分之一,对多种肿瘤显示很好的活性。其抗肿瘤效应包括抑制细胞增殖、诱导肿瘤细胞凋亡、抑制细胞迁移和侵袭、调节机体免疫功能和逆转药物耐药性等。抗肿瘤直接靶点有信号转导和转录激活因子3(STAT3)、酪氨酸蛋白磷酸酶SHP2、DNA拓扑异构酶2(top2) ,其它的作用机制包括诱导活性氧(ROS)产生、调控雌、雄激素受体信号、抑制PI3K/AKT信号通路等。此外,近年来研究人员还设计合成了许多隐丹参酮衍生物,并对其抗肿瘤作用进行了研究。本文主要就隐丹参酮及其衍生物抗肿瘤活性研究进展进行综述,希望能够有助于隐丹参酮及其衍生物在抗肿瘤方面的药物研发。Abstract: Cryptotanshinone is one of the effective components of traditional Chinese medicine salvia miltiorrhiza which shows good activities against a variety of tumors. Its anti-tumor effects include inhibition of tumor cell proliferation, induction of cell apoptosis, inhibition of cell migration and invasion, regulation of immune function and reversal of drug resistance. The direct anti-tumor targets include signal transducer and activator of transcription 3 (STAT3), tyrosine protein phosphatase SHP2, DNA topoisomerase 2, and other mechanisms of action include the induction of reactive oxygen species (ROS) production, regulation of estrogen and androgen receptor signaling, and inhibition of PI3K/AKT signaling pathway. In addition, many cryptotanshinone derivatives have been designed and synthesized to study the antitumor effects. The research progress of the antitumor activity of cryptotanshinone and its derivatives were reviewed in this paper to give references to the anti-tumor drug development of cryptotanshinone and its derivatives.
-
Key words:
- cryptotanshinone /
- derivatives /
- anti-tumor /
- mechanism
-
肝纤维化是肝脏对慢性肝损伤的过度修复反应,是一个动态可逆的过程。阻断肝纤维化持续进展是防治肝病向肝硬化甚至肝细胞癌发展的重要策略。目前研究认为,肝星状细胞(HSCs)转化为活化的肌成纤维细胞(MFBs)是细胞外基质 (ECM)的主要来源,也是肝纤维化的主要驱动力[1]。除此之外,大量研究发现,肝巨噬细胞在肝纤维化过程中同样发挥重要作用。
1. 肝巨噬细胞
肝巨噬细胞是肝脏中一个高度异质的非实质细胞群,占肝脏细胞的10%~15%,主要由枯否细胞 (KCs) 和单核细胞衍生的各种浸润巨噬细胞 (MoMFs) 组成,具有显著异质性。巨噬细胞的异质性以多种来源、多种细胞类型特异性标志物和极化表型为特征。此外,肝巨噬细胞具有显著的可塑性,能够快速响应组织环境的变化,呈现不同的细胞表型。肝巨噬细胞被认为是肝脏抵御病原体的第一道防线,参与包括炎症反应、纤维化形成以及纤维化消退在内的肝纤维化所有阶段[2]。因此,肝内巨噬细胞是肝纤维化的核心调控者,肝纤维化治疗的重要靶细胞。
1.1 KCs
KCs是体内最大的常驻巨噬细胞群,包括卵黄囊来源的KCs和骨髓来源的KCs。KCs可以识别内源性细胞碎片和外源性病原体,感知肝脏损伤进而发生活化。因此,KCs对于肝脏稳态的维持、免疫反应的启动和肝损伤的恢复至关重要。
1.2 MoMFs
MoMFs充当免疫反应协调者并补充巨噬细胞群以维持肝脏中的稳态。在小鼠体内,MoMFs分为两个亚群:Ly6Chi和Ly6Clo单核细胞。Ly6Chi单核细胞参与炎症反应并产生促炎作用,而Ly6Clo单核细胞则具有组织修复功能。
2. 肝巨噬细胞在肝纤维化中的作用
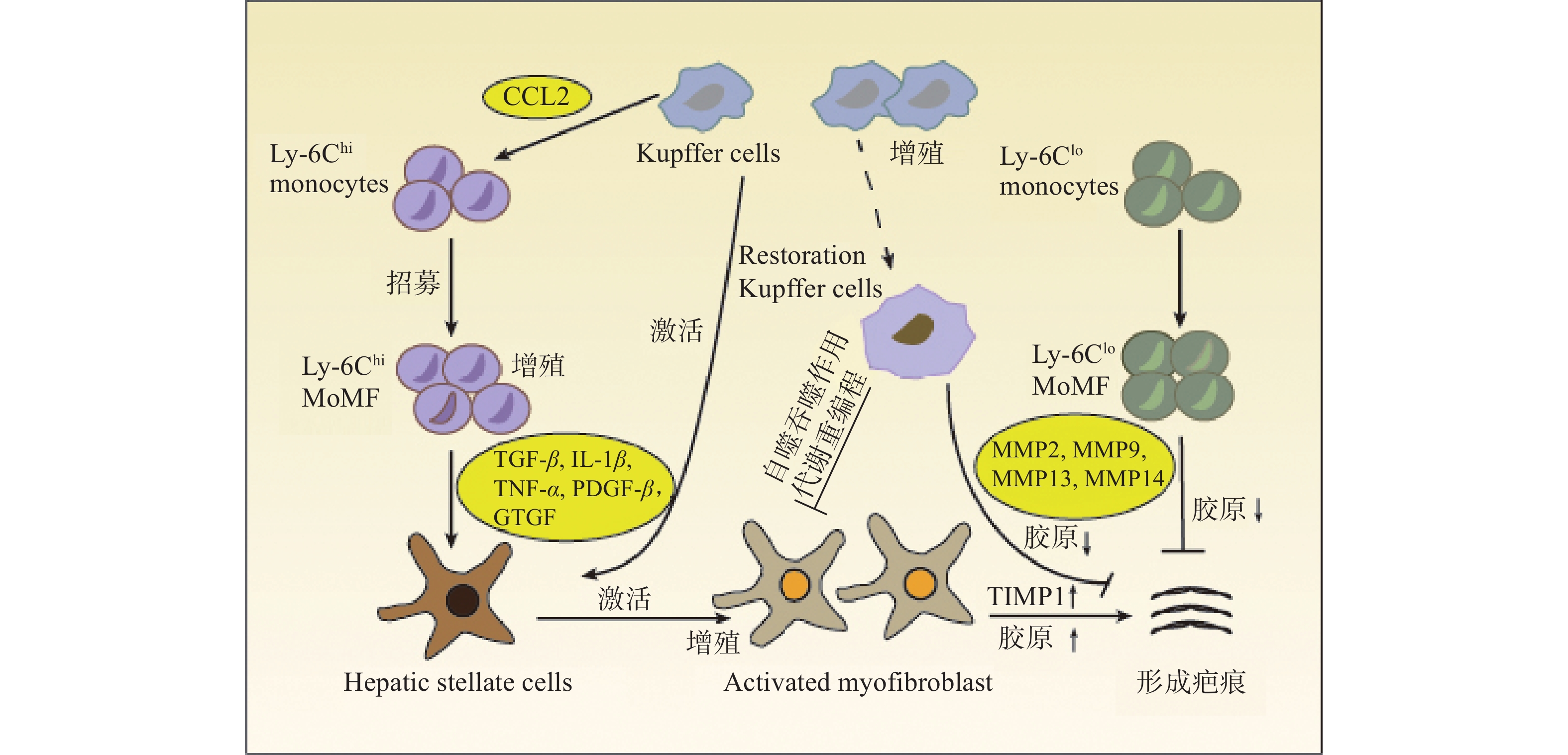
在肝损伤早期,损伤或死亡的肝细胞能够释放损伤相关分子模式 (DAMP),并与肝巨噬细胞相互作用,从而促进肝巨噬细胞的活化、极化和募集。活化的肝巨噬细胞能够分泌大量促炎因子和促纤维化细胞因子,参与炎症反应并促进HSCs的活化和纤维化应答[3](图1)。
2.1 肝巨噬细胞与HSCs的相互作用
HSCs位于肝细胞和肝窦内皮细胞之间的窦周间隙,在正常和受损的肝组织中具有不同的生理功能。正常的生理条件下,HSCs被称为静息的HSCs (qHSCs),负责储存肝脏中的维生素A。当肝损伤后,qHSCs被炎症介质激活,进而分化为 MFBs,分泌大量的ECM并产生纤维瘢痕,导致肝纤维化[4]。肝巨噬细胞能够与HSCs相互作用,重塑免疫微环境和ECM,该相互作用对于肝脏炎症应答和纤维化应答至关重要。
肝巨噬细胞能够分泌与HSCs活化有关的各种细胞因子和趋化因子,如转化生长因子β (TGF-β),肿瘤坏死因子α (TNF-α),白细胞介素1β (IL-1β) 和趋化因子配体2 (CCL2) 等。肝巨噬细胞产生的IL-1β和TNF-α能够激活NF-κB信号通路,增强MFBs的增殖[5]。激活素A (ACTA) 是TGF-β超家族成员之一,能够促进KCs中TNF-α和TGF-β1的表达,诱导HSCs转化为促纤维化表型,提高α-平滑肌肌动蛋白 (α-SMA) 表达水平和迁移能力[6]。此外,肝脏在受到丙型肝炎病毒 (HCV) 感染后,肝巨噬细胞能够分泌趋化因子配体5 (CCL5) ,引起HSCs中炎症小体和纤维化标志物α-SMA与TGF-β的激活[7]。
除细胞因子和趋化因子外,肝巨噬细胞还能够产生其他与HSCs串扰的分子。例如,MoMFs能够通过分泌颗粒蛋白激活qHSCs,促进其转化为MFBs,引起ECM的积累和肝纤维化的形成[8]。HMGB1是一种响应组织损伤而产生的DAMP,主要由肝细胞和KCs分泌,研究表明,HMGB1能够与HSCs中的晚期糖基化终末产物受体(RAGE)结合,激活pMEK1/2、pERK1/2和p-c-Jun通路,增加Ⅰ型胶原蛋白的沉积[9]。
此外,HSCs也可作用于肝巨噬细胞,影响其功能。紫藤凝集素阳性Mac-2结合蛋白 (WFA+-M2BP) 是一种肝纤维化的血清指示剂,可由HSCs分泌。据报道,WFA+-M2BP能够促进KCs表达M2BP,而KCs分泌的M2BP反过来又会进一步加强HSCs的激活。由此说明,在肝纤维化的发展过程中,巨噬细胞和HSCs之间存在正反馈调节[10]。
2.2 巨噬细胞极化
巨噬细胞具有显著的异质性,可以在不同的组织微环境中极化成不同的表型,从而发挥不同作用。通常,巨噬细胞极化的表型可以分为经典活化 (M1) 型和选择活化 (M2) 型。M2型可以进一步分为M2a、M2b、M2c和M2d亚型。
在被脂多糖 (LPS) 和干扰素-γ(IFN-γ) 刺激后,M1型巨噬细胞发生活化,分泌大量促炎细胞因子,如IL-1β、TNF-α、诱导型一氧化氮合酶 (iNOS) 等,从而发挥促炎作用。因此,M1型巨噬细胞在肝损伤起始阶段起重要作用,能够释放促炎因子,加剧炎症反应并促进肌成纤维细胞增殖,最终导致肝纤维化[11]。
M2型巨噬细胞的极化主要由白细胞介素4 (IL-4) 和白细胞介素13 (IL-13)等细胞因子诱导发生,能够分泌抗炎因子,如白细胞介素10 (IL-10) 、TGF-β、精氨酸酶1 (Arg-1) 等,具有抑制炎症、促进组织重塑、预防寄生虫感染以及调节免疫等生物学功能。在肝纤维化的发展过程中,M2型巨噬细胞产生抗炎作用,能够促进伤口的愈合和再生。然而,当肝损伤持续存在时,M2型巨噬细胞释放的TGF-β、血小板衍生生长因子 (PDGF) 、血管内皮生长因子 (VEGF) 等生长因子,会促进MFBs的增殖和活化,加重肝纤维化[12]。
调节巨噬细胞极化可以发挥抗肝纤维化作用。脯氨酸-丝氨酸-苏氨酸-磷酸酶相互作用蛋白2 (PSTPIP2) 能够调节STAT1和NF-κB信号通路,抑制M1型巨噬细胞极化,改善肝脏炎症和肝纤维化[13]。白细胞介素22 (IL-22) 能够调节STAT3、Erk、Akt信号通路的传导,促进巨噬细胞从M1型转变为M2型,从而减缓肝纤维化的进展[14]。
此外,肝巨噬细胞和其他细胞群之间的相互作用对肝巨噬细胞的表型转换也至关重要。自然杀伤 (NK) 细胞在调节巨噬细胞极化方面发挥关键作用,研究发现,DX5+NKp46+ NK细胞能够产生IFN-γ促进M1巨噬细胞极化,在预防非酒精性脂肪性肝炎 (NASH) 进展为肝纤维化方面发挥重要作用[15]。中性粒细胞 (PMN) 能够促进巨噬细胞转变为具有肝脏修复功能的巨噬细胞,有助于肝脏炎症和肝纤维化的自发消退[16]。
2.3 肝巨噬细胞的募集和浸润
肝巨噬细胞浸润与慢性炎症和肝纤维化密切相关。在趋化因子和相应受体的介导下,巨噬细胞能够募集到损伤部位,参与炎症和肝纤维化的发展。例如,Ly6Chi MoMFs能够依赖趋化因子受体2 (CCR2) 募集到肝损伤区域,发挥促炎和促纤维化作用。微蛋白 (PSMP) 是一种新型趋化因子,能够促进炎性巨噬细胞的浸润,分泌更多的促炎细胞因子,加剧肝纤维化应答[17]。骨髓细胞上表达的触发受体1 (TREM-1) 可促进KCs的募集和浸润以及促炎细胞因子的产生[18]。
阻碍肝巨噬细胞的浸润与募集有助于肝纤维化的消退。配对免疫球蛋白样2型受体α (PILRα) 是一种抑制性受体,主要在骨髓细胞中表达,在炎症过程中能够抑制肝巨噬细胞与PMN的浸润。研究证实,PILRα能够调节整合素信号传导,阻碍巨噬细胞迁移到受损的肝组织,从而减轻肝脏炎症并缓解肝纤维化[19]。
此外,研究还发现一种新的TREM2+ CD9+瘢痕相关巨噬细胞 (SAMacs) 亚群,其来源于MOMFs,在肝纤维化过程中表现出促纤维化表型[20],可能成为未来肝纤维化治疗的重要靶细胞。
2.4 肝巨噬细胞与肝细胞的相互作用
在肝纤维化进展中,肝细胞能够分泌一系列DAMP和细胞外囊泡 (EVs) ,可与肝巨噬细胞相互作用,诱导巨噬细胞转变为促炎表型。线粒体DNA (mtDNA) 是一种内源性DAMP,能够激活先天免疫反应[21]。肝细胞衍生的mtDNA能够激活NF-κB信号通路,诱导KCs分泌TNF-α和白细胞介素6 (IL-6) ,引起肝脏炎症和纤维化应答[22]。M1型巨噬细胞分泌的EVs能够激活肝细胞中NLRP3炎性体信号通路,而应激的肝细胞可分泌含有微小RNA-192-50 (miR-192-5p) 和血清CD40L配体 (CD40L) 的EVs,促进M1型巨噬细胞极化[23]。因此,肝细胞和巨噬细胞之间通过释放DAMP和EVs相互作用,促进了肝内炎症反应与肝纤维化进展。
2.5 肝巨噬细胞与代谢重编程
细胞代谢重编程是细胞为满足能量需求,通过改变代谢模式促进细胞增殖和生长的机制,包括糖代谢、脂代谢、氨基酸代谢等。
肝巨噬细胞的代谢重编程与巨噬细胞极化紧密联系,影响肝纤维化的进展和消退[24]。c-Rel是NF-κB转录因子家族成员之一,参与巨噬细胞代谢重编程。研究发现,c-Rel能够与6-磷酸果糖激酶-2的启动子结合,诱导巨噬细胞极化和HSCs活化,从而加重炎症反应与肝纤维化[25]。此外,肝脏中铁的代谢失调也与晚期肝纤维化有关。肝内铁的积累能够激活MiT/TFE转录因子,促进M1型巨噬细胞的活化,加重肝纤维化[26]。
膜联蛋白A5是膜联蛋白家族的成员之一,能够与M2型丙酮酸激酶(PKM2)相互作用,将肝巨噬细胞中的糖酵解转换为氧化磷酸化,促进巨噬细胞从M1型转换到M2型,从而改善炎症和肝纤维化[27]。因此,调节肝巨噬细胞的免疫代谢是肝纤维化的潜在治疗策略。
2.6 肝巨噬细胞自噬和吞噬作用
自噬是将机体中异常表达的蛋白质和受损的细胞器转移到溶酶体中进行降解,对细胞稳态的维持、细胞存活、分化和生长至关重要。大量研究证实,巨噬细胞自噬对肝脏具有保护作用。例如,KCs的自噬能够抑制细胞活性氧 (ROS) 介导的白细胞介素1α (IL-1α) 和IL-1β的分泌,从而缓解肝脏炎症和纤维化[28]。日本血吸虫卵抗原 (SEA) 诱导的巨噬细胞自噬能够抑制肝脏病理的发展[29]。白细胞介素7 (IL-7) 能够通过激活AMP活化蛋白激酶 (AMPK) 抑制SEA诱导的巨噬细胞自噬,促进炎症细胞对肝脏的浸润,增强MFBs活性,从而加重SEA感染引起的肝纤维化[30]。此外,LC3相关的吞噬作用 (LAP) 是一种非典型的自噬形式,能够将Ly6Chi MoMFs变为Ly6Clo MoMFs。研究表明,LAP可抑制全身炎症,发挥抗肝纤维化作用[31]。
吞噬作用是细胞摄取较大固体颗粒或大分子复合体的过程。肝巨噬细胞能够通过吞噬和清除肝脏中死亡的细胞调节肝脏炎症和纤维化。在肝损伤中,巨噬细胞能够吞噬坏死的肝细胞,诱导Wnt3a的表达并激活Wnt通路,从而促进肝再生。肝脏巨噬细胞的吞噬作用,减弱了受损肝细胞中线粒体衍生的DAMP的释放,从而抑制肝脏瘢痕的形成[32]。因此,调节肝巨噬细胞的自噬和吞噬功能可成为一种新的抗肝纤维化策略,值得进一步研究。
2.7 其他肝巨噬细胞在肝纤维化中的作用
除了KCs和MoMFs,其他浸润性巨噬细胞群也与肝纤维化有关。SOCS蛋白是巨噬细胞炎症活性的调节因子,在肝纤维化期间,脾巨噬细胞能够通过上调肝巨噬细胞中的SOCS3信号传导来促进CCL2的分泌,从而促进循环单核细胞的浸润,加剧肝纤维化的发展[33]。
2.8 其他机制
肝纤维化的发展与多种细胞和分子机制相关。除肝巨噬细胞外,HSCs、肝细胞、肝窦内皮细胞、胆管细胞和脾细胞也参与了肝纤维化的发展,这些细胞之间的相互作用,能够调控细胞内信号传导,从而影响肝纤维化进展和消退。此外,肝内肝窦的形成和重塑是肝纤维化的关键特征,抑制血管生成也能够减缓肝纤维化的进展。
3. 靶向肝巨噬细胞治疗肝纤维化
肝巨噬细胞在肝损伤、肝纤维化进展和消退中发挥双重作用。目前研究证实,多种药物能够通过调控肝巨噬细胞的功能发挥抗肝纤维化的作用。因此,基于巨噬细胞在肝纤维化中的作用,人们开发了相关的趋化因子抑制剂、细胞通路拮抗剂,期望为肝纤维化提供新的治疗策略。
3.1 临床前研究
3.1.1 巨噬细胞极化的调节
调节巨噬细胞极化可以治疗肝纤维化。例如,槲皮素能够调控Notch1通路,抑制M1型巨噬细胞极化,缓解炎症反应,从而抑制肝纤维化进展[34];壳寡糖能够通过调控JAK2/STAT1和JAK1/STAT6信号通路,抑制巨噬细胞极化为M1型,增加M2型巨噬细胞数量,从而发挥抗肝纤维化作用[35]。此外,研究还发现,在肝纤维化期间,脾切除能够激活ERK1/2信号通路,促进MOMFs转换为抗炎的Ly6CloMOMFs,从而减轻肝脏炎症和肝纤维化应答[36]。
3.1.2 抑制巨噬细胞的募集和浸润
抑制巨噬细胞募集和浸润有助于肝纤维化的消退。姜黄素能够通过抑制KCs的激活减少趋化因子分泌,降低Ly6ChiMOMFs的浸润,从而缓解肝纤维化[37]。鉴于CCL2/CCR2和CCL5/CCR5信号通路在巨噬细胞募集中的关键作用,人们研发出了相关的趋化因子受体拮抗剂,如CCR2拮抗剂RS102895、CCR2/CCR5双拮抗剂 (CVC) 。研究发现,在酒精性肝纤维化模型中,CVC能够明显抑制体内巨噬细胞的募集,展现出较好的的抗纤维化活性[38]。
3.1.3 诱导巨噬细胞自噬
巨噬细胞自噬是一种针对慢性肝损伤和纤维化的保护机制,通过诱导巨噬细胞自噬能够治疗肝纤维化。MJN110是一种单酰基甘油脂肪酶 (MAGL) 抑制剂,在CCl4和BDL诱导的肝纤维化模型中,MJN110的干预能够促使巨噬细胞自噬通量和自噬体生物合成增加、减少肝巨噬细胞数量,从而减缓肝纤维化进展,促进肝纤维化消退[39]。
3.2 临床研究
大多数基于肝巨噬细胞的疗法仅在肝纤维化的动物模型中进行了评估,而相关的临床研究数据较少。CVC是CCR2和CCR5双重拮抗剂,两项临床实验数据显示,CVC在伴有纤维化的NASH中具有显著的抗纤维化作用,并且耐受性良好[40]。此外,有研究人员在人体上进行了自体巨噬细胞治疗的安全性评估实验,结果表明,该疗法在肝硬化患者中是安全可行的,这为未来研究其在肝硬化和其他纤维化疾病中的疗效提供了依据[41]。
4. 结论与展望
肝纤维化是由各种病因所致慢性肝损伤的修复反应,其特征是ECM在肝内的过度沉积。鉴于肝巨噬细胞在调节肝纤维化反应中的关键作用,人们开发出了针对肝巨噬细胞治疗肝纤维化的新策略。基于抑制KCs活化的靶向疗法已被研究,这些疗法主要通过抑制细胞内炎症信号通路,如NF-κB、ASK1、JNK和p38等信号通路,从而治疗肝纤维化[42]。Loomba等人开发了Selonsertib,一种ASK1信号通路的抑制剂,研究证实,Selonsertib对肝细胞代谢和巨噬细胞活化有影响。在一项随机2期试验中,Selonsertib能够降低NASH和肝纤维化患者的肝脏中胶原蛋白含量和小叶炎症程度,并且能够改善肝细胞凋亡和坏死[43]。此外,肝纤维化治疗的重点是减少MoMFs向肝脏的募集。MoMFs向受损肝脏的募集依赖于活化的肝细胞分泌的几种趋化因子,如趋化因子配体1 (CCL1) ,CCL2,CCL5[44]。因此,调节趋化因子的信号传导也是一种治疗策略,这些疗法主要包括针对趋化因子或受体的单克隆抗体、阻止趋化因子结合的受体拮抗剂、适体分子和阻断趋化因子诱导的细胞内信号传导的小分子抑制剂等[5]。研究发现,使用CCR2敲除能够减弱小鼠MoMFs募集,抑制MFBs活化并减轻肝纤维化[45]。此外,MoMFs可分为导致肝脏损伤的Ly6Chi MOMFs和具有肝脏修复功能的Ly6Clo MOMFs。因此,另一种潜在的策略是通过将Ly6Chi MOMFs转换为Ly6Clo MOMFs来恢复正常的肝功能。研究证实,在CCl4诱导的肝纤维化模型和MCD饮食诱导的NASH模型中,CCL2抑制剂mNOX-E36能够抑制Ly6Chi MOMFs的早期流入,同时能够将Ly6Chi MOMFs转换为Ly6Clo MOMFs,促进肝纤维化的消退[46]。
尽管肝巨噬细胞在肝纤维化发病机制中的作用机制和相关治疗策略已经取得了突破性进展,然而,通过巨噬细胞靶向肝纤维化疗法仍然存在局限性。需要解决的问题如下:肝巨噬细胞的这些表型其临床意义是什么,是否有可能对肝巨噬细胞进行基因改造以解决肝纤维化,如何达到只靶向致病表型而不破坏正常的生理表型?此外,大多数关于肝巨噬细胞的作用和潜在机制的研究都是在啮齿动物模型中进行的,由于啮齿动物和人类之间的肝巨噬细胞存有差异,这些发现与人类的相关性仍需要进一步研究。
-
[1] YUAN D P, LONG J, LU Y, et al. The forecast of anticancer targets of cryptotanshinone based on reverse pharmacophore-based screening technology[J]. Chin J Nat Med,2014,12(6):443-448. [2] CHEN L, ZHENG S Z, SUN Z G, et al. Cryptotanshinone has diverse effects on cell cycle events in melanoma cell lines with different metastatic capacity[J]. Cancer Chemother Pharmacol,2011,68(1):17-27. doi: 10.1007/s00280-010-1440-8 [3] PARK I J, YANG W K, NAM S H, et al. Cryptotanshinone induces G1 cell cycle arrest and autophagic cell death by activating the AMP-activated protein kinase signal pathway in HepG2 hepatoma[J]. Apoptosis,2014,19(4):615-628. doi: 10.1007/s10495-013-0929-0 [4] JI Y B, LIU Y C, XUE N N, et al. Cryptotanshinone inhibits esophageal squamous-cell carcinoma in vitro and in vivo through the suppression of STAT3 activation[J]. Onco Targets Ther,2019,12:883-896. doi: 10.2147/OTT.S187777 [5] WU Y H, WU Y R, LI B, et al. Cryptotanshinone: a review of its pharmacology activities and molecular mechanisms[J]. Fitoterapia,2020,145:104633. doi: 10.1016/j.fitote.2020.104633 [6] LI H Y, GAO C D, LIU C, et al. A review of the biological activity and pharmacology of cryptotanshinone, an important active constituent in Danshen[J]. Biomed Pharmacother,2021,137:111332. doi: 10.1016/j.biopha.2021.111332 [7] JIANG G Q, LIU J, REN B Y, et al. Anti-tumor and chemosensitization effects of Cryptotanshinone extracted from Salvia miltiorrhiza Bge. on ovarian cancer cells in vitro[J]. J Ethnopharmacol,2017,205:33-40. doi: 10.1016/j.jep.2017.04.026 [8] MAN Y H, YANG L, ZHANG D X, et al. Cryptotanshinone inhibits lung tumor growth by increasing CD4+ T cell cytotoxicity through activation of the JAK2/STAT4 pathway[J]. Oncol Lett,2016,12(5):4094-4098. doi: 10.3892/ol.2016.5123 [9] LIU S, HAN Z, TRIVETT A L, et al. Cryptotanshinone has curative dual anti-proliferative and immunotherapeutic effects on mouse Lewis lung carcinoma[J]. Cancer Immunol Immunother,2019,68(7):1059-1071. doi: 10.1007/s00262-019-02326-8 [10] HAN Z, LIU S, LIN H S, et al. Inhibition of murine hepatoma tumor growth by cryptotanshinone involves TLR7-dependent activation of macrophages and induction of adaptive antitumor immune defenses[J]. Cancer Immunol Immunother,2019,68(7):1073-1085. doi: 10.1007/s00262-019-02338-4 [11] DONG B W, LIANG Z R, CHEN Z R, et al. Cryptotanshinone suppresses key onco-proliferative and drug-resistant pathways of chronic myeloid leukemia by targeting STAT5 and STAT3 phosphorylation[J]. Sci China Life Sci,2018,61(9):999-1009. doi: 10.1007/s11427-018-9324-y [12] XIA C, BAI X P, HOU X Y, et al. Cryptotanshinone reverses cisplatin resistance of human lung carcinoma A549 cells through down-regulating Nrf2 pathway[J]. Cell Physiol Biochem,2015,37(2):816-824. doi: 10.1159/000430398 [13] HU T, TO K K, WANG L, et al. Reversal of P-glycoprotein (P-gp) mediated multidrug resistance in colon cancer cells by cryptotanshinone and dihydrotanshinone of Salvia miltior-rhiza[J]. Phytomedicine,2014,21(11):1264-1272. doi: 10.1016/j.phymed.2014.06.013 [14] WANG Y, LU H L, LIU Y D, et al. Cryptotanshinone sensitizes antitumor effect of paclitaxel on tongue squamous cell carcinoma growth by inhibiting the JAK/STAT3 signaling pathway[J]. Biomed Pharmacother,2017,95:1388-1396. doi: 10.1016/j.biopha.2017.09.062 [15] XU Z Y, JIANG H, ZHU Y H, et al. Cryptotanshinone induces ROS-dependent autophagy in multidrug-resistant colon cancer cells[J]. Chem Biol Interact,2017,273:48-55. doi: 10.1016/j.cbi.2017.06.003 [16] HAO W H, ZHANG X N, ZHAO W W, et al. Cryptotanshinone induces pro-death autophagy through JNK signaling mediated by reactive oxygen species generation in lung cancer cells[J]. Anticancer Agents Med Chem,2016,16(5):593-600. doi: 10.2174/1871520615666150907093036 [17] ZOU S L, TONG Q Y, LIU B W, et al. Targeting STAT3 in cancer immunotherapy[J]. Mol Cancer,2020,19(1):145. doi: 10.1186/s12943-020-01258-7 [18] SHIN D S, KIM H N, SHIN K D, et al. Cryptotanshinone inhibits constitutive signal transducer and activator of transcription 3 function through blocking the dimerization in DU145 prostate cancer cells[J]. Cancer Res,2009,69(1):193-202. doi: 10.1158/0008-5472.CAN-08-2575 [19] CHEN L D, LV D Y, CHEN X F, et al. Biosensor-based active ingredients recognition system for screening STAT3 ligands from medical herbs[J]. Anal Chem,2018,90(15):8936-8945. doi: 10.1021/acs.analchem.8b01103 [20] BLASIUS R, REUTER S, HENRY E, et al. Curcumin regulates signal transducer and activator of transcription (STAT) expression in K562 cells[J]. Biochem Pharmacol,2006,72(11):1547-1554. doi: 10.1016/j.bcp.2006.07.029 [21] GE Y Q, YANG B, CHEN Z, et al. Cryptotanshinone suppresses the proliferation and induces the apoptosis of pancreatic cancer cells via the STAT3 signaling pathway[J]. Mol Med Rep,2015,12(5):7782-7788. doi: 10.3892/mmr.2015.4379 [22] YANG Y F, CAO Y, CHEN L H, et al. Cryptotanshinone suppresses cell proliferation and glucose metabolism via STAT3/SIRT3 signaling pathway in ovarian cancer cells[J]. Cancer Med,2018,7(9):4610-4618. doi: 10.1002/cam4.1691 [23] YUAN X R, BU H, ZHOU J P, et al. Recent advances of SHP2 inhibitors in cancer therapy: current development and clinical application[J]. J Med Chem,2020,63(20):11368-11396. doi: 10.1021/acs.jmedchem.0c00249 [24] YU B, LIU W, YU W M, et al. Targeting protein tyrosine phosphatase SHP2 for the treatment of PTPN11-associated malignancies[J]. Mol Cancer Ther,2013,12(9):1738-1748. doi: 10.1158/1535-7163.MCT-13-0049-T [25] LIU W, YU B, XU G, et al. Identification of cryptotanshinone as an inhibitor of oncogenic protein tyrosine phosphatase SHP2 (PTPN11)[J]. J Med Chem,2013,56(18):7212-7221. doi: 10.1021/jm400474r [26] LU L, ZHANG S L, LI C X, et al. Cryptotanshinone inhibits human glioma cell proliferation in vitro and in vivo through SHP-2-dependent inhibition of STAT3 activation[J]. Cell Death Dis,2017,8(5):e2767. doi: 10.1038/cddis.2017.174 [27] HECK M M, EARNSHAW W C. Topoisomerase II: a specific marker for cell proliferation[J]. J Cell Biol,1986,103(6):2569-2581. doi: 10.1083/jcb.103.6.2569 [28] KIM E J, KIM S Y, KIM S M, et al. A novel topoisomerase 2a inhibitor, cryptotanshinone, suppresses the growth of PC3 cells without apparent cytotoxicity[J]. Toxicol Appl Pharmacol,2017,330:84-92. doi: 10.1016/j.taap.2017.07.007 [29] MOLONEY J N, COTTER T G. ROS signalling in the biology of cancer[J]. Semin Cell Dev Biol,2018,80:50-64. doi: 10.1016/j.semcdb.2017.05.023 [30] LIU C, SUN H N, LUO Y H, et al. Cryptotanshinone induces ROS-mediated apoptosis in human gastric cancer cells[J]. Oncotarget,2017,8(70):115398-115412. doi: 10.18632/oncotarget.23267 [31] YE T H, ZHU S R, ZHU Y X, et al. Cryptotanshinone induces melanoma cancer cells apoptosis via ROS-mitochondrial apoptotic pathway and impairs cell migration and invasion[J]. Biomed Pharmacother,2016,82:319-326. doi: 10.1016/j.biopha.2016.05.015 [32] CHEN W X, LIU L, LUO Y, et al. Cryptotanshinone activates p38/JNK and inhibits Erk1/2 leading to caspase-independent cell death in tumor cells[J]. Cancer Prev Res (Phila),2012,5(5):778-787. doi: 10.1158/1940-6207.CAPR-11-0551 [33] PARK I J, KIM M J, PARK O J, et al. Cryptotanshinone induces ER stress-mediated apoptosis in HepG2 and MCF7 cells[J]. Apoptosis,2012,17(3):248-257. doi: 10.1007/s10495-011-0680-3 [34] WU C Y, HSIEH C Y, HUANG K E, et al. Cryptotanshinone down-regulates androgen receptor signaling by modulating lysine-specific demethylase 1 function[J]. Int J Cancer,2012,131(6):1423-1434. doi: 10.1002/ijc.27343 [35] XU D F, LIN T H, LI S S, et al. Cryptotanshinone suppresses androgen receptor-mediated growth in androgen dependent and castration resistant prostate cancer cells[J]. Cancer Lett,2012,316(1):11-22. doi: 10.1016/j.canlet.2011.10.006 [36] PAN Y H, SHI J F, NI W T, et al. Cryptotanshinone inhibition of mammalian target of rapamycin pathway is dependent on oestrogen receptor alpha in breast cancer[J]. J Cell Mol Med,2017,21(9):2129-2139. doi: 10.1111/jcmm.13135 [37] LI S H, WANG H T, HONG L, et al. Cryptotanshinone inhibits breast cancer cell growth by suppressing estrogen receptor signaling[J]. Cancer Biol Ther,2015,16(1):176-184. doi: 10.4161/15384047.2014.962960 [38] KIM S A, KANG O H, KWON D Y. Cryptotanshinone induces cell cycle arrest and apoptosis of NSCLC cells through the PI3K/Akt/GSK-3β pathway[J]. Int J Mol Sci,2018,19(9):2739. doi: 10.3390/ijms19092739 [39] YE Y T, ZHONG W, SUN P, et al. Apoptosis induced by the methanol extract of Salvia miltiorrhiza Bunge in non-small cell lung cancer through PTEN-mediated inhibition of PI3K/Akt pathway[J]. J Ethnopharmacol,2017,200:107-116. doi: 10.1016/j.jep.2016.12.051 [40] ZHANG J T, WEN G L, SUN L H, et al. Cryptotanshinone inhibits cellular proliferation of human lung cancer cells through downregulation ofIGF-1R/PI3K/Akt signaling pathway[J]. Oncol Rep,2018,40(5):2926-2934. [41] ZHANG L, CHEN C, DUANMU J X, et a. Cryptotanshinone inhibits the growth and invasion of colon cancer by suppressing inflammation and tumor angiogenesis through modulating MMP/TIMP system, PI3K/Akt/mTOR signaling and HIF-1α nuclear translocation[J]. Int Immunopharmacol,2018,65:429-437. doi: 10.1016/j.intimp.2018.10.035 [42] KE F Y, WANG Z, SONG X L, et al. Cryptotanshinone induces cell cycle arrest and apoptosis through the JAK2/STAT3 and PI3K/Akt/NFκB pathways in cholangiocarcinoma cells[J]. Drug Des Devel Ther,2017,11:1753-1766. doi: 10.2147/DDDT.S132488 [43] ZHANG J, HUANG M, GUAN S, et al. A mechanistic study of the intestinal absorption of cryptotanshinone, the major active constituent of Salvia miltiorrhiza[J]. J Pharmacol Exp Ther,2006,317(3):1285-1294. doi: 10.1124/jpet.105.100701 [44] 刘航. 隐丹参酮衍生物的设计, 合成及其对STAT3转录活性的影响[D]. 福州: 福建中医药大学, 2021. [45] WANG H, LIU Z, GUAN L N, et al. LYW-6, a novel cryptotanshinone derived STAT3 targeting inhibitor, suppres-ses colorectal cancer growth and metastasis[J]. Pharmacol Res,2020,153:104661. doi: 10.1016/j.phrs.2020.104661 [46] XU D F, LIN T H, ZHANG C X, et al. The selective inhibitory effect of a synthetic tanshinone derivative on prostate cancer cells[J]. Prostate,2012,72(7):803-816. doi: 10.1002/pros.21474 -

 点击查看大图
点击查看大图
计量
- 文章访问数: 5618
- HTML全文浏览量: 3227
- PDF下载量: 29
- 被引次数: 0




 下载:
下载:

 下载:
下载:
