-
心衰(HF)是一种复杂的临床综合征,因心脏结构或功能性疾病导致心室充盈或射血功能降低,并伴有全身健康受损和高病死率。全球有超过3 770万HF患者,近50%的HF患者在确诊5年内死亡,病死率超过了多种癌症。据美国心脏病协会(AHA)最新发布的数据显示,预计到2030年,HF发病率将进一步增加到46%[1]。
长期以来,天然中草药一直用于治疗HF且效果显著。天然药物及其活性化合物的多通路、多靶点的优势可避免当前西药疗法靶点单一引起的多种代偿性不良反应,以及药物代谢导致的药理作用减弱等问题[2],特别是副作用也明显减少。中药治疗的副作用为4.08%,西药治疗的副作用为9.81%[3]。然而,由于中药成分复杂多样,其临床作用机制、药动学和治疗靶点尚未得到充分研究,且目前探索天然药物单一生物活性成分来治疗心血管疾病并验证其药理作用和治疗靶点也是一大研究热点。因此,本文对数据挖掘的前5名抗HF天然药物及其活性成分进行综述,旨在为进一步研究开发抗HF天然药物提供参考依据。
-
为选出临床常用中药,我们对国家专利数据库中治疗HF的中药复方专利进行挖掘分析。登录国家知识产权局中国专利公布公告网站(中国专利公布公告 cnipa.gov.cn),在“中国专利公布公告”的“高级查询”界面勾选“发明公布”与“发明授权”,分别将“心力衰竭和中药”作为“名称”项目进行检索,检索时间为2023年2月。本研究纳入的116项中药复方专利中,中药复方组成的药物最多有50味中药,最少有2味中药,共有418味中药。运用频次统计分析发现,出现频次最高的药物是黄芪(55次)。频次≥10的中药见表1。
表 1 中国专利数据库中治疗HF的高频次中药
药名 频次 药名 频次 药名 频次 黄芪 55 白术 21 三七 12 丹参 40 当归 21 干姜 11 茯苓 40 麦冬 21 鸡血藤 11 附子 38 甘草 20 桃仁 11 人参 31 泽泻 19 猪苓 11 葶苈子 28 红参 16 红花 10 桂枝 28 党参 15 肉桂 10 川芎 23 五味子 15 益母草 10 -
黄芪作为常用中药,记载具有滋补、保肝、利尿和祛痰的特性。截至2023年,已从黄芪中分离鉴定出100多种化合物,包括皂苷、黄酮、多糖和氨基酸等[4, 5],其中的皂苷、黄酮和多糖被认为是黄芪的主要生物活性成分。目前市场中流行的含黄芪类药物主要有黄芪生脉颗粒、益心通脉颗粒、脑心通脉胶囊等,黄芪注射液在临床上已被用于治疗病毒性心肌炎和心功能不全。现代药理学研究表明,黄芪具有改善心脏功能、促进血管生成[6]、降血糖、抗炎、调节免疫活性[7]等药理作用。
-
心肌缺血再灌注损伤(MI/R)是心肌损伤(尤其是心肌梗死)中常见的病理生理学特征,在缺氧心脏组织中发生细胞损伤,并在恢复供氧后加重[8]。预给药黄芪甲苷(AS-Ⅳ)可显著降低MI/R大鼠模型中心肌梗死大小、肌酸激酶-MB(CK-MB)产生、血清心肌肌钙蛋白(cTnI)水平和心肌细胞凋亡。该机制涉及钙敏感受体(CaSR)表达的下调和ERK1/2磷酸化的上调[9]。血管生成涉及到细胞外基质重塑、内皮细胞增殖、迁移和组装成毛细血管结构的过程[10]。研究发现,在结扎左冠状动脉以诱导HF大鼠模型中,AS-Ⅳ显著增加了缺血性心脏中的血管密度、CD31和血管内皮生长因子(VEGF)表达,表明AS-Ⅳ可以通过促进血管生成来缓解HF,这可能是通过JAK-STAT信号通路发挥心脏保护作用的[11]。NF-κB是多种炎性细胞因子的常见转录因子,有研究报道,AS-Ⅳ对炎症有很强的拮抗作用。在脂多糖(LPS)诱导的HF小鼠中,AS-Ⅳ可使NF-кB信号传导失活并激活PI3K/AKT通路,导致血清炎症介质TNF-α、单核细胞化学引诱蛋白-1(MCP-1)、IL-6、IL-1β等显著降低,最终改善心脏功能[12]。
-
环黄芪醇(CAG)是AS-Ⅳ经历肠道细菌生物转化后的主要代谢物,并且比AS-Ⅳ更容易吸收以达到体循环[13]。研究表明,其具有抗炎、抗菌和抑制纤维化的作用[14, 15]。心脏纤维化是许多心血管疾病的共同特征,NLRP3炎症小体信号传导及其下游细胞因子反应在心脏纤维化中起重要作用[16]。有研究表明,在异丙肾上腺素(ISO)诱导的HF中,CAG通过抑制NLRP3炎症小体表达,降低NLRP3、IL-1和IL-18的分泌,有效改善心脏纤维化[12],从而发挥对心脏的保护作用。同时,在ISO诱导的大鼠HF模型中,环黄芪醇可通过下调AKT1-RPS6KB1信号通路,增强心肌细胞自噬,抑制基质金属蛋白酶(MMPs)表达,改善心脏重塑[17]。以上研究表明,环黄芪醇可能成为充血性心力衰竭患者的候选药物。
-
毛蕊异黄酮(Calycosin)是黄芪中黄酮类化合物成分之一。研究证实,毛蕊异黄酮具有多种生物学效应,如抗氧化、抗凋亡、抗炎、促血管生成等[18]。毛蕊异黄酮能通过多种机制对不同原因造成的心肌细胞损伤发挥抗损伤作用。例如,毛蕊异黄酮及其衍生物可以显著降低丙二醛的水平,同时增加超氧化物歧化酶的水平,以保护心肌细胞免受氧化应激。在另一项研究中,首次证明毛蕊异黄酮通过调节自噬和抗NLRP3介导的焦亡抑制多柔比星诱导的心脏毒性来保护小鼠心肌细胞,从而减轻斑马鱼模型中阿霉素诱导的心脏毒性[19]。最近的研究表明,毛蕊异黄酮可以有效减轻异丙肾上腺素诱导的小鼠和大鼠心功能障碍,并通过抑制转化生长因子-β受体信号通路(TGFBR1)抑制TGF-β1诱导的心脏成纤维(CFs)增殖和胶原蛋白沉积, 减轻小鼠体内MI后的心肌纤维化和心功能障碍[20]。虽然目前针对毛蕊异黄酮对心血管的作用研究较多,但其作用机制还需要进一步系统研究。
-
茯苓最早记载于中国古代医学杰作《神农本草经》中[21],具有渗湿利水,益脾和胃,宁心安神的功效。在临床中,茯苓四逆汤、真武汤、桂枝茯苓丸常用于治疗慢性HF。茯苓的化学成分主要为萜类、甾醇类、多糖类以及其他类化合物,其中研究最多的是三萜和多糖类化合物[22]。现代药理学研究表明,茯苓可有效提高心肌收缩力,具有利尿、抗氧化、抗炎等多种功效[23]。
-
茯苓多糖(PCP)占干菌核重量的70%~90%,具有抗炎、降血脂、抗肿瘤、抗衰老和抗氧化特性[21]。活性氧(ROS)在细胞稳态中起着关键作用。在心脏中,过量的ROS可导致适应不良心肌重塑和心力衰竭的发生[24]。研究表明,在补充茯苓多糖7周后,小鼠的血清抗氧化酶(SOD、CAT、GPx)活性差异有统计学意义,显示茯苓多糖可显著增强血清抗氧化酶活性[25],从而发挥对心脏的保护作用。同时,用茯苓多糖处理小鼠巨噬细胞系RAW264.7细胞,可发现细胞中的NO释放和细胞因子分泌增加,提示茯苓多糖可通过诱导iNOS基因表达刺激巨噬细胞产生NO发挥血管扩张和抗炎作用[26],其机制与NF-κB/Rel通路有关。在与其他药物合用时,可发挥对HF的防治作用。
-
茯苓酸(PA)是一种羊毛甾烷型三萜类化合物,具有抗炎、抗氧化和抗凋亡等多种药理作用[27]。炎症是心血管疾病的病理基础,已有学者证明,茯苓酸可降低LPS诱导的炎症反应,减少LPS刺激下H9C2细胞中IL-1、IL-6和TNF-α等炎症因子的表达,并通过H9C2细胞中的ERK1/2和p38途径抑制LPS诱导的心肌细胞炎症和细胞凋亡,从而发挥心脏的保护作用[28]。血脂异常会导致多种心血管疾病,研究表明,茯苓酸可诱导葡萄糖转运蛋白4型(GLUT4)表达,通过上调胰岛素非依赖性AMPK和胰岛素受体底物-1-PI3K-AKT途径,刺激GLUT4从细胞内囊泡重新分布到质膜,并诱导甘油三酯积累[29],从而发挥对血脂的正向调节作用。
-
附子在分类学上属于毛茛科乌头属,《中华人民共国药典》2020年版(以下简称《中国药典》)收载的乌头类药材有川乌、制川乌、附子、草乌、制草乌、草乌叶等。目前上市的含附子类药物主要有参附注射液、芪苈强心胶囊等。其主要生物活性成分为总生物碱和多糖,但因多糖结构复杂、难以纯化,目前仅对粗多糖有相关药理研究。现代药理学研究表明,附子具有抑制心肌纤维化、细胞凋亡和自噬、改善线粒体能量代谢等功能,涉及RAAS系统、PI3K/AKT、JAK/STAT、AMPK/mTOR等多条信号通路[30]。此外,乌头碱是附子的主要生物活性部分,具有治疗和毒性双重作用。
-
附子多糖(FPS)是一种水溶性多糖,具有抗氧化、抑制细胞凋亡和增强自噬活性的作用。在一项早期研究中,发现FPS不仅可以通过其抗氧化作用减少肝缺血再灌注损伤,而且在心肌细胞中也显示出相同的保护作用[31]。在体外心肌缺血再灌注损伤细胞模型中,FPS通过增强锰超氧化物歧化酶(Mn SOD)活性和基因表达来抑制细胞凋亡,促进抗凋亡基因Bcl-2的表达,并清除线粒体产生的过量氧自由基[32]。深入研究表明,FPS的抗氧化自由基生成作用可以拮抗钙过载,降低细胞内钙离子浓度,减少心肌细胞凋亡[31]。在其抗凋亡机制的研究中,发现FPS可以诱导信号转导器和转录因子-3(STAT3)激活剂的磷酸化,STAT3是JAK-STAT通路的底物,可以促进Bcl-2表达,发挥心脏保护作用[33]。尽管FPS具有心脏保护作用,但有研究结果显示,FPS和附子提取物的总生物碱相比,FPS的治疗效果最弱,这表明生物碱成分在心脏保护作用中更为重要[34]。但这并不意味着FPS没有研究价值,与具有毒性作用的生物碱相比,FPS没有明显的心脏和胚胎毒性,优于其他成分,更具有研发价值。
-
乌头碱是乌头属植物的主要毒性成分,也是一种重要的活性物质,具有强心作用,可用于治疗充血性心力衰竭、心源性休克等心血管疾病。在服用高浓度乌头碱类药物时,会导致严重的心脏和中枢系统的不良反应,其中,室性快速心律失常和心脏骤停是主要致死原因[35]。但是,在大鼠静脉注射极低剂量(0.01 mg/kg)的乌头碱时,可通过增加LVSP、MBP和LVEDP显著改善心功能[36]。一些学者认为,乌头碱可能与强心苷类似,是通过延长动作电位中Na+内流而引起正性肌力作用。HF患者口服乌头碱后,被血液吸收较少,与心肌细胞膜的亲和力较低,在心脏组织中的剂量远小于治疗窗口[37]。而乌头碱的强心作用也仅在相对较低的水平上被观察到,可能正是由于这一原因,高浓度乌头碱诱发的心律失常掩盖了低浓度的正性肌力作用。虽然乌头碱具有很强的毒性,但低剂量的乌头碱也常在医疗紧急情况下被用作强心药物,这些发现提示了虽然乌头碱存在毒性,但在强心和治疗心律失常方面依然具有很高的利用价值。
-
去甲乌药碱是提取于附子的增强心脏功能的水溶性生物碱中主要生物活性成分,其强心作用主要表现为抗心脏肥大、抗纤维化、改善血流动力学和减少细胞凋亡。早期研究发现,在大鼠经历缺血再灌注损伤之前给予去甲乌药碱显著降低了细胞色素C的释放和半胱天冬酶-3(caspase-3)活性和Bax表达,并上调了Bcl-2表达。进一步的深入研究表明,去甲乌药碱通过激活β2-肾上腺素能受体(β2-AR)来拮抗大鼠心肌细胞的细胞凋亡并防止缺血/再灌注诱导的心肌梗死,并发现β2-AR/PI3K/AKT级联的激活是其抗凋亡作用的关键途径[38]。线粒体功能异常和细胞代谢紊乱影响心肌收缩功能障碍和左心室重塑[39]。LKB1/AMPK/Sirt1是阿霉素诱导的心肌损伤的重要靶标。据报道,去甲乌药碱和6-姜辣素的组合可促进LKB1、AMPKα1和Sirt1的mRNA和蛋白质的表达,从而减轻心肌线粒体能量代谢的紊乱[40]。这提示去甲乌药碱作为一种低毒的化学成分可以进一步对其开发利用。
-
丹参为唇形科的丹参属,根据中医理论,丹参味苦、性微寒,具有活血祛瘀、通经止痛、清心除烦、凉血消痈之功效。目前,含丹参制剂已广泛应用于临床治疗。如复方丹参片用于治疗心绞痛引起的胸痛,冠心丹参胶囊、复方丹参滴丸对气滞血瘀型胸痹证有较好疗效。丹参的化学成分主要可分为二萜类和酚酸类两大类。现代药理学研究表明,丹参具有改善微循环、舒张冠状动脉血管、抑制血栓素形成、抑制血小板黏附和聚集、防止心肌缺血等作用[41]。
-
丹参酮Ⅱa是在心血管领域中研究最充分的生物活性成分之一,可以通过多种机制控制心血管疾病的发展,包括抗炎、抗氧化应激、抗细胞凋亡、抗血管生成[42]等。研究表明,丹参酮Ⅱa通过抑制ERK的活化来抑制血管平滑肌细胞(VSMC)的增殖和迁移,同时激活BKCa、AMPK和Nrf2途径来减少斑块形成,降低心梗发病概率[43]。心肌的缺血/再灌注(I/R)时触发ROS的突然增加,丹参酮Ⅱa抑制NF-κB的活化,最终减弱炎症介质MCP1、TGF-β1和TNFα的表达,并阻止巨噬细胞浸润到梗死的心肌中[44]。此外,丹参酮Ⅱa可减弱NOD样受体(NLR)家族的形成,该家族含有NOD样受体热蛋白结构域蛋白3(NLRP3)炎症小体的pyrin结构域,该结构已被确定为MI炎症反应的介质[45],并随后预防下游炎症级联和脂质代谢紊乱。
-
隐丹参酮已被报道在体外和体内各种神经退行性疾病模型中均有神经保护作用,近来,在心血管疾病中的作用也得到了较高的认可。有研究表明,在主动脉结扎诱导的急性心肌梗死实验模型中,隐丹参酮剂量依赖性地改善了心肌组织排列紊乱和炎症细胞积聚[46]。在闭塞冠状动脉左前降支所致大鼠心肌I/R损伤模型中,隐丹参酮预处理可以抑制TNF-α诱导的人脐静脉内皮细胞(HUVEC)中黏附分子的表达,显著缩小梗死面积,改善心肌收缩功能障碍[47]。最近的一项研究表明,隐丹参酮通过促进线粒体生物发生和ATP生成以及抑制自由基的产生来改善心肌细胞线粒体功能[48],同时有学者研究了隐丹参酮抗心肌纤维化的作用。其机制主要与抑制MMP-2产生和NADPH氧化依赖的ROS产生有关[49]。这些观察可以部分解释隐丹参酮对心肌梗死和心肌I/R损伤的保护作用,但其治疗心脏病的机制还有待进一步阐明。
-
丹酚酸B为丹参提取物中主要的亲水成分,目前已有丹参多酚酸盐应用于临床。其可对心肌缺血损伤和病理性心脏重塑产生保护作用,主要包括减少相关炎症因子的表达,抑制细胞凋亡和减轻氧化应激。据报道,丹酚酸B通过缓解氧化应激、减少钙过载、改善内皮功能、稳定线粒体膜电位和上调 microRNA-30a发挥对心肌I/R损伤的保护作用[50]。同时,丹酚酸B参与PI3K/Akt信号通路的激活并抑制HMGB1表达,从而改善心功能不全,减少心肌酶释放,减小梗死面积[51]。细胞间黏附减少会增加内皮通透性,一项研究表明,在TNF-α减弱细胞连接蛋白(如VE-cadherin 和 β-catenin)的酪氨酸磷酸化时,丹酚酸B可减少TNF-α介导的内皮细胞连接紊乱[52]。以上研究表明,丹酚酸B在心脏保护方面具有极大潜力。
-
人参是五加科植物人参属的干燥根及根茎,应用历史悠久,具有回阳救逆、益气生津、补肾养血、安神明目之功效。在衰老、癌症、心血管系统疾病、糖尿病、免疫缺陷等方面都有广泛应用。其中含有的化学成分主要包括人参皂苷、多糖、多肽、糖缀合化合物和其他化合物等,在心血管疾病中发挥重要作用 [53]。
-
人参皂苷Rb1是从人参的根部提取的活性成分之一,具有广泛的心脏保护作用,其在减少心肌梗死面积、缓解心肌细胞水肿和抑制心脏毒性方面具有明显效果。人参皂苷Rb1对I/R诱导的心肌细胞损伤导致的细胞凋亡、氧化应激、炎症和能量代谢均有调节作用。采用小鼠HF模型对Rb1的心脏保护作用进行评价,结果显示,人参皂苷Rb1处理可显著降低乳酸脱氢酶(LDH)和CK水平,显著减少心脏梗死面积,这与激活Akt,磷酸化GSK-3β和抑制mPTP开放有关[54]。磷脂酰肌醇3激酶(PI3K)信号通路相关蛋白家族参与细胞增殖、分化、凋亡、葡萄糖转运和其他细胞功能的调节。人参皂苷Rb1可以通过增加磷酸化蛋白激酶B(Akt)的表达来激活PI3Ks信号通路,以减少细胞凋亡[55]。先前的一项研究表明,人参皂苷Rb1可以下调细胞凋亡相关蛋白Bax和Bcl-2的比例,以及裂解的caspase-3的表达。从而减少I/R引起的细胞凋亡,降低小鼠心肌损伤[54]。上述研究表明,人参皂苷Rb1在预防和治疗心肌I/R中的作用主要涉及通过增加PI3K/Akt信号传导和减少caspase家族等细胞凋亡相关因子来减少细胞凋亡,是一种潜在的能改善心肌微环境,发挥心肌保护作用的天然活性化合物。
-
人参多糖是人参的主要成分之一,由人参淀粉和人参果胶两部分组成,药理活性部分主要是人参果胶[56],具有提高免疫力、抗肿瘤和降血糖[57-59]等药理作用,能有效减轻心室重构,对心肌的基本结构进行保护。已有实验证明,利用结扎大鼠腹主动脉ACC制备心肌肥厚模型,给予人参多糖可有效减轻AAC所致的心肌肥厚,显著降低模型组大鼠LAC和FFA生成量,改善心肌肥厚所致的MMP改变,减少线粒体能量代谢紊乱。人参多糖可能通过改善心肌能量FFA和LAC代谢和提高线粒体的活力抑制AAC所致的心肌肥厚。目前,人参多糖多关注于抗癌、肠道菌群和高血压等疾病,在心血管领域研究较少,亟待科研工作者的进一步研究。
-
天然药物是新药研究的源泉,全球天然药物市场处于蓬勃发展阶段,拥有巨大增长潜力。本文主要总结了从国家专利数据库中挖掘出的前5名抗HF天然药物及其活性成分,介绍了其功效、活性成分、药理作用等。相比于西药治疗效果单一、不良反应大、价格昂贵等缺点,天然药物具有治疗途径多样、不良反应小、价格便宜的优势。通过针对开发基于天然药物的新型抗HF药物,有望从根本上减少HF的发病率和病死率,提高HF患者的生活质量。但是基于天然产物研发的抗HF药物用于临床仍然面临很多挑战,例如,药物活性成分的筛选和分离困难,治疗HF时相关作用机制不明确,临床研究样本少等问题。综上,天然药物应用于HF的相关研究仍需加大力度,争取开发出更多的抗HF天然药物,以满足日益增长的HF患者的需求。
Research progress on natural medicines and active compounds in the treatment of heart failure
-
摘要: 心衰是各种心血管疾病的终末阶段,也是导致患者死亡的主要原因。长期以来,天然药物一直用于治疗心衰,且效果显著。对国家专利数据库中的中药复方专利数据进行数据挖掘,选出临床治疗心衰的常见中药,并对其含有的经典单一活性成分进行分析,为开发治疗心衰的天然药物提供理论依据。Abstract: Heart failure is the terminal stage of various cardiovascular diseases and a leading cause of death. For a long time, natural medicines have been used to treat heart failure(HF) with remarkable effects. In this paper, the Traditional Chinese Medicine compound patents in the national patent database were mined, common Traditional Chinese Medicines for the clinical treatment of HF were selected, and the single active ingredient contained in them was analyzed, which provided some valuable tips for the development of drugs for the treatment of heart failure.
-
Key words:
- heart failure /
- natural medicine /
- monomer compounds /
- pharmacological action
-
参麻颈复颗粒是上海中医药大学附属岳阳中西医结合医院经典的自制制剂,由丹参、山茱萸、栀子、续断等10余味药物组成,具有活血通络,宁神安脑,健筋壮骨的功效。通过益气活血、滋阴降火、补肝益肾、温脾化痰以达到气血双补、上中下统调的治疗作用[1],多用于颈椎病、脑供血不足、头昏胀痛、夜寐梦扰等。脑梗死属于中医“中风”范畴,是指各种原因引起的脑部血液供应障碍,使局部脑组织发生不可逆性损害[2],主要采用溶栓、抗血小板或抗凝、调脂药以及脑保护药等治疗手段。参麻颈复颗粒作为上海中医药大学附属岳阳医院(本院)的特色自制制剂,在数十年的临床应用中发现其对脑梗死患者的预后有明显的治疗作用,研究表明该方中当归[3]、川芎[4]、蒺藜[5]、杜仲[6]、天麻[7]等药味均对脑梗死有一定的疗效,但作用机制尚不清楚。本研究借助网络药理学方法,对参麻颈复颗粒治疗脑梗死的作用机制进行研究,预测可能的活性成分、作用靶点及通路,为该制剂的进一步研发提供参考依据。
1. 材料和方法
1.1 参麻颈复颗粒活性成分筛选及对应靶点的收集
参麻颈复颗粒共由十二味中药组成,本研究利用中药系统药理学数据库和分析平台(TCMSP数据库) [8]、中药百科全书数据库(ETCM数据库)[9]、中医药资料库检索参麻颈复颗粒中组成中药的化学成分,TCMSP 数据库没有收录中药天麻和首乌藤,因此天麻的化学成分从ETCM数据库检索,首乌藤的化学成分从中医药资料库数据库检索[10-11],鉴于不同数据库中化学成分名称可能不同,因此将检索的化学成分根据其CAS 匹配到 TCMSP,找到该化学成分并获取其作用靶点。其余十味药通过TCMSP查找并导出用于筛选活性成分的相应数据,根据参数的口服生物利用度( oral bioavailability, OB) 和类药性( drug-likeness, DL)[12],以OB≥30%且DL ≥0.18作为条件筛选出活性成分,再利用TCMSP,关联相应的靶点,得到潜在靶点蛋白,并通过UniProt数据库(https://www.uniprot.org/)[13]匹配靶点蛋白所对应的基因。
1.2 参麻颈复颗粒活性成分-预测靶点网络的构建
将参麻颈复颗粒的活性成分及潜在靶点导入Cytoscape 3.7.2软件,构建参麻颈复颗粒的活性成分-预测靶点网络。 1.3 脑梗死相关靶标蛋白质的收集
基于OMIM数据库[14]检索脑梗死相关靶蛋白基因,以脑梗死(cerebral infarction)和缺血性脑卒中(cerebral ischemic stroke)为关键词进行靶标检索,所有靶标均通过UniProt数据库获取其UniProt ID信息。 1.4 参麻颈复颗粒相关的蛋白互作网络构建
将OMIM中收集到的与脑梗死相关的所有蛋白质,导入STRING数据库,导出分值>0.7的高置信度蛋白相互作用数据,用Cytoscape 3.7.2软件构建与治疗脑梗死有关的蛋白质-蛋白质相互作用(protein-protein interaction,PPI) 网络。 1.5 网络合并
利用Cytoscape 3.7.2软件中Merge功能,将参麻颈复颗粒活性成分-预测靶点网络与脑梗死的蛋白质-蛋白质相互作用网络合并,确定两者是否存在交集,通过Cytoscape 3.7.2软件构建参麻颈复颗粒活性成分-潜在靶点网络,系统分析参麻颈复颗粒治疗脑梗死的潜在作用靶点。 1.6 参麻颈复颗粒治疗脑梗死预测靶标富集分析
采用DAVID数据库( https://david.ncifcrf.gov/home.jsp) [15-17],对与脑梗死相关的参麻颈复颗粒活性成分-潜在靶点网络中的蛋白进行基于KEGG的生物通路富集分析,并利用OmicShare对通路进行可视化,采用DAVID数据库,对与治疗脑梗死相关的参麻颈复颗粒活性成分-潜在靶点网络中的蛋白进行GO功能富集分析。 2. 结果和分析
2.1 参麻颈复颗粒活性成分筛选
在TCMSP数据库中对十二味药的活性成分进行检索,共得到183个潜在有效成分(表1),其中有13个为共有成分(表2)。
表 1 参麻颈复颗粒中药对应潜在有效成分个数编号 中药名称 检索名称 检索拼音名 中药名称缩写 潜在有效成分个数 1 丹参 丹参 DAN SHEN DS 65 2 蒺藜 蒺藜 JI LI JL 30 3 杜仲 杜仲 DU ZHONG DZ 28 4 栀子 栀子 ZHI ZI ZZ 13 5 山茱萸 山茱萸 SHAN ZHU YU SZY 12 6 天麻 天麻 TIAN MA TM 9 7 川芎 川芎 CHUAN XIONG CX 7 8 续断 续断 XU DUAN XD 5 9 陈皮 陈皮 CHEN PI CP 5 10 首乌藤 夜交藤 YE JIAO TENG YJT 5 11 当归 当归 DANG GUI DG 2 12 桑寄生 桑寄生 SANG JI SHENG SJS 2 表 2 参麻颈复颗粒中药共有潜在有效成分编号 共有成分 来源 编号 共有成分 来源 A1 槲皮素 栀子、杜仲、桑寄生 A8 多孔菌素-5-烯-3β-醇 丹参、山茱萸、天麻 A2 β-谷甾醇 栀子、杜仲、山茱萸、续断、当归 A9 京尼平-1-O-龙胆双糖苷 杜仲、栀子 A3 谷甾醇 桑寄生、续断、蒺藜、川芎、陈皮 A10 表儿茶素 杜仲、首乌藤 A4 山柰酚 栀子、杜仲、蒺藜 A11 大黄素甲醚 蒺藜、首乌藤 A5 豆甾醇 栀子、山茱萸、当归 A12 异欧前胡素 丹参、栀子 A6 十八碳-6,9-二烯酸乙酯 栀子、山茱萸、川芎 A13 油酸乙酯 山茱萸、栀子 A7 3-β-羟基亚甲基-苯醌 杜仲、丹参 2.2 参麻颈复颗粒活性成分-靶点网络的构建
将筛选出的参麻颈复颗粒183个潜在有效成分导入到TCMSP,查找相应的靶点,得到1785个潜在靶点蛋白,并通过UniProt数据库匹配其蛋白所对应的基因。将结果导入到Cytoscape 3.7.2软件中进行网络构建,得到参麻颈复颗粒主要活性成分靶点网络(见表1和图1)。该网络共有519个节点、1 927条边,矩形方阵中浅蓝色菱形表示单味药的作用靶点、蓝色菱形表示共有的作用靶点、八边形图标表示参麻颈复颗粒活性成分、黄色箭头图标表示共有活性成分。参麻颈复颗粒的活性成分按度值排序,前四名分别为槲皮素、山柰酚、β-谷固醇、豆甾醇。该网络的构建提示参麻颈复颗粒的组成中药均具有多活性成分、多靶点的特点。
2.3 脑梗死相关靶点信息的收集和筛选
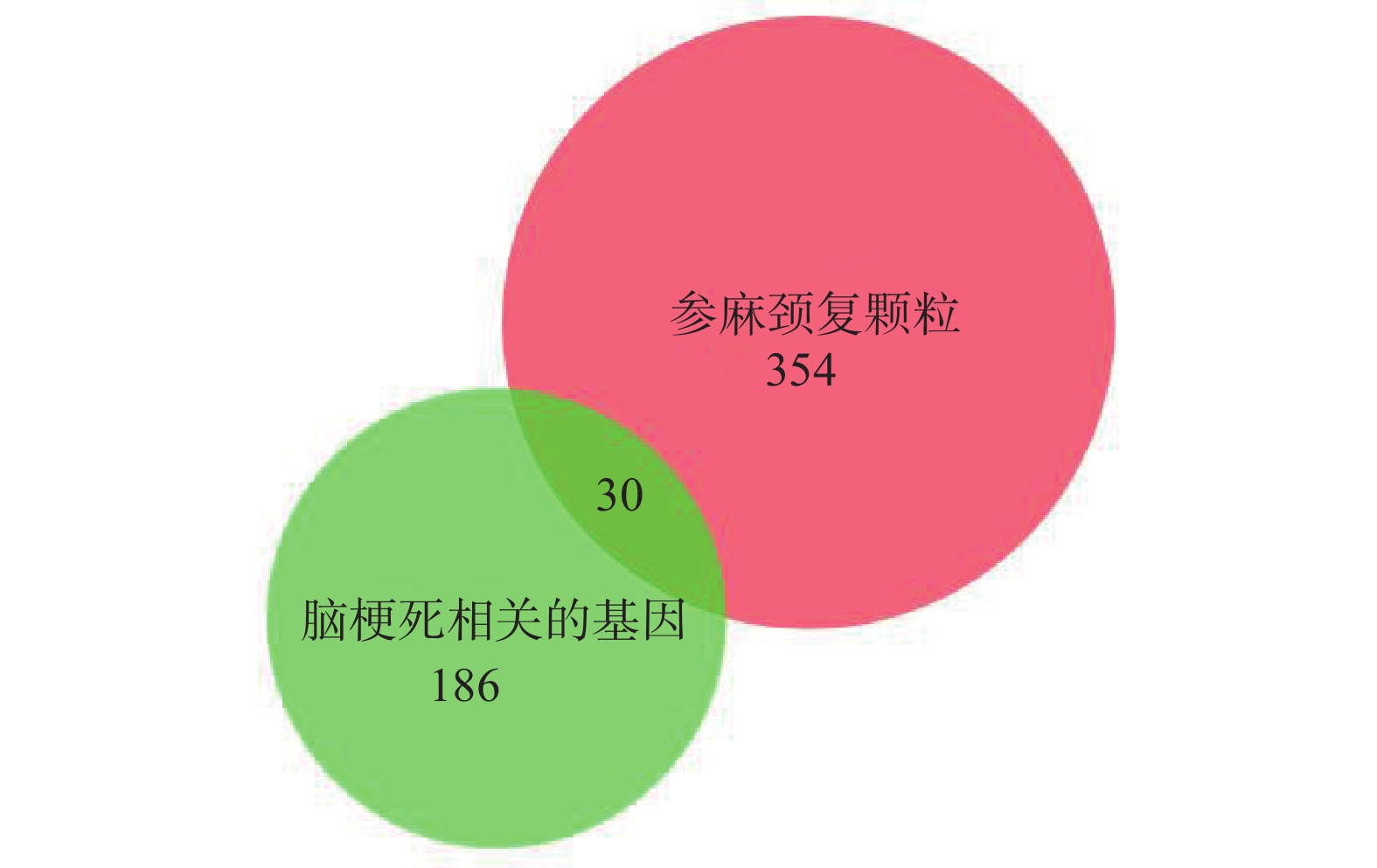
在OMIM数据库检索与脑梗死相关的基因,共检索到216个相关基因靶点。参麻颈复有效成份的1785个潜在靶点蛋白,删除重复项后得到384个相关靶点。将成分靶点和疾病靶点输入BioVenn在线软件进行交集分析,绘制韦恩图,筛选出脑梗死与参麻颈复活性成分共有30个共同靶点(图2)。
2.4 参麻颈复颗粒治疗脑梗死靶标蛋白-蛋白相互作用分析及网络可视化构建
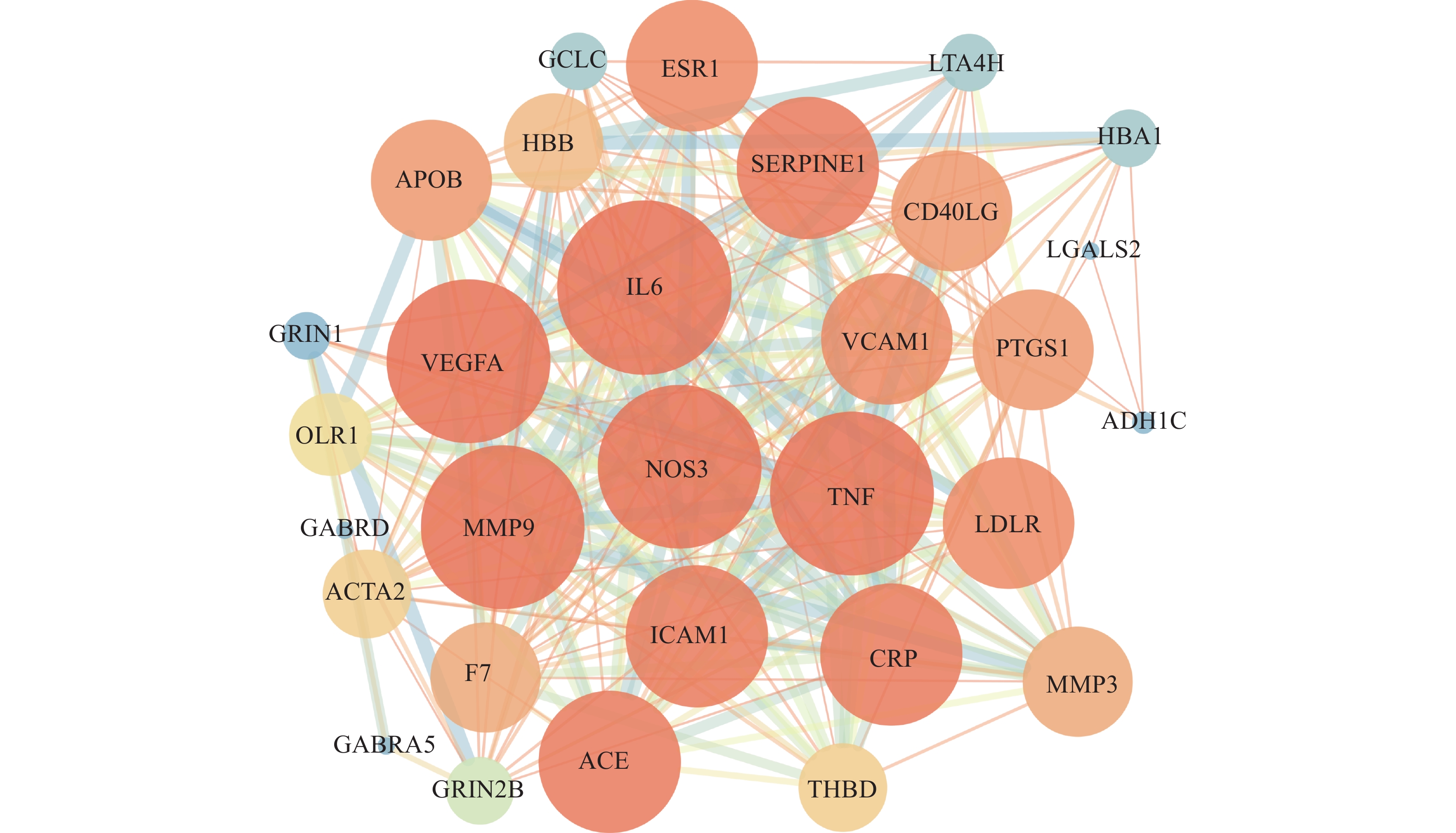
将参麻颈复颗粒预测所得的基因与脑梗死相关基因进行映射后得到共有靶基因,输入STRING数据库进行蛋白-蛋白相互作用分析。在分析过程中,选取物种为Homosapiens ,并将蛋白-蛋白互作得分>0.7的基因输入Cytoscape 3.7.2进行网络可视化,共有30个节点,253个连线。应用软件中的Network analysis plugin对网络图中节点(Node)进行统计,分析其在图中的作用,自由度(Degree)越大,该节点在网络中的生物功能则越多。同时,颜色越深代表该节点自由度较大、生物功能较多(图3)。进一步对与脑梗死潜在靶点网络进行分析,得到网络中潜在靶点的度值,网络中有20个靶点的度值>16.86(平均度值),可能为参麻颈复颗粒活性成分发挥作用的潜在靶点。
2.5 GO功能富集分析和KEGG通路富集分析
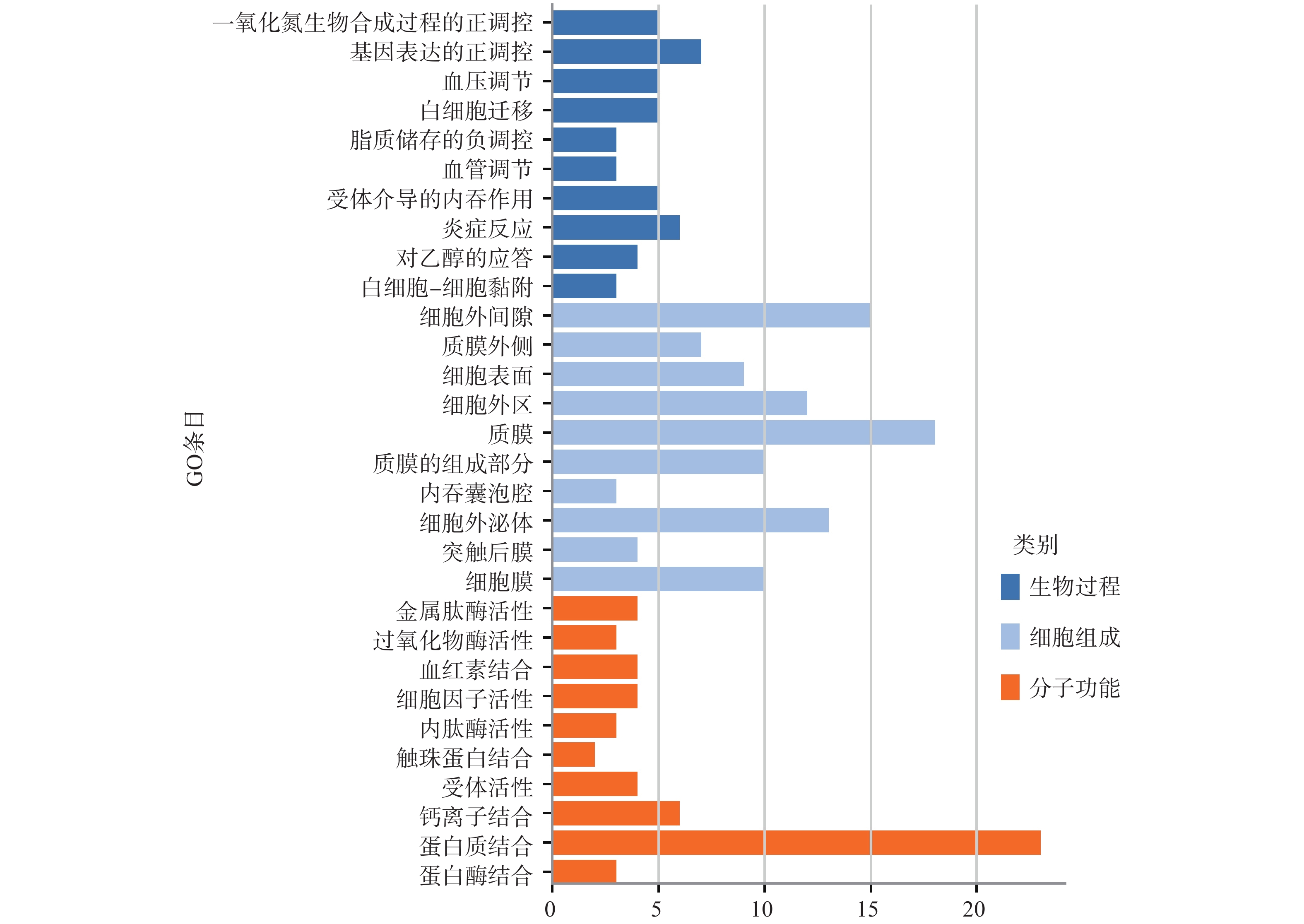
利用DAVID平台进行GO功能富集分析,对与脑梗死相关的参麻颈复颗粒活性成分-潜在靶点网络中涉及的30个蛋白在基因功能中的作用进行研究,得到了151个GO条目,根据P<0.05,筛选出117个GO条目,针对前10条BP分析、CC分析、MF分析绘制直方图(图4)。其中,生物过程相关的条目最多,有74个,结果显示参麻颈复颗粒主要对基因表达的正向调控、白细胞迁移、炎症反应、一氧化氮生物合成过程的正向调节等方面影响较大;分子功能相关的条目23个,结果显示参麻颈复颗粒主要对蛋白质结合、钙离子结合、受体活性、细胞因子活性等方面影响较大;细胞组成相关的条目20个,结果显示参麻颈复颗粒主要对细胞外间隙、质膜、细胞表面、胞外区等方面影响较大。
利用DAVID平台的KEGG通路富集分析功能,对与脑梗死相关的参麻颈复颗粒活性成分-潜在靶点网络中涉及的蛋白信号通路中的作用进行研究,得到19条信号通路,包括补体和凝血级联通路、NF-κB信号通路、HIF-1信号通路、肿瘤坏死因子信号通路、HTLV-I感染、神经活性配体受体相互作用等。
2.6 药物-化合物-靶点-通路图的构建
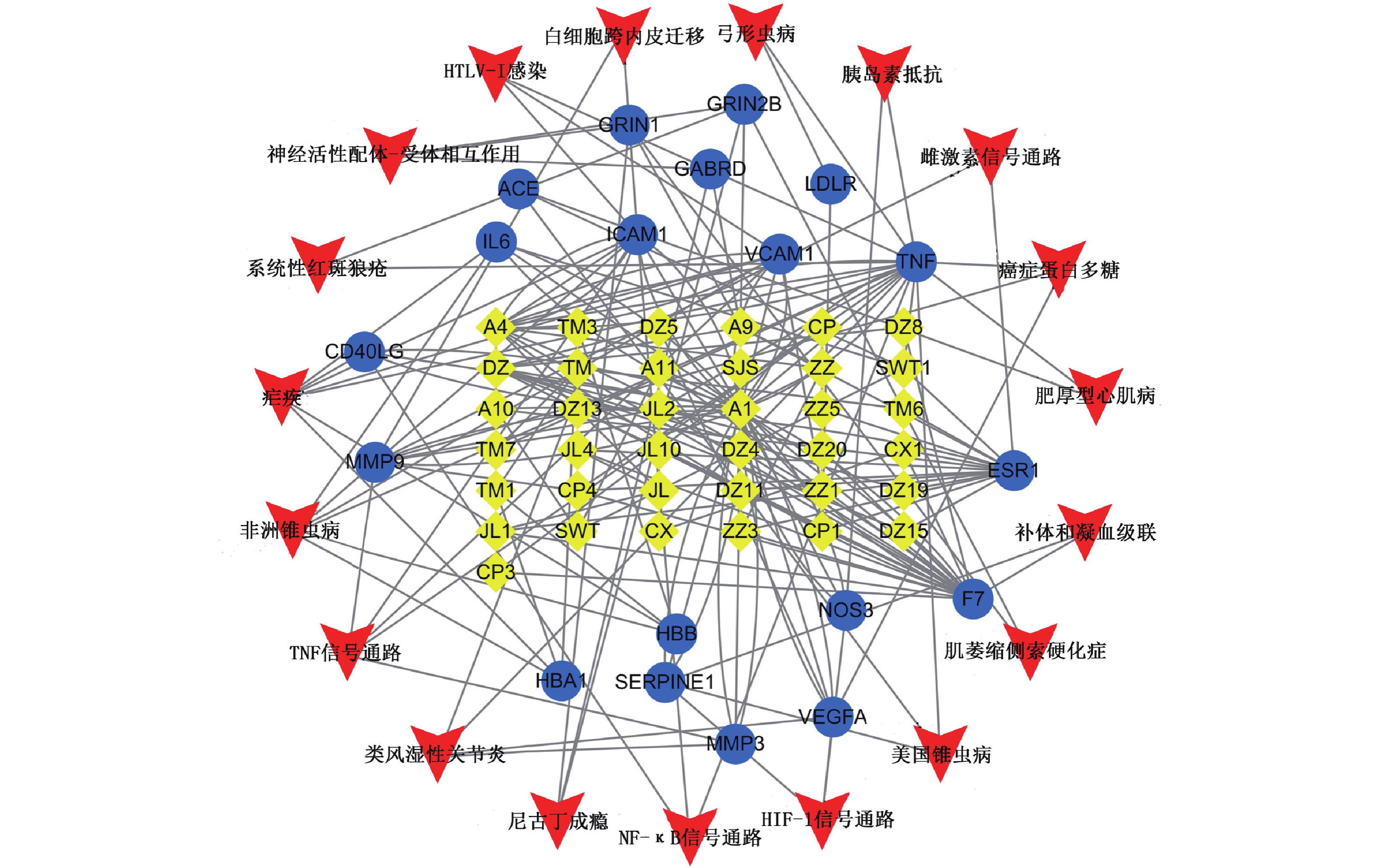
基于上述信息,构建活性成分-靶点-通路图,以全面阐述参麻颈复颗粒脑梗死的作用机制(图5、表3),图中有74个节点和188条边,黄色菱形代表参麻颈复颗粒活性成分,绿色圆形代表潜在靶点,红色箭头代表信号通路,边代表三者之间的相互作用。从结果可以看出参麻颈复方中槲皮素、β-胡萝卜素、柚皮素、西红花酸、大黄素、报春色素苷、表儿茶素等活性成分可能是参麻颈复治疗脑梗死的关键成分。
表 3 参麻颈复颗粒活性成分对照表编号 活性成分 口服利用度(%) 类药系数 度值 A1 槲皮素 46.43 0.28 414 A4 山柰酚 41.88 0.24 174 A9 京尼平-1-O-龙胆双糖苷 36.91 0.75 45 TM1 蔗糖 37.17 0.23 38 CP1 柚皮素 59.29 0.21 34 TM3 琥珀酸 31.62 0.23 34 CP4 柠檬苦素 61.67 0.52 33 JL2 大黄素 32.41 0.24 33 JL1 异鼠李素 49.60 0.31 31 SWT1 表儿茶素 48.96 0.24 29 A11 大黄素甲醚 22.29 0.27 28 ZZ5 5-羟基-7-甲氧基-2-(3,4,5-三甲氧基苯基)色酮 51.96 0.41 25 CX1 杨梅酮 40.60 0.51 22 TM7 胡萝卜苷 36.91 0.75 20 JL4 麦黄酮 118.35 0.26 17 DZ11 (E)-3-[4-[(1R,2R)-2-羟基-2-(4-羟基-3-甲氧基-苯基)-1-羟甲基-乙氧基]-3-甲氧基苯基]丙烯醛 56.32 0.36 15 DZ20 报春色素苷 49.81 0.37 15 DZ5 β-胡萝卜素 37.18 0.58 15 DZ15 脱氢二甘醇4,γ'-二-O-β-D-吡喃糖苷 51.44 0.40 13 DZ13 (+)-右旋杜仲树脂酚 87.19 0.62 12 DZ4 40957-99-1 57.20 0.62 12 JL10 4-酮皮诺类 49.60 0.56 12 CP3 二氢川陈皮素 86.90 0.51 11 DZ19 4-[(2S,3R)-5-[(E)-3-羟基p-1烯基]-7-甲氧基-3-羟甲基-2,3-二氢苯并呋喃-2-基]-2-甲氧基苯酚 50.76 0.39 11 ZZ1 西红花酸 35.30 0.26 11 ZZ3 苏丹Ⅲ 84.07 0.59 11 A10 表儿茶素 48.96 0.24 10 TM6 香兰素 52.00 0.33 8 DZ8 AIDS214634 92.43 0.55 7 3. 讨论
中药复方具有多活性成分、多作用靶点的特性,通过网络药理学手段,可以有效预测参麻颈复颗粒治疗脑梗死的作用机制。通过药物-化合物-靶点-通路网络的构建,可以发现参麻颈复颗粒中的陈皮、川芎、栀子、蒺藜、杜仲、天麻、首乌藤、山茱萸等药味中的槲皮素[18]、β-胡萝卜素[19]、西红花酸、柚皮素[20]、大黄素、报春色素苷、表儿茶素等活性成分可改善脑梗死患者的预后情况。研究显示槲皮素可通过抑制细胞凋亡和氧化应激水平,改善脑梗死受损神经功能,改善脑纤溶功能。β-胡萝卜素能阻止脑组织因自由基激活的氧化损伤,保护低密度脂蛋白免遭氧化损伤,在降低脑血管病危险因素方面有一定的作用。柚皮素可降低缺血再灌注损伤侧脑组织含水量、缩小脑梗死体积、降低脑组织MDA含量,提高SOD活性,对脑缺血再灌注损伤具有保护作用。通过GO功能富集结果提示,参麻颈复颗粒可能通过作用于纤溶酶原激活物抑制物1、血栓调节蛋白、凝血因子Ⅶ、血管内皮生长因子A等多个靶点,干预血小板激活、改善受损神经功能、保护脑缺血再灌注损伤,从而有助于脑梗死患者的恢复。
脑梗死后出现的炎症反应与脑损伤存在一定的关系,KEGG生物通路富集分析结果提示参麻颈复颗粒在干预脑梗死相关通路中,TNF信号通路和NF-κB信号通路起到了治疗脑梗死后炎症反应的重要作用。 IL-6靶点和TNF信号通路是脑梗死后重要的炎症反应通路[21]。NF-κB信号通路对炎症反应具有显著的影响,是脑缺血后炎性级联反应的始动因素[22],NF-κB被激活,使其调控的靶基因转录活性升高,可诱导TNF和IL-6等炎症因子的产生,促进炎症发生发展和诱导细胞凋亡加重脑缺血的损伤。因此,参麻颈复颗粒可能是通过抑制NF-κB、TNF等炎症信号通路,起到保护脑血管损伤的作用。
HIF-1信号通路参与脑缺血组织的血管再生和血脑屏障的维持[23],可以通过调控下游基因的转录,对抗低氧造成的细胞功能紊乱。HIF-1可以调控10余种下游基因的表达和转录,进而对多种细胞的多种生物学活动有重要影响[24]。因此,参麻颈复颗粒可能通过调节HIF-1信号通路促进对脑血管组织的再生,维持脑梗死患者的血脑屏障,改善脑梗死患者的预后情况。
本研究运用网络药理学的技术和方法,通过中药活性成分的筛选、靶点预测、网络构建与分析,从“药物-化合物-靶点-疾病”的关联性对中药复方参麻颈复颗粒治疗脑梗死的相关作用机制进行分析,预测参麻颈复颗粒治疗脑梗死的主要活性成分、作用靶点及信号通路,为进一步的实验验证提供依据。
-
表 1 中国专利数据库中治疗HF的高频次中药
药名 频次 药名 频次 药名 频次 黄芪 55 白术 21 三七 12 丹参 40 当归 21 干姜 11 茯苓 40 麦冬 21 鸡血藤 11 附子 38 甘草 20 桃仁 11 人参 31 泽泻 19 猪苓 11 葶苈子 28 红参 16 红花 10 桂枝 28 党参 15 肉桂 10 川芎 23 五味子 15 益母草 10 -
[1] XU L H, CHEN L Y, GU G Y, et al. Natural products from traditional Chinese medicine for the prevention and treatment of heart failure: progress and perspectives[J]. Rev Cardiovasc Med, 2022, 23(2):60. doi: 10.31083/j.rcm2302060 [2] WANG A Z, ZHAO W, YAN K T, et al. Mechanisms and efficacy of traditional Chinese medicine in heart failure[J]. Front Pharmacol, 2022, 13:810587. doi: 10.3389/fphar.2022.810587 [3] FU S F, ZHANG J H, GAO X M, et al. Clinical practice of traditional Chinese medicines for chronic heart failure[J]. Heart Asia, 2010, 2(1):24-27. doi: 10.1136/ha.2009.001123 [4] ZANG Y B, WAN J J, ZHANG Z, et al. An updated role of astragaloside IV in heart failure[J]. Biomed Pharmacother, 2020, 126:110012. doi: 10.1016/j.biopha.2020.110012 [5] WANG Y, WANG Q Y, LI C, et al. A review of Chinese herbal medicine for the treatment of chronic heart failure[J]. Curr Pharm Des, 2017, 23(34):5115-5124. [6] MA X, ZHANG K, LI H X, et al. Extracts from Astragalus membranaceus limit myocardial cell death and improve cardiac function in a rat model of myocardial ischemia[J]. J Ethnopharmacol, 2013, 149(3):720-728. doi: 10.1016/j.jep.2013.07.036 [7] ZHOU R J, CHEN H J, CHEN J P, et al. Extract from Astragalus membranaceus inhibit breast cancer cells proliferation via PI3K/AKT/mTOR signaling pathway[J]. BMC Complementary Altern Med, 2018, 18(1):83. doi: 10.1186/s12906-017-2057-9 [8] FRANK A, BONNEY M, BONNEY S, et al. Myocardial ischemia reperfusion injury: from basic science to clinical bedside[J]. Semin Cardiothorac Vasc Anesth, 2012, 16(3):123-132. doi: 10.1177/1089253211436350 [9] YIN B, HOU X W, LU M L. Astragaloside IV attenuates myocardial ischemia/reperfusion injury in rats via inhibition of calcium-sensing receptor-mediated apoptotic signaling pathways[J]. Acta Pharmacol Sin, 2019, 40(5):599-607. doi: 10.1038/s41401-018-0082-y [10] FISCHER P, HILFIKER-KLEINER D. Survival pathways in hypertrophy and heart failure: the gp130-STAT3 axis[J]. Basic Res Cardiol, 2007, 102(4):279-297. doi: 10.1007/s00395-007-0658-z [11] DENISE H K, PRAPHULLA S, GUNNAR K, et al. Continuous glycoprotein-130-mediated signal transducer and activator of transcription-3 activation promotes inflammation, left ventricular rupture, and adverse outcome in subacute myocardial infarction[J]. Circulation, 2010, 122(2):145-155. doi: 10.1161/CIRCULATIONAHA.109.933127 [12] ZHAO P, WANG Y, ZENG S, et al. Protective effect of astragaloside IV on lipopolysaccharide-induced cardiac dysfunction via downregulation of inflammatory signaling in mice[J]. Immunopharmacol Immunotoxicol, 2015, 37(5):428-433. doi: 10.3109/08923973.2015.1080266 [13] ZHOU R N, SONG Y L, RUAN J Q, et al. Pharmacokinetic evidence on the contribution of intestinal bacterial conversion to beneficial effects of astragaloside IV, a marker compound of astragali Radix, in traditional oral use of the herb[J]. Drug Metab Pharmacokinet, 2012, 27(6):586-597. doi: 10.2133/dmpk.DMPK-11-RG-160 [14] SUN C H, JIANG M M, ZHANG L, et al. Cycloastragenol mediates activation and proliferation suppression in concanavalin A-induced mouse lymphocyte pan-activation model[J]. Immunopharmacol Immunotoxicol, 2017, 39(3):131-139. doi: 10.1080/08923973.2017.1300170 [15] TAN S F, WANG G F, GUO Y P, et al. Preventive effects of a natural anti-inflammatory agent, astragaloside IV, on ischemic acute kidney injury in rats[J]. Evid Based Complement Alternat Med, 2013, 2013:284025. [16] GUO H T, CALLAWAY J B, TING J P-Y. Inflammasomes: mechanism of action, role in disease, and therapeutics[J]. Nat Med, 2015, 21(7):677-687. doi: 10.1038/nm.3893 [17] WANG J, WU M L, CAO S P, et al. Cycloastragenol ameliorates experimental heart damage in rats by promoting myocardial autophagy via inhibition of AKT1-RPS6KB1 signaling[J]. Biomed Pharmacother, 2018, 107:1074-1081. doi: 10.1016/j.biopha.2018.08.016 [18] LI M, HAN B, ZHAO H, et al. Biological active ingredients of astragali radix and its mechanisms in treating cardiovascular and cerebrovascular diseases[J]. Phytomedicine, 2022, 98:153918. doi: 10.1016/j.phymed.2021.153918 [19] ZHANG L, FAN C D, JIAO H C, et al. Calycosin alleviates doxorubicin-induced cardiotoxicity and pyroptosis by inhibiting NLRP3 inflammasome activation[J]. Oxid Med Cell Longev, 2022, 2022:1733834. [20] CHEN G H, XU H L, XU T, et al. Calycosin reduces myocardial fibrosis and improves cardiac function in post-myocardial infarction mice by suppressing TGFBR1 signaling pathways[J]. Phytomedicine, 2022, 104:154277. doi: 10.1016/j.phymed.2022.154277 [21] RÍOS J L, ANDÚJAR I, RECIO M C, et al. Lanostanoids from fungi: a group of potential anticancer compounds[J]. J Nat Prod, 2012, 75(11):2016-2044. doi: 10.1021/np300412h [22] ESTEBAN C I. Interés medicinal de Poria Cocos (= Wolfiporia extensa)[J]. Rev Iberoam De Micología, 2009, 26(2):103-107. [23] RÍOS J L. Chemical constituents and pharmacological properties of Poria cocos[J]. Planta Med, 2011, 77(7):681-691. doi: 10.1055/s-0030-1270823 [24] VAN DER POL A, VAN GILST W H, VOORS A A, et al. Treating oxidative stress in heart failure: past, present and future[J]. Eur J Heart Fail, 2019, 21(4):425-435. doi: 10.1002/ejhf.1320 [25] LI X, CHEN S, LI J E, et al. Chemical composition and antioxidant activities of polysaccharides from Yingshan cloud mist tea[J]. Oxidative Med Cell Longev, 2019, 2019:1915967. [26] LIU X F, WANG X Q, XU X F, et al. Purification, antitumor and anti-inflammation activities of an alkali-soluble and carboxymethyl polysaccharide CMP33 from Poria cocos[J]. Int J Biol Macromol, 2019, 127:39-47. doi: 10.1016/j.ijbiomac.2019.01.029 [27] WEI C Y, WANG H Z, SUN X, et al. Pharmacological profiles and therapeutic applications of pachymic acid (Review)[J]. Exp Ther Med, 2022, 24(3):547. doi: 10.3892/etm.2022.11484 [28] LI F F, YUAN Y, LIU Y, et al. Pachymic acid protects H9c2 cardiomyocytes from lipopolysaccharide-induced inflammation and apoptosis by inhibiting the extracellular signal-regulated kinase 1/2 and p38 pathways[J]. Mol Med Rep, 2015, 12(2):2807-2813. doi: 10.3892/mmr.2015.3712 [29] HUANG Y C, CHANG W L, HUANG S F, et al. Pachymic acid stimulates glucose uptake through enhanced GLUT4 expression and translocation[J]. Eur J Pharmacol, 2010, 648(1-3):39-49. doi: 10.1016/j.ejphar.2010.08.021 [30] LUO C M, YI F L, XIA Y L, et al. Comprehensive quality evaluation of the lateral root of Aconitum carmichaelii Debx. (Fuzi): simultaneous determination of nine alkaloids and chemical fingerprinting coupled with chemometric analysis[J]. J Sep Sci, 2019, 42(5):980-990. [31] LIN S Q, LIU K X, WU W K, et al. Study on pretreatment of FPS-1 in rats with hepatic ischemia-reperfusion injury[J]. Am J Chin Med, 2009, 37(2):323-337. doi: 10.1142/S0192415X09006874 [32] LU Y J, ZHOU J, XU C Q, et al. JAK/STAT and PI3K/AKT pathways form a mutual transactivation loop and afford resistance to oxidative stress-induced apoptosis in cardiomyocytes[J]. Cell Physiol Biochem, 2008, 21(4):305-314. doi: 10.1159/000129389 [33] LU X H, ZHANG L, LI P Y, et al. The protective effects of compatibility of Aconiti Lateralis Radix Praeparata and Zingiberis Rhizoma on rats with heart failure by enhancing mitochondrial biogenesis via Sirt1/PGC-1α pathway[J]. Biomed Pharmacother, 2017, 92:651-660. doi: 10.1016/j.biopha.2017.05.117 [34] WU H, LIU X, GAO Z Y, et al. Anti-myocardial infarction effects of Radix aconiti lateralis preparata extracts and their influence on small molecules in the heart using matrix-assisted laser desorption/ionization–mass spectrometry imaging[J]. Int J Mol Sci, 2019, 20(19):4837. doi: 10.3390/ijms20194837 [35] CHAN T F, CHAN J C, TOMLINSON B, et al. Chinese herbal medicines revisited: a Hong Kong perspective[J]. Lancet, 1993, 342(8886-8887):1532-1534. doi: 10.1016/S0140-6736(05)80091-1 [36] LIU M, CAO Y, LV D Y, et al. Effect of processing on the alkaloids in Aconitum tubers by HPLC-TOF/MS[J]. J Pharm Anal, 2017, 7(3):170-175. doi: 10.1016/j.jpha.2017.01.001 [37] HONERJÄGER P, MEISSNER A. The positive inotropic effect of aconitine[J]. Naunyn-Schmiedeberg's Arch Pharmacol, 1983, 322(1):49-58. doi: 10.1007/BF00649352 [38] WU M P, ZHANG Y S, ZHOU Q M, et al. Higenamine protects ischemia/reperfusion induced cardiac injury and myocyte apoptosis through activation of β2-AR/PI3K/AKT signaling pathway[J]. Pharmacol Res, 2016, 104:115-123. doi: 10.1016/j.phrs.2015.12.032 [39] LOPASCHUK G D, KARWI Q G, TIAN R, et al. Cardiac energy metabolism in heart failure[J]. Circ Res, 2021, 128(10):1487-1513. doi: 10.1161/CIRCRESAHA.121.318241 [40] WANG D, LU C Y, TENG L S, et al. Therapeutic effects of Chinese herbal medicine against neuroendocrinological diseases especially related to hypothalamus-pituitary-adrenal and hypothalamus-pituitary-gonadal axis[J]. Pak J Pharm Sci, 2014, 27(3-Suppl):741-754. [41] TSAI M Y, YANG R C, WU H T, et al. Anti-angiogenic effect of Tanshinone IIA involves inhibition of matrix invasion and modification of MMP-2/TIMP-2 secretion in vascular endothelial cells[J]. Cancer Lett, 2011, 310(2):198-206. doi: 10.1016/j.canlet.2011.06.031 [42] LI X, DU J R, YU Y, et al. Tanshinone IIA inhibits smooth muscle proliferation and intimal hyperplasia in the rat carotid balloon-injured model through inhibition of MAPK signaling pathway[J]. J Ethnopharmacol, 2010, 129(2):273-279. doi: 10.1016/j.jep.2010.03.021 [43] REN Z H, TONG Y H, XU W, et al. Tanshinone II A attenuates inflammatory responses of rats with myocardial infarction by reducing MCP-1 expression[J]. Phytomedicine, 2010, 17(3-4):212-218. doi: 10.1016/j.phymed.2009.08.010 [44] TAKAHASHI M. NLRP3 inflammasome as a novel player in myocardial infarction[J]. Int Heart J, 2014, 55(2):101-105. doi: 10.1536/ihj.13-388 [45] MA Y Z, LI H, YUE Z B, et al. Cryptotanshinone attenuates cardiac fibrosis via downregulation of COX-2, NOX-2, and NOX-4[J]. J Cardiovasc Pharmacol, 2014, 64(1):28-37. doi: 10.1097/FJC.0000000000000086 [46] JIN Y C, KIM C W, KIM Y M, et al. Cryptotanshinone, a lipophilic compound of Salvia miltiorrriza root, inhibits TNF-alpha-induced expression of adhesion molecules in HUVEC and attenuates rat myocardial ischemia/reperfusion injury in vivo[J]. Eur J Pharmacol, 2009, 614(1-3):91-97. doi: 10.1016/j.ejphar.2009.04.038 [47] ZHANG Y S, CHEN L, LI F, et al. Cryptotanshinone protects against adriamycin-induced mitochondrial dysfunction in cardiomyocytes[J]. Pharm Biol, 2016, 54(2):237-242. doi: 10.3109/13880209.2015.1029052 [48] MA S T,YANG D C,WANG K Y,et.al. Cryptotanshinone attenuates isoprenaline-induced cardiac fibrosis in mice associated with upregulation and activation of matrix metalloproteinase-2[J]. Mol Med Report, 2012, 6(1):145-150. [49] SONG Q T, CHU X, ZHANG X, et al. Mechanisms underlying the cardioprotective effect of Salvianic acid A against isoproterenol-induced myocardial ischemia injury in rats: possible involvement of L-type calcium channels and myocardial contractility[J]. J Ethnopharmacol, 2016, 189:157-164. doi: 10.1016/j.jep.2016.05.038 [50] ANDRASSY M, VPLZ H C, IGWE J C, et al. High-mobility group box-1 in ischemia-reperfusion injury of the heart[J]. Circulation, 2008, 117(25): 3216-3226. [51] XIANG J, ZHANG C L, DI T T, et al. Salvianolic acid B alleviates diabetic endothelial and mitochondrial dysfunction by down-regulating apoptosis and mitophagy of endothelial cells[J]. Bioengineered, 2022,13(2): 3486-3502. [52] ZHOU Z, LIU Y, MIAO A D, et al. Salvianolic acid B attenuates plasminogen activator inhibitor type 1 production in TNF-alpha treated human umbilical vein endothelial cells[J]. J Cell Biochem, 2005, 96(1):109-116. doi: 10.1002/jcb.20567 [53] VAN DER POL A, VAN GILST W H, VOORS A A, et al. Treating oxidative stress in heart failure: past, present 1and future[J]. Eur J Heart Fail, 2019, 21(4): 425-435. [54] LI C Y, YANG P, JIANG Y L, et al. Ginsenoside Rb1 attenuates cardiomyocyte apoptosis induced by myocardial ischemia reperfusion injury through mTOR signal pathway[J]. Biomed Pharmacother, 2020, 125:109913. doi: 10.1016/j.biopha.2020.109913 [55] WU Y, XIA Z Y, MENG Q T, et al. Shen-Fu injection preconditioning inhibits myocardial ischemia-reperfusion injury in diabetic rats: activation of eNOS via the PI3K/Akt pathway[J]. J Biomed Biotechnol, 2011, 2011:384627. [56] HUANG L Z, ZHAO H F, HUANG B K, et al. Acanthopanax senticosus: review of botany, chemistry and pharmacology[J]. Pharmazie, 2011, 66(2):83-97. [57] NIU J, PI Z F, YUE H, et al. Effect of ginseng polysaccharide on the urinary excretion of type 2 diabetic rats studied by liquid chromatography–mass spectrometry[J]. Analyt Teehnot. Biomed Life Sci, 2012, 907:7-12. doi: 10.1016/j.jchromb.2012.08.012 [58] LI C, CAI J P, GENG J S, et al. Purification, characterization and anticancer activity of a polysaccharide from Panax ginseng[J]. Int J Biol Macromol, 2012, 51(5):968-973. doi: 10.1016/j.ijbiomac.2012.06.031 [59] KIM M H, BYON Y Y, KO E J, et al. Immunomodulatory activity of ginsan, a polysaccharide of Panax ginseng, on dendritic cells[J]. Korean J Physiol Pharmacol, 2009, 13(3):169-173. doi: 10.4196/kjpp.2009.13.3.169 -





 下载:
下载:

 下载:
下载: 

