-
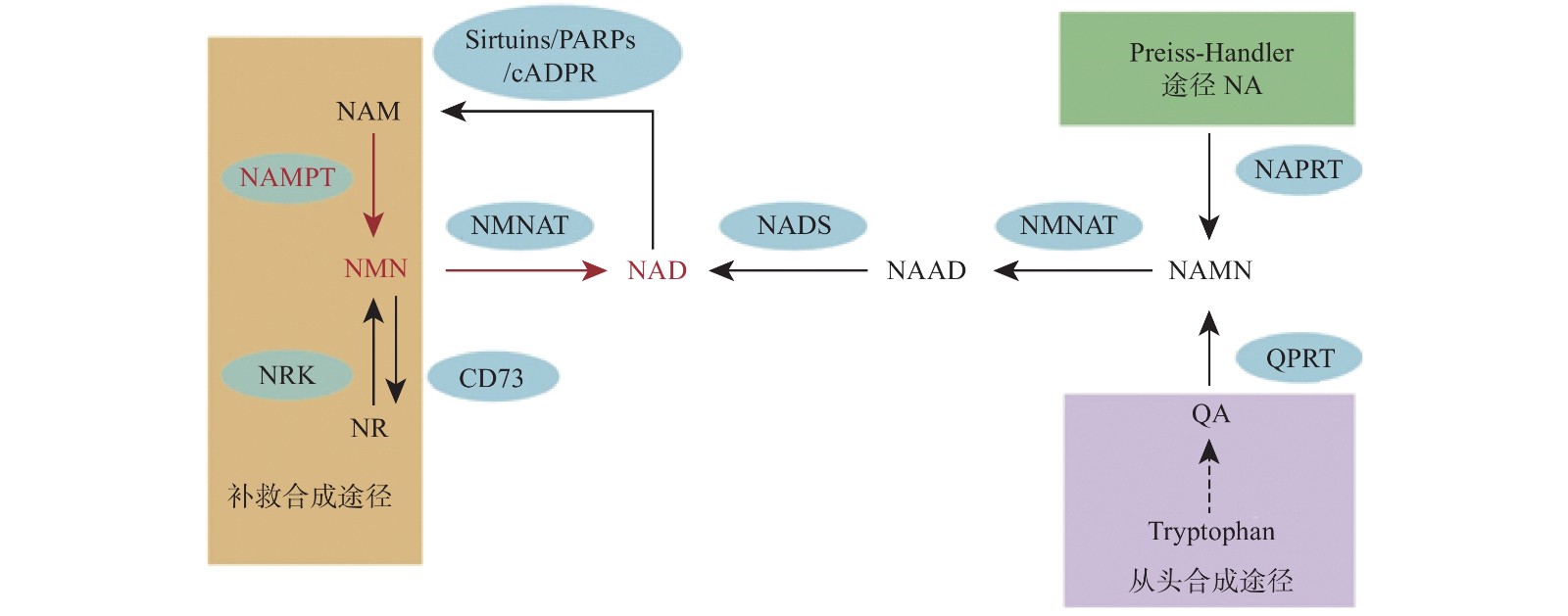
烟酰胺腺嘌呤二核苷酸(NAD)是真核细胞中的一种重要的代谢氧化还原辅酶,它在各种生物过程中起关键作用,包括新陈代谢、衰老、细胞死亡、DNA 修复和表达[1-2]。NAD主要有3种生物合成途径,在哺乳动物中,补救途径是NAD的主要来源并且该途径只有两个步骤(图1)。NAD 在该途径中的合成速率主要由烟酰胺磷酸核糖基转移酶(Nampt)决定,该步骤首先将烟酰胺(NAM)和5-磷酸核糖基-1-焦磷酸(PRPP)转化为烟酰胺单核苷酸(NMN)。然后,在第二步中将NMN与ATP偶联并转化为NAD[3]。直接使用NMN可以弥补NAD的不足,因此NMN可以参与多种疾病的调节,如2型糖尿病、肥胖症、心力衰竭、神经再生和炎症等[4-8]。
溃疡性结肠炎是炎症性肠病的一种。近年来,其病因和发病机制的研究受到广泛关注[9-11]。目前治疗溃疡性结肠炎的手段主要是对症治疗,如抗感染药、糖皮质激素和免疫抑制剂等,但这些药物长期使用会带来很多不良反应[12-13]。NAD与多种炎症性疾病有关,如败血症和类风湿性关节炎[14-15]。此外,有报道显示,炎症性肠病患者结肠组织和血清中Nampt浓度升高,并将Nampt作为小儿炎症性肠病严重程度的标志物[16-17]。因此,作为NAD合成的中间重要产物NMN,也有可能对炎症性肠病产生一定作用。与此同时,目前有很多含有NMN的保健品问世,但是由于NMN参与调节的功能非常复杂,并且有研究表明NMN可以促进肿瘤的增殖等作用[18],因此,补充NMN并不一定对人体都有益。并且,NMN作为保健品需要长期服用,但对于一些患有如炎症性肠病的慢性病患者,评价其对于患者的安全性极其重要。
本研究主要考察NMN对DSS诱导的溃疡性结肠炎小鼠模型的作用。以评价NMN作为保健品是否适用于患有溃疡性结肠炎的患者。
-
雄性C57小鼠(8周龄,上海西普尔-必凯实验动物有限公司),放于实验室适应2周后进行造模。按照之前的方法进行模型制备[19],将DSS(美国MP公司,分子量为36 000~50 000)溶于水中,至终浓度为3%,让小鼠自由饮用。
-
将NMN[音芙医药科技(上海)有限公司]溶于生理盐水中,制备不同浓度的NMN溶液,将雄性C57小鼠分为6组,分别为生理盐水对照组,3、10、30、100、300 mg/kg NMN的不同剂量组。按照容积0.1 ml/10 g,通过灌胃(ig)和腹腔注射(ip)两种方式,从第1天开始给药,每天1次,直至实验观察结束。
-
按照之前的评分标准进行评分[19],对体重下降程度、大便性状、血便情况分别进行评分,而后进行加和,计算总分数。具体评分标准见表1。
表 1 疾病评分
评分 体重下降(%) 大便性状 血便情况 0 无 正常 无 1 1~5 — — 2 5~10 半稀便 潜血 3 10~15 — — 4 ≥15 稀便 肉眼血便 注:“—”表示无此项评分。 -
小鼠处死后,取整个结肠部位,测量长度进行比较。而后将结肠下段部位组织用4%多聚甲醛固定24 h,然后包埋在石蜡中。准备厚度为4 μm的切片,按照之前的实验方法,进行HE染色[19]。
-
本实验指标均为定量数据,数据以(
$\bar x \pm s$ )表示。两两比较采用t-test法进行,采用GraphPad Prism 7统计软件进行统计分析。 -
为了确定实验的最佳观察时间,首先对小鼠的生存曲线进行测定。将100和300 mg/kg的NMN通过灌胃的给药方式,检测3%DSS诱导的溃疡性结肠炎模型小鼠生存时间(图2),在给药第9天时,300 mg/kg组中有2只小鼠死亡,生理盐水对照组和100 mg/kg组在第10 天出现小鼠死亡。第17天时,300 mg/kg组小鼠全部死亡,而在第20天时,生理盐水对照组和100 mg/kg组全部死亡。3组生存曲线之间并无统计学差异。由于在给药第9天时,有小鼠出现死亡,因此我们将后面实验的观察时间设定为8 d。
-
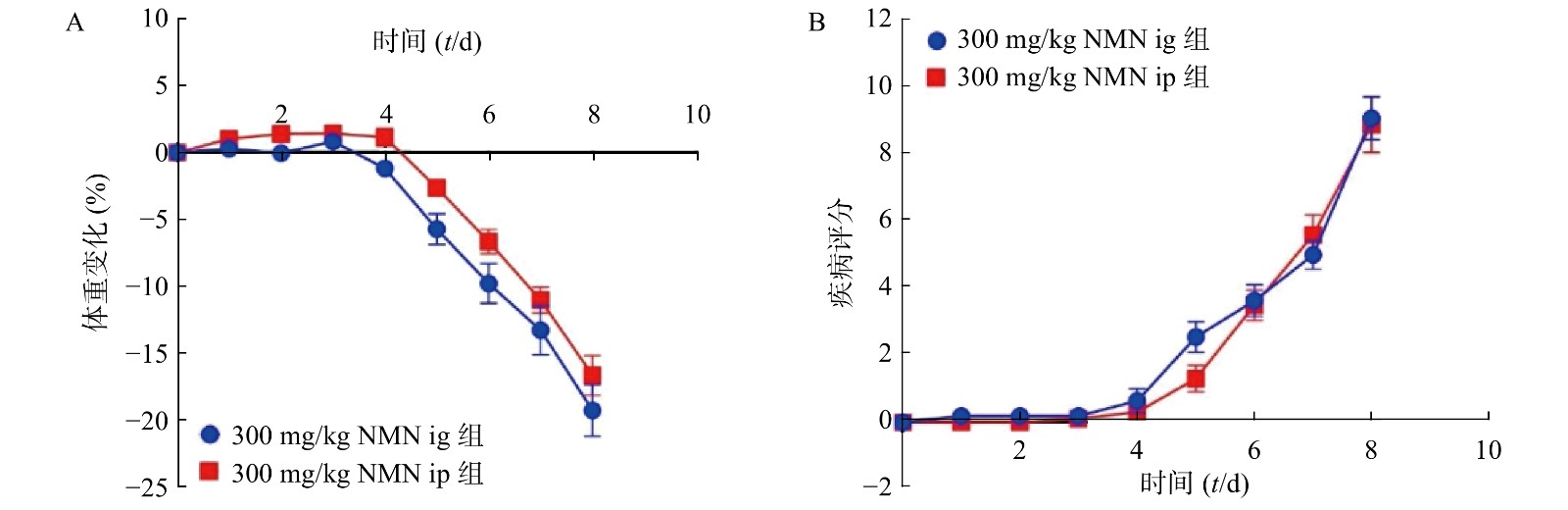
为了考察不同给药方式对小鼠的影响,我们分别通过灌胃和腹腔注射两种给药方式,观察NMN对于小鼠体重和DAI的影响,如图3所示,灌胃和腹腔注射两种给药方式对溃疡性结肠炎模型小鼠体重和DAI分数的影响无显著性差异,二者都在第5天时表现出体重下降并出现稀便情况。因此,为了更真实的模拟人用药环境,我们在后续实验中均采用灌胃的给药方式。
-
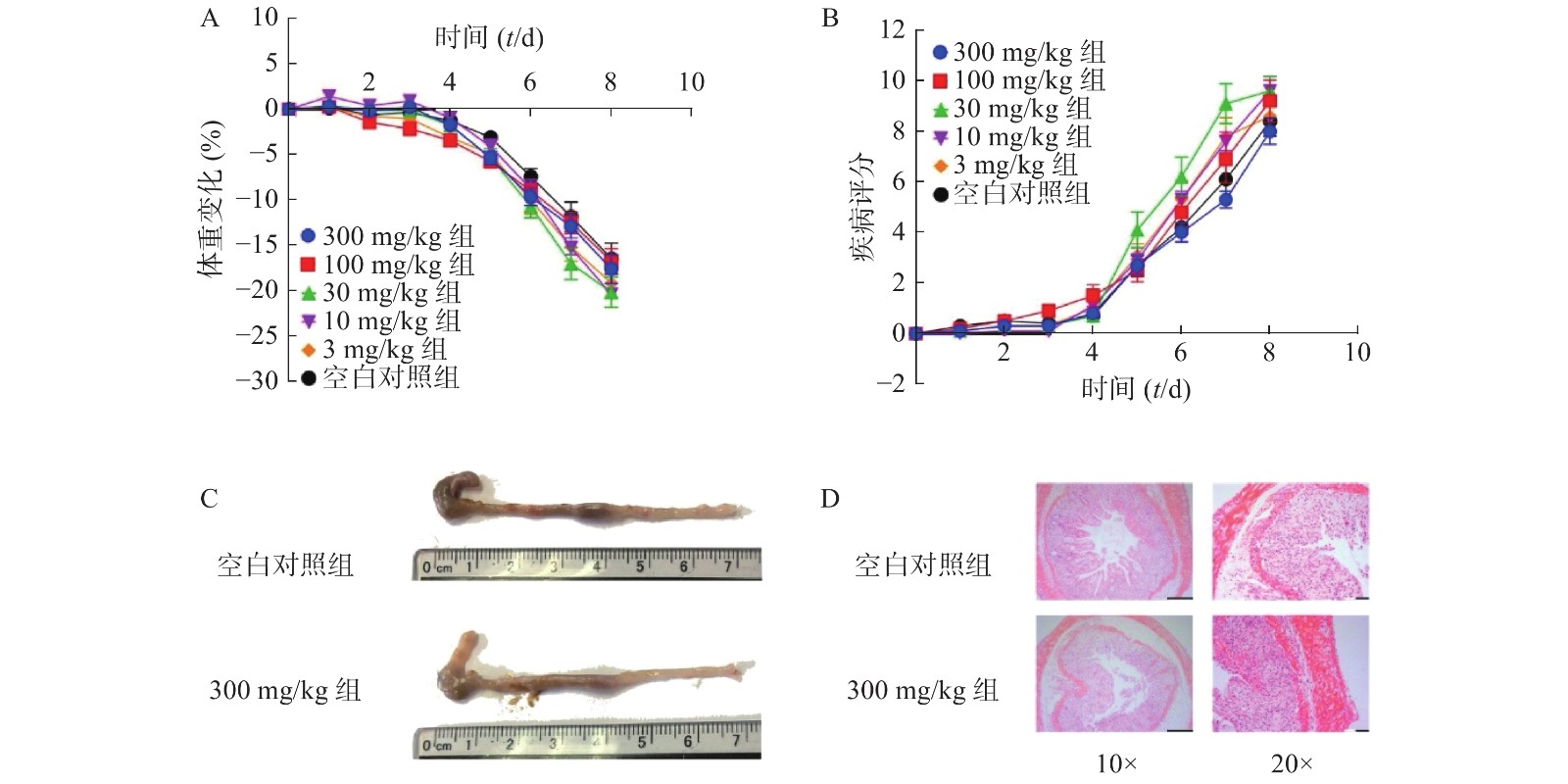
为了进一步考察不同浓度NMN对DSS诱导的溃疡性结肠炎模型小鼠的影响,我们应用了不同浓度的NMN通过灌胃给药的方式,分别对小鼠的体重和DAI进行了检测。结果显示(图4A、4B),不同浓度的NMN对小鼠的体重和DAI的影响,与对照组相比均无显著性差异。为了更进一步确认,我们又对结肠长度和结肠形态进行了检测,结果显示(图4C、4D),300 mg/kg的NMN与对照组相比,肠道长度和免疫组化切片结果并无显著性差异。
-
本研究测定了不同剂量的NMN对DSS诱导的溃疡性结肠炎小鼠的体重、DAI评分、结肠长度和肠道形态的影响,即NMN对DSS诱导的溃疡性结肠炎小鼠并无显著作用。
NMN作为NAD的前体,其功能目前认为是通过NAD来体现的,NNM和NAD的代谢是紧密联系的。NAD在人体内有3条生化途径:Preiss-Handler途径、从头合成途径和补救合成途径(图1)[20]。Preiss-Handler途径从NA开始,经过NAPRT催化变成NAMN,经过NMNAT的催化,变成NAAD,然后再被NAD合成酶NADS催化成NAD[21]。从头合成途径首先是从食物中摄取的色氨酸开始,经过一系列体内生化反应生成喹啉酸(QA),而后经过(QPRT催化生成NAMN进入Preiss-Handler途径[22]。补救合成途径从NAM开始,然后经过NAMPT催化后,变成NMN,NMN同样通过NMNAT酶的催化转变成NAD,而后NAD在经过3个消耗途径NAD依赖的去乙酰化酶(Sirtuins)、多聚ADP核糖聚合酶(PARPs)、环腺苷二磷酸核糖(cADPR)合酶后变成烟酰胺完成循环[2]。NAD的含量在这3条途径下保持平衡,补救合成途径是人体NAD的主要来源,该过程中的NAMPT是这个循环的限制步骤[23]。
NMN作为NAD合成的重要中间产物,存在于多种类型的细胞中,并参与了不同的生物学过程。NMN可防止由NAD分解代谢酶而引起的NAD耗竭。目前报道的NMN大部分作用对人体都是有益的,但是随着研究的深入,NAD的增加也能够加重某些疾病的发展,如炎症和肿瘤[18, 24-25]。近期有研究表明,在克罗恩结肠炎和溃疡性结肠炎患者的结肠组织中,血浆Nampt和mRNA水平均显著升高[16]。更有研究表明,Nampt的特异性抑制剂FK866,改善了DSS诱导的溃疡性结肠炎模型小鼠症状,并抑制了小鼠中与炎症相关的肿瘤发生。由于Nampt是NMN的重要合成生物酶,因此,我们怀疑NMN可能也会加重DSS诱导的溃疡性结肠炎模型小鼠症状。基于此,我们首先检测了不同剂量的NMN对模型小鼠的生存曲线的影响,发现与对照组相比,NMN并不会显著改变模型小鼠的生存时间。而后我们发现不同给药方式也不能显著改变小鼠溃疡性结肠炎的状态。最后我们又检测不同浓度的NMN对于肠炎小鼠的影响,发现300 mg/kg 剂量以下的NMN,对于模型小鼠的体重、DAI评分、结肠组织均不能引起显著性改变。因此,NMN对DSS诱导的溃疡性结肠炎小鼠并无影响。
综上,NMN具有广泛的人体生物调节作用,目前市面上出现了很多含有NMN的保健品。虽然我们的研究结果表明NMN对DSS诱导的溃疡性结肠炎模型小鼠无明显毒副作用,但是对于NMN的副作用仍需继续考察,特别是对于长期使用NMN的人群来说,充分考察其安全性尤为重要。
Effect of NMN on DSS induced ulcerative colitis in mice
-
摘要:
目的 探究烟酰胺单核苷酸(NMN)对葡聚糖硫酸钠盐(DSS)诱导的溃疡性结肠炎小鼠模型的作用。 方法 采用DSS诱导溃疡性结肠炎小鼠模型评价NMN的作用。应用DSS对C57小鼠进行造模,给予NMN后观察模型小鼠的生存时间、体重、疾病评分(DAI)、结肠组织长度以及结肠组织切片病理学变化。 结果 NMN对模型小鼠的生存时间、体重、DAI、肠道形态学变化等无显著性改变。 结论 NMN对DSS诱导的溃疡性结肠炎小鼠无显著作用。 Abstract:Objective To investigate the effects of Nicotinamide mononucleotide (NMN) on ulcerative colitis induced by dextran sulfate sodium (DSS) in mice. Methods DSS-induced ulcerative colitis mice were used to evaluate the effects of NMN. After NMN administration, the survival time, weight, disease activity index (DAI), colon tissue length and pathological changes of colon tissue slices were observed. Results NMN did not cause significant changes in the survival time, weight, DAI, and intestinal morphology of ulcerative colitis mice. Conclusion NMN has no significant effect on DSS-induced ulcerative colitis mice. -
Key words:
- nicotinamide mononucleotide /
- ulcerative colitis
-
脂肪性肝病(脂肪肝)是由各种原因引起的以肝细胞弥漫性脂肪变为病理特征的一种临床综合征,多数患者伴有代谢性疾病、心血管疾病与胆道系统疾病。根据流行病学调查研究显示:全球25%的成人患有脂肪肝,我国脂肪肝的患病率高达27%且有逐渐年轻化的趋势[1]。脂肪肝可逐步发展为肝炎、肝硬化甚至肝癌,故而早期干预脂肪肝的发展是保障广大人民健康与减轻国家医疗负担的重要举措。现代医学主要通过调整生活方式、应用抗肝损伤及抗代谢紊乱的药物(如他汀类)进行治疗。目前,中西医结合治疗脂肪肝越来越被当代社会推崇。降脂护肝胶囊是原湖州福音医院中医科老中医赵文敏主任医师多年的经验用方,于20世纪90年代已在该院推广使用,并形成院内协定处方。其由山楂、姜黄、茵陈、葛根和决明子五味中药组成,具有平肝降脂、活血化瘀的作用,将其与西药配合应用对脂肪肝的治疗效果显著[2-3],但其作用机制尚不明确。本文旨在应用网络药理学的方法对降脂护肝胶囊的作用机制进行探究,以期为日后的实验研究与临床应用提供一定的理论依据。
1. 材料与方法
1.1 药物靶点的筛选
本研究采用计算系统生物学实验室的中药系统药理学数据库和分析平台 (TCMSP;http://lsp. nwu.edu.cn/tcmsp.php) 与Traditional Chinese Medicines Integrated Database (TCMID;http://119.3.41.228:8000/tcmid/search/) 检索中药姜黄、茵陈、葛根和决明子的活性成分。因山楂在TCMSP数据库中未收录,笔者应用TCMID对山楂进行活性成分检索,利用TCMID对其余中药的活性成分进行补充。根据化合物口服生物利用度 (OB) 与类药性 (DL) 进行筛选,OB 阈值设为 OB≥30%,DL 阈值设为 DL≥0.18[4-5]。此外,由于齐墩果酸、熊果酸、葛根素、姜黄素和6,7-二甲氧基香豆素等化合物已被证实具有较好的降脂作用,而且在降脂护肝胶囊中的含量也较高,故将上述化合物也纳入活性成分范围内[6-8],并通过TCMSP数据库获取成分靶点。
1.2 疾病靶点的收集
以 “fatty liver” “liver steatosis”等为关键词检索 GeneCard(https://www.genecards.org/)数据库与OMIM数据库(https://omim.org/),收集与脂肪肝相关的作用靶点[9]。
1.3 构建化合物-靶点网络
为明确疾病靶点与药物靶点之间的关系,将两部分靶点进行交集,输入 Cytoscape软件构建化合物-靶点网络。Cytoscape 软件的核心架构是网络,每个节点是基因或活性成分,节点与节点之间的连接代表这些生物分子之间的相互作用,节点的度值代表网络中节点与节点相连的数目,度值越大说明该活性成分或靶点处于越核心的位置。
1.4 构建蛋白相互作用网络
为更深层次探究靶点之间的相互作用关系,将交集所得的共同靶点上传至线上软件String10.5 (http://stringdb.org),构建蛋白相互作用网络。物种选择为 Homosapiens,置信度设置为>0.9,其余参数保持默认设置,获取 PPI 网络。
1.5 生物过程与通路分析
利用 R Project 中的 org.Hs.eg.db 程序包(http://www.bioconductor.org/packages/ release /data /annotation/html/org.Hs.eg.db.html)将基因 symbols 转变为 Entrez IDs,进而利用 clusterProfiler 程序包(3.6 版)(http://bioconductor.org/packages http://bioconductor.org/packages/release/bioc/html/clusterProfiler.html)对网络进行 GO 分析和 KEGG 通路分析。设定 P<0.05,并按照涉及的靶点数目多少进行排序,获取 GO 富集分析的前20个条目以及 KEGG 富集的前 20 条信号通路[10]。
2. 结果
2.1 潜在活性成分的筛选与对应靶点的收集
通过TCMSP数据库检索到决明子活性成分68个,姜黄活性成分52个,葛根活性成分18个,茵陈活性成分53个,通过TCMID数据库检索到山楂活性成分94个,茵陈活性成分58个,姜黄活性成分109个,葛根活性成分51个,决明子活性成分57个。根据OB≥30%与DL≥0.18,筛选出决明子活性成分14个,葛根活性成分4个,茵陈活性成分13个,姜黄活性成分3个,山楂活性成分3个。将山楂中的齐墩果酸、熊果酸、咖啡酸、金丝桃苷、表儿茶素,葛根中的葛根素、黄豆苷元,姜黄中的姜黄素、双去甲氧基姜黄素、去甲氧基姜黄素、二氢姜黄素与茵陈中的滨蒿内酯,纳入活性成分范围。其中,MOL000358(β-谷甾醇)为茵陈和葛根的共有成分,MOL000953(胆甾烷醇)为姜黄和决明子的共有成分,MOL000449(豆甾醇)为决明子和姜黄的共有成分。按照类别计数符合标准的活性成分共计46个,部分化合物见表1。通过TCMSP数据库获取上述中药活性成分的靶点,除去重复靶点,共获得靶点133个。
表 1 降脂护肝胶囊部分活性成分化合物编号 化合物名称 口服生物利用度 类药性 MOL000953 胆甾烷醇 37.87 0.68 MOL000493 菜油甾醇 37.58 0.71 MOL005043 (3β,24R)-麦角甾-5-烯-3-醇 37.58 0.71 MOL000354 异鼠李素 49.60 0.31 MOL000358 β-谷甾醇 36.91 0.75 MOL004609 茵陈黄酮 48.96 0.41 MOL005573 芫花素 37.13 0.24 MOL007274 玄参黄酮 30.35 0.30 MOL008039 异茵陈黄酮 57.40 0.41 MOL008040 异泽兰素 46.11 0.33 MOL008041 泽兰素 42.55 0.37 MOL008043 茵陈色原酮 57.56 0.31 MOL008046 去甲氧基茵陈色原酮 52.33 0.25 MOL008047 阿特匹林A 68.32 0.24 MOL000098 槲皮素 46.43 0.28 MOL000392 芒柄花黄素 69.67 0.21 MOL006466 红镰玫素 45.55 0.24 MOL002959 3'-甲氧基大豆黄素 48.57 0.24 MOL003629 大豆苷元 47.27 0.67 MOL002268 大黄酸 47.07 0.28 MOL002281 决明内酯 46.46 0.24 MOL000449 豆甾醇 43.83 0.76 MOL000471 芦荟大黄素 83.38 0.24 2.2 疾病相关靶点的筛选
从GeneCard 与OMIM数据库去除重复基因后,获得与脂肪肝相关的靶点7406个。
2.3 化合物-靶点网络构建
将“2.1”中的133个降脂护肝胶囊活性成分靶点与“2.2”中的7406个脂肪肝靶点,输入Venny2.1软件绘制韦恩图,两者进行交集后,获得疾病-药物成分共同靶点118个,见图1。采用Cytoscape软件构建的活性成分-靶点网络,该网络共包含157个节点(39个化合物节点,118个靶点节点)和327条边,其中,红色节点表示化合物,绿色节点表示药物靶点,连接化合物与靶点的边表示它们之间有作用关系,见图2。表2列出了化合物-靶点网络中的关键节点、类别及其度值。活性成分度值排名前5位的是槲皮素(quercetin)、黄豆苷元(daidzein)、熊果酸(ursolic acid)、葛根素(puerarin)和异鼠李素(isorhamnetin),这5种化合物的节点数分别是71、37、27、25和16。靶点度值排名前5位的是前列腺素过氧化物合酶1(PTGS1)、核受体共激活因子2(NCOA2)、丝氨酸蛋白酶1(PRSS1)、雌激素受体2(ESR2)和雄激素受体(AR),分别能与26、17、13、11和11个化合物发生相互作用,体现了中药多成分、多靶点的特性。
表 2 化合物-靶点网络的关键节点及其度值名称 类别 度值 名称 类别 度值 槲皮素 化合物 71 芦荟大黄素 化合物 12 黄豆苷元 化合物 37 β-谷甾醇 化合物 12 熊果酸 化合物 27 芒柄花黄素 化合物 11 PTGS1 基因 26 ESR2 基因 11 葛根素 化合物 25 AR 基因 11 NCOA2 基因 17 ESR1 基因 11 异鼠李素 化合物 16 GSK3B 基因 10 PRSS1 基因 13 PPARG 基因 10 2.4 PPI 网络的构建与分析
应用String软件构建PPI网络(图3),在此网络图中包含103个节点、474条边,同时得到网络中关键靶点的频次 (图4)。根据“度值>均值”筛选出关键节点38个,包括:CCND1、ESR1、EGFR、RELA、FOS、NCOA1、MAPK8、APOB、IL6、NCOA2、PRKCA、RB1、AR、ATF2、RHOA、CASP3、CASP8、CCNB1、ERBB2、PCNA、VEGFA、CYP1A1、GSK3B、MYC、PPARG、CDKN1B、CTSD、HIF1A、P4HB、PSMD3、BARD1、BCL2、CHRM2、ESR2、IGFBP3、NOS3、PGR、PTPN6。度值最高的是CCND1,度值为17;其次为ESR1,度值为16;EGFR、RELA的度值为15,FOS、NCOA1度值为14。度值大的靶点提示在网络调控中起关键作用,且很可能是降脂护肝胶囊治疗脂肪肝的关键靶点。
2.5 GO与KEGG富集分析
GO富集条目(图5)主要包括:DNA结合转录因子结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合、核受体活性、配体激活转录因子活性、DNA结合转录激活活性、RNA聚合酶Ⅱ特异性、DNA结合转录激活活性、类固醇激素受体、类固醇结合、整合素结合、核受体结合等。KEGG富集信号通路(图6)主要包括:PI3K-Akt信号通路、人巨细胞病毒感染、癌症中的微小RNA、乙型肝炎、EB病毒感染等。其中,PI3K-Akt信号通路的靶点主要包括:GF、RTK、CK、CKR、GPCR、PKC、NOS、Raf、GSK3、Myc、CCND1、p27、Cyclin、p27Kip1、Bcl-2、CASP9、CREB、Mcl-1、NF-ĸB。乙型肝炎的靶点主要包括:Fas、JNK、c-Myc、SAPK、NF-ĸB、IĸB、Bcl2、CASP8、CASP3、CASP9、pRb、PKC、Survivin、ATF2、CREB、PCNA、Raf、AP-1、ELK-1、IL6(图7、图8)。
3. 讨论
中医学认为脂肪肝病位在肝,病因主要与过食肥甘厚腻、嗜酒无度有关,疾病早期多为脾失健运,痰湿内生,湿郁化热;疾病后期多见热灼营阴,炼液成痰,痰瘀互结,故而脂肪肝在早期应以清利湿热为主,在后期当在清利湿热的基础上佐以活血化瘀。临床上脂肪肝患者早期无特征性症状,故而容易被患者忽视,当疾病进展到一定程度,患者才来到医院寻求治疗。降脂护肝胶囊以清利湿热、祛瘀活血为治疗原则,对脂肪肝后期具有良好的治疗作用。方中山楂消食化积、行气活血、降脂化浊,茵陈清利湿热、疏肝护肝,两者针对痰瘀互结之病机根本,共为君药;葛根通经活络,解酒毒降脂为臣药;决明子清肝通便泄浊,姜黄活血行气为佐使药。现代药学研究表明,山楂的主要化学成分主要有槲皮素等黄酮类化学成分,以及熊果酸等三萜酸及绿原酸、柠檬酸等有机酸等。研究表明,其中总黄酮及三萜酸等化学成分是山楂降脂作用的主要活性成分,可以抑制低密度脂蛋白的氧化修饰,减少脂质过氧化物的形成,发挥降血脂的作用[11-13]。茵陈的化学成分主要有6,7-二甲氧基香豆素类、绿原酸、对羟基苯乙酮和挥发油等化学成分,这些成分也是茵陈的降脂和保肝的主要活性成分[14-16]。葛根的化学成分主要有葛根素等异黄酮化合物,这类化合物具有降脂和保肝作用,是葛根降脂作用的主要活性成分[17-19]。决明子的主要化学成分为蒽醌类物质,研究表明决明子蒽醌能减少肠道对胆固醇的吸收,增加排泄,能抑制血清胆固醇升高和主动脉粥样硬化斑点形成,能明显增加血清 HDL-C含量及提高HDL-C/TCM 比值,通过反馈调节 LDL代谢,降低血清胆固醇水平,延缓和抑制动脉粥样硬化斑块的形成,改善体内胆固醇的分布[20-21]。姜黄的主要化学成分为姜黄素类不饱和二酮类物质,研究表明姜黄素具有降低高脂血症大鼠血清TC及LDL-C的作用,对家兔的动脉粥样硬化形成也有抑制作用[22-23]。此外,姜黄还可以增强阿伐他汀的降血脂作用[24]。综上,降脂护肝胶囊具有明确的中医学理论指导与物质基础,本文旨在通过网络药理学探究降脂护肝胶囊的作用机制,以期推广其临床应用。
本研究运用网络药理学研究方法共筛选出降脂护肝胶囊中的活性成分39个,作用靶点118个,体现了中药多成分、多靶点联合作用的整体性和关联性的特点。根据“活性成分-靶点”网络结果,进一步得到排名前5的关键化合物为槲皮素、黄豆苷元、熊果酸、葛根素和异鼠李素。现代研究表明,槲皮素主要通过抗氧化应激与抑制炎症小体激活改善胰岛素抵抗,从而减少脂质堆积并调节脂质代谢[25-27];黄豆苷元在通过抗氧化改善脂代谢紊乱的同时可以调节能量代谢,其机制可能与棕色脂肪组织中解偶联蛋白1的表达增加有关[28-30];熊果酸与葛根素主要通过抑制炎症反应发挥减少脂肪堆积的作用,其作用机制主要与上调AMPK和PPARa的表达,及下调SREBP-lc和ACC的表达有关[31-33];现代研究表明,50 mg/kg剂量口服异鼠李素可以抑制小鼠肝内三酰甘油的含量,同时肝损伤标记物也得到相应改善,但其作用机制有待探究[34]。综上,降脂护肝胶囊可能是通过槲皮素、黄豆苷元、熊果酸、葛根素和异鼠李素等活性成分发挥抗氧化应激与抑制炎症反应干预脂肪肝的。
根据PPI网络分析结果和“活性成分-靶点”网络结果,降脂护肝胶囊干预脂肪肝的主要作用靶点有周期蛋白D1(CCND1)、雌激素受体1(ESR1)、表皮生长因子受体(EGFR)等,其中,CCND1与炎症反应和能量代谢有关;ESR1与EGFR除了与炎症反应相关外,还与血管生成有关,脂肪肝患者多伴有胰岛素抵抗,其并发症如肥胖症、高血压、糖尿病等可能会诱发新生血管疾病,如视网膜病变。GO功能富集分析结果发现,降脂护肝胶囊活性成分主要涉及氧化应激、细胞凋亡、炎症反应、激素抵抗等生物学过程;KEGG通路富集主要涉及PI3K-Akt信号通路、人巨细胞病毒感染、癌症中的微小RNA、乙型肝炎、EB病毒感染等信号通路,高相关度的通路主要包括炎症通路、病毒感染与癌症通路通路。PI3K-Akt可以调控各种不同细胞的功能,如代谢、生长、增殖、存活等;乙型肝炎通路主要与乙肝病毒感染的炎症反应相关。现代研究表明,脂肪肝与代谢以及炎症反应高度相关,在代谢紊乱的基础上,乙肝病毒感染使得炎症反应进一步加剧,可逐渐转变为不同类型的肝炎,若不及时干预可进一步发展为肝纤维化、肝硬化,甚至肝癌。
综上所述,降脂护肝胶囊可能是通过槲皮素、黄豆苷元、熊果酸、葛根素和异鼠李素等活性成分通过抑制炎症反应、抗氧化应激两条途径改善脂代谢,降低脂肪堆积,并防止脂肪肝进一步向肝癌方向转化,体现了一定的保肝作用。网络药理学分析是中医药基础研究的重要手段,但是基于中医药理论药材配伍的特点,还应当考虑中药活性成分的含量以及成分与成分之间的协同作用关系,这需要通过后续对海量数据处理算法的研发,此外,还需要通过实验验证网络药理学得出的结果以增强说服力。但无论如何,网络药理学的结果对临床应用与实验研究都具有一定的指导意义。
-
表 1 疾病评分
评分 体重下降(%) 大便性状 血便情况 0 无 正常 无 1 1~5 — — 2 5~10 半稀便 潜血 3 10~15 — — 4 ≥15 稀便 肉眼血便 注:“—”表示无此项评分。 -
[1] RAJMAN L, CHWALEK K, SINCLAIR D A. Therapeutic potential of NAD-boosting molecules: the in vivo evidence[J]. Cell Metab,2018,27(3):529-547. doi: 10.1016/j.cmet.2018.02.011 [2] OKABE K, YAKU K, TOBE K, et al. Implications of altered NAD metabolism in metabolic disorders[J]. J Biomed Sci,2019,26(1):34. doi: 10.1186/s12929-019-0527-8 [3] PODDAR S K, SIFAT A E, HAQUE S, et al. Nicotinamide mononucleotide: exploration of diverse therapeutic applications of a potential molecule[J]. Biomolecules,2019,9(1):E34. doi: 10.3390/biom9010034 [4] REVOLLO J R, KÖRNER A, MILLS K F, et al. Nampt/PBEF/Visfatin regulates insulin secretion in beta cells as a systemic NAD biosynthetic enzyme[J]. Cell Metab,2007,6(5):363-375. doi: 10.1016/j.cmet.2007.09.003 [5] JUKARAINEN S, HEINONEN S, RÄMÖ J T, et al. Obesity is associated with low NAD(+)/SIRT pathway expression in adipose tissue of BMI-discordant monozygotic twins[J]. J Clin Endocrinol Metab,2016,101(1):275-283. doi: 10.1210/jc.2015-3095 [6] LEE C F, CHAVEZ J D, GARCIA-MENENDEZ L, et al. Normalization of NAD+ redox balance as a therapy for heart failure[J]. Circulation,2016,134(12):883-894. doi: 10.1161/CIRCULATIONAHA.116.022495 [7] ZHAO Y, GUAN Y F, ZHOU X M, et al. Regenerative neurogenesis after ischemic stroke promoted by nicotinamide phosphoribosyltransferase-nicotinamide adenine dinucleotide cascade[J]. Stroke,2015,46(7):1966-1974. doi: 10.1161/STROKEAHA.115.009216 [8] LI C, ZHOU Y N, RYCHAHOU P, et al. SIRT2 contributes to the regulation of intestinal cell proliferation and differentiation[J]. Cell Mol Gastroenterol Hepatol,2020,10(1):43-57. doi: 10.1016/j.jcmgh.2020.01.004 [9] GHOSH S, DAPERNO M. Topical therapy in ulcerative colitis: always a bridesmaid but never a bride?[J]. Gastroenterology, 2015, 148(4): 701-704. [10] ORDÁS I, ECKMANN L, TALAMINI M, et al. Ulcerative colitis[J]. Lancet,2012,380(9853):1606-1619. doi: 10.1016/S0140-6736(12)60150-0 [11] YAN Y X, SHAO M J, QI Q, et al. Artemisinin analogue SM934 ameliorates DSS-induced mouse ulcerative colitis via suppressing neutrophils and macrophages[J]. Acta Pharmacol Sin,2018,39(10):1633-1644. doi: 10.1038/aps.2017.185 [12] FORD A C, MOAYYEDI P, HANAUER S B. Ulcerative colitis[J]. BMJ,2013,346:f432. doi: 10.1136/bmj.f432 [13] MOWAT C, COLE A, WINDSOR A, et al. Guidelines for the management of inflammatory bowel disease in adults[J]. Gut,2011,60(5):571-607. doi: 10.1136/gut.2010.224154 [14] JIA S H, LI Y, PARODO J, et al. Pre-B cell colony-enhancing factor inhibits neutrophil apoptosis in experimental inflammation and clinical Sepsis[J]. J Clin Invest,2004,113(9):1318-1327. doi: 10.1172/JCI19930 [15] MEIER F M, FROMMER K W, PETERS M A, et al. Visfatin/pre-B-cell colony-enhancing factor (PBEF), a proinflammatory and cell motility-changing factor in rheumatoid arthritis[J]. J Biol Chem,2012,287(34):28378-28385. doi: 10.1074/jbc.M111.312884 [16] MOSCHEN A R, KASER A, ENRICH B, et al. Visfatin, an adipocytokine with proinflammatory and immunomodulating properties[J]. J Immunol,2007,178(3):1748-1758. doi: 10.4049/jimmunol.178.3.1748 [17] STARR A E, DEEKE S A, NING Z B, et al. Proteomic analysis of ascending colon biopsies from a paediatric inflammatory bowel disease inception cohort identifies protein biomarkers that differentiate Crohn's disease from UC[J]. Gut,2017,66(9):1573-1583. doi: 10.1136/gutjnl-2015-310705 [18] XU T Y, ZHANG S L, DONG G Q, et al. Discovery and characterization of novel small-molecule inhibitors targeting nicotinamide phosphoribosyltransferase[J]. Sci Rep,2015,5:10043. doi: 10.1038/srep10043 [19] ZHANG S L, LI Z Y, WANG D S, et al. Aggravated ulcerative colitis caused by intestinal Metrnl deficiency is associated with reduced autophagy in epithelial cells[J]. Acta Pharmacol Sin,2020,41(6):763-770. doi: 10.1038/s41401-019-0343-4 [20] VERDIN E. NAD+ in aging, metabolism, and neurodegeneration[J]. Science,2015,350(6265):1208-1213. doi: 10.1126/science.aac4854 [21] PREISS J, HANDLER P. Biosynthesis of diphosphopyridine nucleotide. I. Identification of intermediates[J]. J Biol Chem,1958,233(2):488-492. [22] DE FIGUEIREDO L F, GOSSMANN T I, ZIEGLER M, et al. Pathway analysis of NAD+ metabolism[J]. Biochem J,2011,439(2):341-348. doi: 10.1042/BJ20110320 [23] FREDERICK D W, LORO E, LIU L, et al. Loss of NAD homeostasis leads to progressive and reversible degeneration of skeletal muscle[J]. Cell Metab,2016,24(2):269-282. doi: 10.1016/j.cmet.2016.07.005 [24] MOSCHEN A R, GERNER R, SCHROLL A, et al. A key role for Pre-B cell colony-enhancing factor in experimental hepatitis[J]. Hepatology,2011,54(2):675-686. doi: 10.1002/hep.24416 [25] HASMANN M, SCHEMAINDA I. FK866, a highly specific noncompetitive inhibitor of nicotinamide phosphoribosyltransferase, represents a novel mechanism for induction of tumor cell apoptosis[J]. Cancer Res,2003,63(21):7436-7442. -





 下载:
下载:








 下载:
下载: