-
浅部真菌病是军人的常见病和多发病,国内外对不同部队的多项调查研究表明,浅部真菌性皮肤病发病率在各类皮肤病中居于前列,尤其在南方、沿海地区和炎热季节[1-4],浅部真菌感染性皮肤病受到菌种、地域、机体免疫力、环境等多方面因素影响。目前抗真菌药物种类很多,主要有唑类、丙烯胺类、吗啉类、中草药等[5-6]。经调查发现,皮肤真菌感染治愈率不高,容易复发,患者用药依从性是影响疾病治愈率的重要因素[7-8]。低依从性在各类疾病治疗中普遍存在,会降低药物的治疗效果[9],因此,准确评估用药依从性对于制定有针对性的干预措施,提高患者的用药依从性十分重要。
学者Morisky于2008年发表了用药依从性量表(Morisky Medication Adherence Scale)[10],该量表为结构化的、包含8项量度的自我报告量表,最初用于高血压病的用药依从性分析,逐渐被广泛应用于其他疾病,特别是慢性疾病,如糖尿病、骨质疏松症等的用药依从性研究[11-12],国外较少有文献报道该量表对浅部真菌病用药依从性分析[13],国内未有关于Morisky量表对真菌感染疾病的应用。本研究基于Morisky量表进行适度修改,评估部队院校学员浅部真菌病用药依从性情况,了解该群体用药习惯、特点,为提高抗真菌药物治疗效果寻求解决方案。
-
①对某院校在校学员进行浅部真菌性皮肤病普查,包括手癣、足癣、体癣、股癣、头癣、花斑癣和甲癣,记录患病基本情况、既往病史、用药、生活习惯等情况,同时发放自制调查问卷,问卷由专家修订后制成电子问卷。由患有浅部真菌病病史且使用过抗真菌药物的学员现场填写问卷。②调查曾患有浅部真菌病学员用药依从性,采用8条目的Morisky量表,删除原量表中第五条“昨天您忘记服药了吗?”,因为该条目不适用于只需局部用药的浅部真菌病患者,而仍沿用其余7个条目作为学员浅部真菌病用药依从性评估的量表(见表1)。
表 1 修改版Morisky用药依从性量表
条目 评分标准 1. 您是否有时忘记服用抗真菌药(内服和外用)? 否(1) 是(0) 2. 在用药治疗的2周内,是否有一天或几天您忘记用药? 否(1) 是(0) 3. 用药期间当您觉得症状加重时,您是否未咨询医生而自行减药或停药? 否(1) 是(0) 4. 当您外出时,您是否有时忘记随身携带药物? 否(1) 是(0) 5. 当您觉得自己的皮肤病已经得到控制时,您是否停止继续用药? 否(1) 是(0) 6. 您是否觉得要坚持治疗计划有困难? 否(1) 是(0) 7. 您觉得按时按量用药很难吗? 从不(1)、偶尔(0.75)、有时(0.5)、经常(0.25)、总是(0) -
评分标准:条目1~6题的答案均设计为是非式,选为“否”记1分,选为“是”记0分。条目7依据里克特(Likert)5级评分法,分为从不、偶尔、有时、经常、总是等五个选项,分别赋值为1、0.75、0.5、0.25和0分。总分为各项评分之和,评分<5分,表示依从性低,评分≥5分且<7分表示依从性中等,评分=7分表示依从性高。
-
采用SPSS 22.0软件进行统计学处理,通过内部一致性系数(Cronbach’s α)进行量表信度检验,通过KMO(Kaiser-Meyer-Olkin)检验、Bartlett’s球形检验、探索性因子分析进行量表结构效度检验,采用Spearman相关性分析,P<0.05为差异有统计学意义。信度检验参考标准:Cronbach’s α高于0.8,信度高;α介于0.7~0.8之间,信度较好; α介于0.6~0.7之间,信度可接受;α小于0.6,信度不佳。效度检验参考标准:KMO值高于0.8,效度好;KMO值介于0.7~0.8之间,效度较好;KMO值介于0.6~0.7,效度一般;KMO值小于0.6,效度较差。
-
经过体检普查及病史资料询问,调查学员中曾患浅部真菌病且使用抗真菌药物治疗的学员243例,回收问卷243份,有效问卷242份,均为男性(见表2)。问卷结果显示,90.08%学员使用局部药物治疗,8.68%学员使用局部与系统药物联合治疗。抗真菌药物中唑类药物使用率最高,如咪康唑、酮康唑,其次是丙烯胺类(特比萘芬)、中药洗剂、复方制剂(曲安奈德益康唑、复方十一烯酸锌曲安奈德)等。
表 2 调查学员人口学特征
人口学变量 变量值 人数(n) 百分比(%) 在读学历 本科 234 96.69 研究生 8 3.31 年龄(岁) 16~18 25 10.33 19~21 127 52.48 22~24 64 26.45 25~27 20 8.26 28~30 3 1.24 >30 3 1.24 服役年限(年) <1 38 15.70 1~3 122 50.41 4~6 65 26.86 7~10 13 5.37 >10 4 1.65 -
用药依从性量表评分结果显示,评分最小值为0分,最大值为7分,平均分为3.90分,标准差2.13。根据问卷评分标准,在患病学员中,抗真菌药物用药依从性水平高的22例,占比9.09%;依从性水平中等的58例,占比23.97%;依从性水平低的162例,占比66.94%(见表3)。相关性分析显示,用药依从性水平与药物治疗效果满意度(r=0.351, P=0.000)、病程时长(r=−0.226, P=0.000)、疾病是否复发(r=−0.428, P=0.000)存在显著相关关系。单因素方差分析显示,依从性低、中、高水平的药物治疗效果满意度均有显著差异(F=13.132, P=0.000),依从性水平越高,药物疗效满意度越高(见表3);卡方检验显示,不同依从性水平的患病时长无显著差异(χ2=69.223,P=0.079);而不同依从性水平与疾病是否复发存在显著差异(χ2=31.851,P=0.000),依从性高的患者未复发比例(77.273%)显著高于平均值(43.388%),而低依从性中复发次数在3次以上患者比例(22.840%)显著高于平均值(16.116%),见表4。
表 3 抗真菌药物用药依从性水平与药物疗效满意度
依从性分类 频数 百分比(%) 中位数 依从性
平均值药物疗效满意度
平均值低 162 66.94 2.63 2.68±1.46 3.42±1.04 中 58 23.97 6 6.11±0.43 3.93±0.93 高 22 9.09 7 7±0.00 4.41±0.73 表 4 不同用药依从性水平的患病时长及复发情况
依从性
程度患病时长(例数,%) 复发次数(例数,%) 4周以内 5-12周 13周以上 0 1 2 ≥3 低 77(53.846) 20(13.986) 46(32.168) 53(32.716) 40(24.691) 32(19.753) 37(22.840) 中 27(69.231) 5(12.821) 7(17.948) 35(60.345) 14(24.138) 8(13.793) 1(1.724) 高 7(70.000) 2(20.000) 1(10.000) 17(77.273) 3(13.636) 1(4.545) 1(4.545) 总计 111(57.813) 27(14.063) 54(28.125) 105(43.388) 57(23.554) 41(16.942) 39(16.116) χ² 69.223 31.851 P 0.079 <0.01 -
对修改后的7条目Morisky用药依从性量表进行信度检验,采用内部一致性系数(Cronbach’s α)检验本研究量表Cronbach’s α系数为0.781,调整后Cronbach’s α系数0.790,大于0.70,表明该量表信度质量较好。
-
效度检验采用KMO检验、Bartlett’s球形检验来验证条目间是否适合进行因子分析。本研究KMO值为0.798,大于0.7,Bartlett’s球形检验值为440.866,P=0.000,提示修改版Morisky用药依从性量表效度较好。探索性因子分析(Exploratory factor analysis)对7条目测度问题进行因子提取,采用最大方差法进行因子载荷分析,结果显示因子载荷均大于0.5(见表5),表明在用药依从性单因素方面7条目聚合度较好,相关度高。
表 5 修改版Morisky用药依从性量表因子载荷
条目 因子载荷 1. 您是否有时忘记服用抗真菌药(内服和外用)? 0.687 2. 在用药治疗的2周内,是否有一天或几天您忘记用药? 0.729 3. 用药期间当您觉得症状加重时,您是否未咨询医生而自行减药或停药? 0.574 4. 当您外出时,您是否有时忘记随身携带药物? 0.618 5. 当您觉得自己的皮肤病已经得到控制时,您是否停止继续用药? 0.556 6. 您是否觉得要坚持治疗计划有困难? 0.751 7. 您觉得按时按量用药很难吗? 0.735 -
本研究采用修改版Morisky用药依从性量表,对某部队院校曾患浅部真菌性皮肤病学员用药依从性水平进行调研。结果显示,用药依从性水平高、中、低的占比分别为9.09%、23.97%、66.94%。患病学员整体用药依从性水平偏低,与国外文献[13]报道足癣病人用药依从性平均水平较为一致,该文献报道局部与系统用药高、中、低依从性平均水平分别为8.62%、24.55%、66.80%。本研究统计结果显示,用药依从性水平与药物治疗效果满意度呈正相关,表明依从性越好,治疗效果越好;与疾病是否复发存在负相关,表明依从性越好,浅部真菌病越不易复发;与患病病程时长存在负相关,表明用药依从性越低,病程越长。
-
目前国内未有Morisky量表对浅部真菌病用药依从性方面的研究。在对8条目Morisky用药依从性量表进行删减修改后,调整后Cronbach’s α系数为0.790,KMO值为0.798,7条目聚合度较好,量表信效度质量较高。与国外文献报道的Morisky量表用药依从性的信度和效度评价结果较为一致。因此,该量表对于研究浅部真菌病患者用药依从性具有一定的科学性,能够较好的了解患者用药情况,可以推广使用。
军人由于职业特殊性,浅部真菌病高发,影响部队的整体战斗力,研究抗真菌药物的用药依从性,了解特殊人群的用药习惯,并采取积极有效措施具有重要意义。本研究基于Morisky用药依从性量表,进行适当修改,对军校学员抗真菌药物用药依从性进行调研,发现用药依从性水平较低。研究发现[14],医务人员对患者进行用药教育、心理干预、简化治疗方案以及尽可能缩短治疗时间等措施有益于提高患者的口服或局部用药依从性。最常见的不依从行为主要有不按规定数量或次数用药和提前终止药物治疗。患者停止用药通常因为他们认为真菌感染已经治愈,提示抗真菌药物用药依从性受患者主观判断影响,且局部用药的依从性较全身用药依从性差[13,15]。经了解,大部分依从性差的学员在症状缓解后自行停药,未严格按照医嘱和说明书用药,外用药物不如口服药物应用方便,特别是夏季训练强度大,患病率高,外用药物不适感强,影响用药依从性。因此,学员前来就诊时,医生可提醒患病学员,用药一段时间后及时前来复查,将有助于其坚持用药,提高用药依从性,以使药物发挥最佳治疗效果。同时,基层医务人员需定期巡诊随访或电话随访,加强健康教育和合理用药宣讲,与学员之间建立良好沟通,使学员提高疾病认识,强化对日常生活的药物管理,选择适合自身的用药模式,从而改善用药依从性。
Investigation of medication adherence for superficial mycoses among students in a college based on Morisky Medication Adherence Scale
-
摘要:
目的 了解某部队院校学员浅部真菌病用药依从性。 方法 将8条目Morisky用药依从性量表修改为7条目量表,调查患病学员用药依从性,对修改版Morisky量表进行信度和效度分析。 结果 回收243份问卷,其中有效问卷242份,结果显示90.08%的学员采用局部用药治疗,8.68%的学员采用局部用药和全身用药联合治疗;抗真菌药物用药依从性高、中、低的患病学员比例分别为9.09%、23.97%、66.94%;修改版Morisky用药依从性量表信度分析,内部一致性系数(Cronbach’s α)为0.781,调整后Cronbach’s α系数为0.790,信度较好;效度分析KMO值0.798,Bartlett’s球形检验值440.866,P=0.000,效度较好;探索性因子分析提取1个因子,量表因子载荷值均大于0.5,量表条目聚合度较好。 结论 修改版Morisky用药依从性量表信度和效度较好,可以推广应用。院校学员浅部真菌病用药依从性水平较低,需采取有效措施,帮助学员加强日常用药管理,改善用药依从性。 Abstract:Objective To investigate the medication adherence of military academy students with superficial mycoses. Methods A 8-item Morisky medication adherence scale (MMAS) was modified into 7-item scale to evaluate the compliance of antifungal drugs in the sick students. The reliability and validity of the scale were analyzed. Results A total of 243 questionnaires were collected, of which 242 were valid questionnaires. 90.08% of the students took topical medication and 8.68% were treated both with topical and systematic combination. High, medium and low medication adherence rates as assessed by the modified MMAS were 9.09%, 23.97% and 66.94%, respectively. The reliability analysis showed that the internal consistency coefficient (Cronbach’s α ) was 0.781, and the adjusted Cronbach’s α was 0.790, indicating the high reliability of the scale. The KMO value was 0.798, and the Bartlett’s spherical test value was 440.866, P=0.000. One factor was extracted by exploratory factor analysis. The factor loadings of the items were all above 0.5. Therefore, the high convergent validity was good. Conclusion The modified MMAS has good reliability and validity and is applicable for the evaluation of medication compliance for superficial mycoses. In this study, the military students have a low level of medication adherence for superficial mycoses. Effective measures should be taken to help students strengthen their daily medication management and improve compliance. -
Key words:
- superficial mycoses /
- medication adherence /
- scale /
- students
-
玄参别名元参、黑参、浙玄参等,为我国传统大宗药材,主产地为浙江、安徽、四川、贵州等地[1-2]。玄参,始载于《神农本草经》,被列为中品,味甘、苦、咸,性微寒[3];归肺、胃、肾经,具有清热凉血,滋阴降火,解毒散结的功效,常用于热病伤阴,舌绛烦渴,津伤便秘、目赤、咽痛等症[4-5]。环烯醚萜苷类是玄参的主要有效成分,包括哈巴苷、哈巴俄苷等,临床上主要用于脑缺血、高血压、糖尿病等疾病,具有抗炎、保护心血管、抗肿瘤、免疫调节等作用[6-9]。
关于不同产地玄参有效成分含量测定的报道较少,仅有的报道也只集中在少数产地[10-11]。玄参药材原植物生长环境差别大,不同的生境因子下药材质量参差不齐,且在栽培过程中,栽培品系繁多混杂,严重阻碍了玄参产业的可持续发展。2020版《中国药典》规定将哈巴苷、哈巴俄苷作为玄参药材的质控成分,现代药理学研究也表明哈巴苷、哈巴俄苷具有保护心血管、保护神经的药理作用[12-13]。因此,课题组以哈巴苷和哈巴俄苷成分为指标性成分,收集全国玄参15个主产区玄参种质资源,建立HPLC法对其进行含量测定,分析不同产地玄参环烯醚萜苷类成分之间的差异性,以期为玄参药材质量控制提供理论依据。
1. 材料与方法
1.1 药材
2019年11月至2019年12月,收集浙江磐安、安徽谯城区、贵州阳溪、河南朱庄、四川陇东等15个产地新鲜玄参种质资源,经浙江中医药大学药学教研室秦路平教授鉴定为玄参科植物玄参(Scrophularia ningpoensis Hemsl.)的干燥根,信息见表1。
表 1 不同产地玄参样品信息编号 产地 经度(°) 纬度(°) 海拔(l/m) 降雨量(l/mm) 年平均温度(t/℃) S1 浙江磐安 120.43 29.05 1020 1440.1 17.4 S2 浙江临安 119.72 30.23 1050 1463.3 16.2 S3 杭州植物园 120.13 30.27 25 1400.3 16.1 S4 安徽涡阳 116.22 33.52 40 809.8 15.1 S5 安徽谯城区 115.77 33.88 35 805.0 14.5 S6 安徽利辛 116.20 33.15 22 823.9 14.8 S7 河南太丘 116.13 33.93 32 740.5 14.3 S8 河南南丰 115.20 33.65 34 738.6 14.6 S9 河南朱庄 114.51 33.01 33 740.5 14.3 S10 四川陇东 102.71 30.48 1428 1000.0 12.6 S11 四川永富 102.65 30.55 1456 984.6 13.4 S12 四川五龙 102.77 30.40 1410 993.4 12.5 S13 贵州洛龙 107.71 29.06 832 1170.4 22.1 S14 贵州阳溪 107.57 29.07 1300 1100.3 16.3 S15 贵州玉溪 107.36 29.05 1324 1070.3 15.6 1.2 仪器与试剂
Waters Alliance e2695型高效液相色谱仪(美国Waters公司);ZORBAX Eclipse C18色谱柱(250 mm×4.6 mm, 5 μm);XS105型电子分析天平(梅特勒-多利多公司);超纯水仪(美国Millipore公司);DXF–60D型中药打粉机(广州市大祥电子机械设备有限公司);KQ–300DV型超声波(广州颖汉科技有限公司);DHG–9031A型电热恒温鼓风干燥箱(上海森信试验仪器有限公司)。哈巴苷(B20481)、哈巴俄苷(B20480)对照品均购于上海源叶生物科技有限公司。乙腈(色谱级,美国天地公司),磷酸(色谱级,上海阿拉丁公司),其余试剂均为分析纯。
1.3 方法
1.3.1 色谱条件
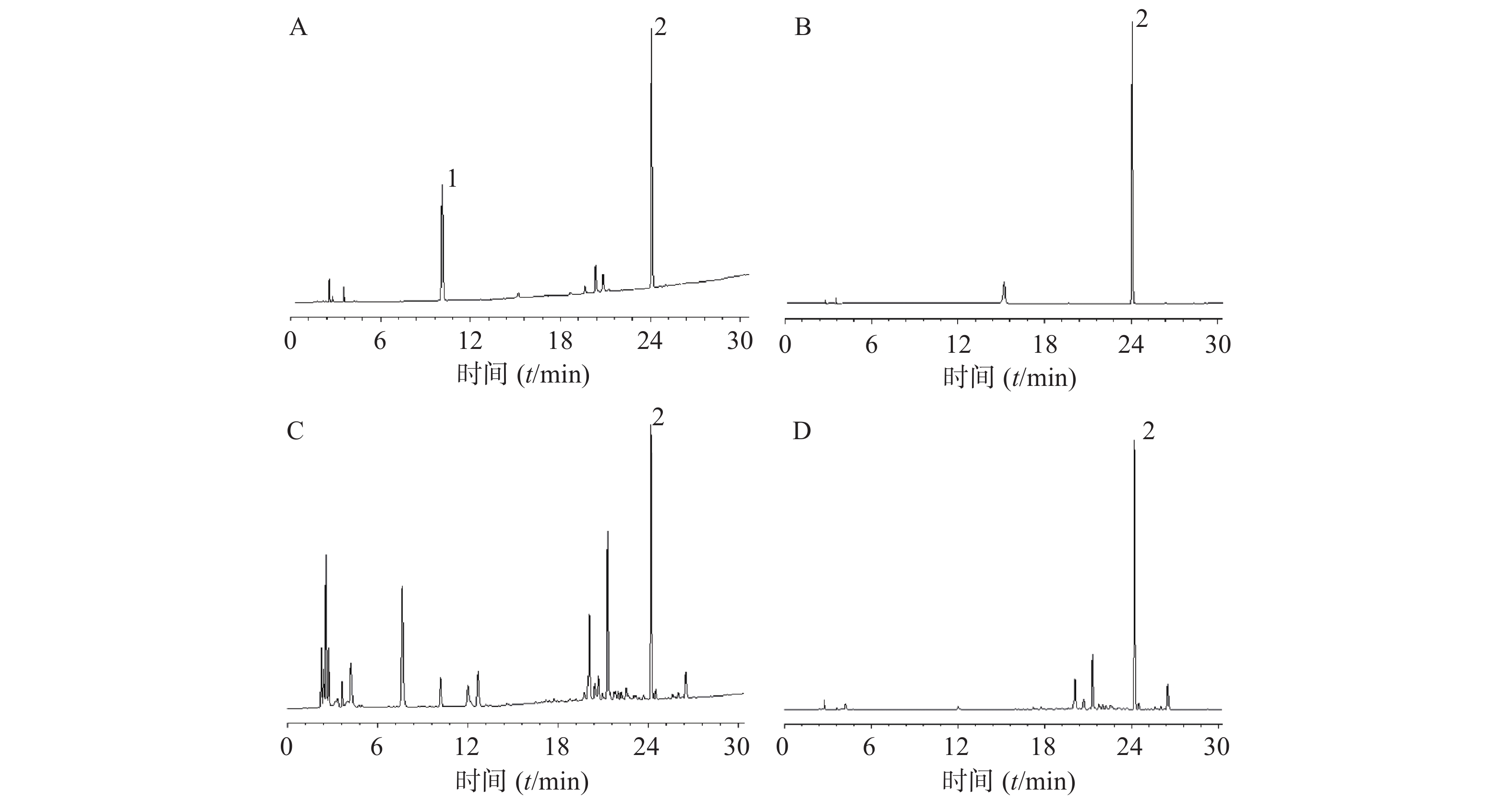
ZORBAX Eclipse Plus C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)–0.03%磷酸水溶液(B),梯度洗脱(1~10 min,3%~10% A;10~20 min,10%~33% A;20~25 min,33%~50% A;25~30 min,50%~80% A;30~35 min,80% A;35~37 min,80%~3% A;37~42 min,3% A);体积流量1.0 ml/min,柱温30 ℃,进样量为10 μl;检测波长为210、280 nm。色谱图见图1。
1.3.2 线性关系考察
精密称取哈巴苷、哈巴俄苷对照品适量,用30%甲醇溶液制备成终质量浓度为每1 ml含哈巴苷0.6 mg、哈巴俄苷0.2 mg的混合对照品溶液,于4 ℃冰箱中保存备用。分别精密吸取哈巴苷、哈巴俄苷混合对照品溶液0.34、0.67、1.00、1.40、1.70 ml置于2 ml容量瓶中,30%甲醇溶液定容至2 ml,吸取上述溶液适量,0.45 μm微孔滤膜过滤,按“1.3.1”项下色谱条件依次进样。哈巴苷的检测波长为210 nm,哈巴俄苷的检测波长为280 nm。以对照品溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表2,可知哈巴苷与哈巴俄苷在各自范围内线性关系良好。
表 2 线性关系考察成分 回归方程 线性范围 r 哈巴苷 Y=2964.3X+5156.4 0.1020~0.5100 mg/ml 0.9999 哈巴俄苷 Y=13919X+366.1 0.0340~0.1700 mg/ml 0.9999 1.3.3 供试品溶液制备
将洗净后的玄参根切片,置于60 ℃烘箱中烘至恒定质量,粉碎后过3号筛。精密称取玄参根样品粉末0.25 g,置于25 ml具塞锥形瓶中,精密加入50%甲醇溶液25 ml,密塞,称定重量,浸泡1 h,超声处理45 min(300 W, 40 kHz),放冷,再称定重量,用50%甲醇溶液补足损失的重量,摇匀,用0.45 μm微孔滤膜过滤,取续滤液,即得。按“1.3.1”项下色谱条件平行测定3次。
1.3.4 精密度试验
精密吸取哈巴苷、哈巴俄苷对照品溶液适量,按“1.3.1”项下色谱条件依次进样6次,测得哈巴苷、哈巴俄苷峰面积RSD分别为0.11%、0.09%,表明仪器精密度良好。
1.3.5 稳定性试验
取浙江磐安样品,按“1.3.3”项下方法制备供试品溶液,分别于0、2、4、8、12、18、24 h,按“1.3.1”项下色谱条件进样,测得哈巴苷、哈巴俄苷峰面积RSD分别为0.24%、0.17%,表明供试品溶液在24 h内稳定性良好。
1.3.6 重复性试验
取浙江磐安样品6份,按“1.3.3”项下方法制备供试品溶液,按“1.3.1”项下色谱条件进样,测得哈巴苷、哈巴俄苷含量的RSD分别为0.59%、0.50%,表明该方法重复性良好。
1.3.7 加样回收率试验
取含量已知的浙江磐安样品,精密称定0.125 g, 加入哈巴苷、哈巴俄苷对照品适量,按“1.3.3”项下方法制备成供试品溶液,按“1.3.1”项下色谱条件进样,计算回收率,结果见表3。
表 3 加样回收率试验结果(n=6)成分 称样量(m/g) 原有量(m /mg) 加入量(m /mg) 测得量(m /mg) 回收率(%) 平均回收率(RSD)(%) 哈巴苷 0.1251 0.0748 0.0748 0.1478 0.9759 97.44(0.93) 0.1250 0.0748 0.0748 0.1476 0.9733 0.1251 0.0748 0.0748 0.1486 0.9866 0.1254 0.0750 0.0750 0.1482 0.9760 0.1253 0.0749 0.0749 0.1480 0.9760 0.1251 0.0748 0.0748 0.1465 0.9586 哈巴俄苷 0.1250 0.1065 0.1065 0.2093 0.9653 97.08(1.24) 0.1254 0.1068 0.1068 0.2126 0.9906 0.1252 0.1067 0.1068 0.2089 0.9569 0.1251 0.1066 0.1068 0.2109 0.9766 0.1253 0.1068 0.1068 0.2096 0.9625 0.1251 0.1066 0.1068 0.2105 0.9728 1.4 数据处理与分析
应用SPSS 19.0软件处理数据。方差分析采用单因素ANOVA分析,聚类分析采用组间连接法[14]。
2. 结果与分析
2.1 哈巴苷与哈巴俄苷含量比较
15个产地间玄参根中哈巴苷、哈巴俄苷的含量存在统计学差异(P<0.01),结果见表4。哈巴苷、哈巴俄苷含量以及两者总量分别为0.791、0.228、1.265 mg/g。四川陇东产哈巴苷含量最高、安徽谯城区含量最低;浙江磐安产哈巴俄苷含量最高,四川永富含量最低;四川陇东产哈巴苷与哈巴俄苷总量最高,杭州植物园最低,含量范围在0.752~1.529 mg/g之间,均符合《中国药典》2020版质量标准。
表 4 不同产地间玄参样品中各成分含量测定结果($\bar x \pm s$ ,n=3,mg/g)样品 哈巴苷含量 哈巴俄苷含量 哈巴苷与哈巴俄苷总量 S1 0.598±0.003 0.852±0.003 1.450±0.006 S2 0.979±0.002 0.520±0.004 1.499±0.006 S3 0.600±0.007 0.152±0.009 0.752±0.013 S4 0.625±0.003 0.542±0.003 1.167±0.004 S5 0.489±0.002 0.831±0.008 1.320±0.009 S6 0.558±0.003 0.615±0.006 1.173±0.009 S7 0.730±0.021 0.626±0.017 1.355±0.038 S8 0.921±0.007 0.563±0.006 1.484±0.002 S9 0.642±0.004 0.655±0.004 1.297±0.008 S10 1.147±0.006 0.382±0.002 1.529±0.008 S11 0.992±0.016 0.036±0.002 1.029±0.017 S12 0.560±0.002 0.422±0.001 0.983±0.002 S13 0.759±0.006 0.385±0.005 1.144±0.009 S14 1.120±0.009 0.234±0.015 1.355±0.024 S15 1.140±0.007 0.297±0.294 1.434±0.010 均值 0.791** 0.228** 1.265** **P<0.01,表示不同产地的哈巴苷或哈巴俄苷含量存在极显著差异。 2.2 相关性分析
对不同产地之间中的有效成分与生境因子进行相关性分析,结果如表5所示,哈巴苷与海拔、降雨量、年平均温度呈正相关关系,与海拔正相关系数最高为(0.440);与经度、纬度之间呈负相关关系,与经度负相关系数最高为(–0.419)。哈巴俄苷与经度、纬度呈正相关,与海拔、降雨量、年平均温度呈负相关,与海拔负相关系数最高为(–0.360)。
表 5 玄参中哈巴苷、哈巴俄苷含有量与生境因子相关性分析项目 哈巴苷 哈巴
俄苷经度 纬度 海拔 年降
雨量年平均
温度哈巴苷 1.000 哈巴俄苷 −0.553 1.000 经度 −0.419 0.572 1.000 纬度 −0.341 0.506 0.370 1.000 海拔 0.440 −0.360 −0.620* −0.768** 1.000 年降雨量 0.098 −0.243 0.184 −0.795** 0.508 1.000 年平均温度 0.079 −0.237 −0.005 −0.507 0.009 0.363 1.000 *P<0.05,表示显著相关;**P<0.01,表示极显著相关。 2.3 聚类分析
以哈巴苷、哈巴俄苷含量以及两者总量为参考指标,对15个产地玄参进行聚类分析,根据欧式距离D2=19.98将不同产地划分为3个类群,如图2所示。类群I共5个产地,分别为浙江临安,河南南丰,贵州阳溪、玉溪,四川陇东,该类玄参中哈巴苷含量、哈巴苷和哈巴俄苷总量最高;类群II有8个产地、分别为贵州洛龙,四川五龙,安徽利辛、谯城区、涡阳,浙江磐安,河南太丘、朱庄,这些产地哈巴俄苷含量次之;类群III共有2个产地,分别是四川永富和杭州植物园,这两个产地的哈巴俄苷含量、哈巴苷和哈巴俄苷总量最低。
3. 讨论与结论
本试验采用高效液相法测定玄参哈巴苷与哈巴俄苷含量,经PDA检测器对哈巴苷和哈巴俄苷标准品溶液进行波长扫描,结果显示,哈巴苷的最大检测波长是210 nm,与溶剂甲醇的吸收波长一致,此处会有溶剂峰的出现,而哈巴俄苷的最大检测波长是280 nm,此时基线平稳,未与溶剂峰相重叠,因此,确定检测波长为210 nm和280 nm;采用2020版《中国药典》中哈巴苷与哈巴俄苷的含量测定的提取方法及流动相,结果显示,提取、分离效果良好,哈巴苷与哈巴俄苷在甲醇中超声处理45 min即可提取完全,各峰之间的分离度>1.5,理论塔板数>5000,哈巴苷与哈巴俄苷的保留时间分别是10.107、24.116 min。
药用植物的生长环境对次生代谢产物的积累起着非常关键的作用,包括经纬度、海拔、降雨量等[14]。本实验结果显示,15个产地玄参根中哈巴苷、哈巴俄苷的含量存在统计学差异(P<0.01),其中四川陇东、河南南丰、浙江临安、磐安含量最高;海拔、降雨量、年平均温度与哈巴苷之间呈正相关,与哈巴俄苷呈负相关。课题组发现,浙江临安、磐安的海拔分别是1050 m、1020 m,远高于杭州植物园的25 m,因此,临安、磐安哈巴苷的含量要高于植物园,这与实验结果一致;经纬度与哈巴俄苷呈正相关,且相关系数较大,经纬度越高,哈巴俄苷的含量就越大,四川陇东、永富、五龙的经纬度低于安徽利辛、涡阳、谯城区,因此,前者的哈巴俄苷的含量低于后者。结果显示,经纬度越高越有利于哈巴俄苷的积累,降雨量越大,海拔越高,越有利于哈巴苷的积累,故可优先在拥有上述环境条件的种质中选择。本实验只对玄参中哈巴苷、哈巴俄苷的含量进行测定,下一步将继续增加其他活性成分的含量测定,为玄参的质量控制提供参考依据。
-
表 1 修改版Morisky用药依从性量表
条目 评分标准 1. 您是否有时忘记服用抗真菌药(内服和外用)? 否(1) 是(0) 2. 在用药治疗的2周内,是否有一天或几天您忘记用药? 否(1) 是(0) 3. 用药期间当您觉得症状加重时,您是否未咨询医生而自行减药或停药? 否(1) 是(0) 4. 当您外出时,您是否有时忘记随身携带药物? 否(1) 是(0) 5. 当您觉得自己的皮肤病已经得到控制时,您是否停止继续用药? 否(1) 是(0) 6. 您是否觉得要坚持治疗计划有困难? 否(1) 是(0) 7. 您觉得按时按量用药很难吗? 从不(1)、偶尔(0.75)、有时(0.5)、经常(0.25)、总是(0) 表 2 调查学员人口学特征
人口学变量 变量值 人数(n) 百分比(%) 在读学历 本科 234 96.69 研究生 8 3.31 年龄(岁) 16~18 25 10.33 19~21 127 52.48 22~24 64 26.45 25~27 20 8.26 28~30 3 1.24 >30 3 1.24 服役年限(年) <1 38 15.70 1~3 122 50.41 4~6 65 26.86 7~10 13 5.37 >10 4 1.65 表 3 抗真菌药物用药依从性水平与药物疗效满意度
依从性分类 频数 百分比(%) 中位数 依从性
平均值药物疗效满意度
平均值低 162 66.94 2.63 2.68±1.46 3.42±1.04 中 58 23.97 6 6.11±0.43 3.93±0.93 高 22 9.09 7 7±0.00 4.41±0.73 表 4 不同用药依从性水平的患病时长及复发情况
依从性
程度患病时长(例数,%) 复发次数(例数,%) 4周以内 5-12周 13周以上 0 1 2 ≥3 低 77(53.846) 20(13.986) 46(32.168) 53(32.716) 40(24.691) 32(19.753) 37(22.840) 中 27(69.231) 5(12.821) 7(17.948) 35(60.345) 14(24.138) 8(13.793) 1(1.724) 高 7(70.000) 2(20.000) 1(10.000) 17(77.273) 3(13.636) 1(4.545) 1(4.545) 总计 111(57.813) 27(14.063) 54(28.125) 105(43.388) 57(23.554) 41(16.942) 39(16.116) χ² 69.223 31.851 P 0.079 <0.01 表 5 修改版Morisky用药依从性量表因子载荷
条目 因子载荷 1. 您是否有时忘记服用抗真菌药(内服和外用)? 0.687 2. 在用药治疗的2周内,是否有一天或几天您忘记用药? 0.729 3. 用药期间当您觉得症状加重时,您是否未咨询医生而自行减药或停药? 0.574 4. 当您外出时,您是否有时忘记随身携带药物? 0.618 5. 当您觉得自己的皮肤病已经得到控制时,您是否停止继续用药? 0.556 6. 您是否觉得要坚持治疗计划有困难? 0.751 7. 您觉得按时按量用药很难吗? 0.735 -
[1] 刘慧民, 刘玉明, 陈向齐, 等. 军队浅部真菌病发病现状及中草药防治研究进展[J]. 中国医药导报, 2014, 11(7):163-165. [2] GREGORY J F, TAYLOR E A, LIU Y E, et al. The burden of skin disease on deployed servicemembers[J]. Mil Med,2019,184(11-12):889-893. doi: 10.1093/milmed/usz110 [3] 郭运达, 孙风清, 冷玉新, 等. 某沿海执勤部队官兵夏季皮肤病患病情况调查[J]. 人民军医, 2019, 62(2):111-114. [4] 郭蓉, 朱红梅. 某部长远航舰员真菌等感染性皮肤病调查[J]. 中国真菌学杂志, 2019, 14(3):169-170. doi: 10.3969/j.issn.1673-3827.2019.03.009 [5] CAMPOY S, ADRIO J L. Antifungals[J]. Biochem Pharmacol,2017,133:86-96. doi: 10.1016/j.bcp.2016.11.019 [6] 高璐, 吴建美, 曲琳. 中药对皮肤浅部真菌病抑制作用的研究进展[J]. 四川中医, 2021, 39(1):218-221. [7] 中国手癣和足癣诊疗指南工作组. 中国手癣和足癣诊疗指南(基层实践版2020)[J]. 中国真菌学杂志, 2020, 15(6):325-330. doi: 10.3969/j.issn.1673-3827.2020.06.002 [8] 赵广, 杨庆琪, 那爱华. 东南沿海部队皮肤浅部真菌病的调查研究[J]. 中国真菌学杂志, 2007, 2(5):270-272. doi: 10.3969/j.issn.1673-3827.2007.05.005 [9] MCDONALD H P, GARG A X, HAYNES R B. Interventions to enhance patient adherence to medication prescriptions: scientific review[J]. JAMA,2002,288(22):2868-2879. doi: 10.1001/jama.288.22.2868 [10] MORISKY D E, ANG A, KROUSEL-WOOD M, et al. Predictive validity of a medication adherence measure in an outpatient setting[J]. J Clin Hypertens (Greenwich),2008,10(5):348-354. doi: 10.1111/j.1751-7176.2008.07572.x [11] KOTHAWALA P, BADAMGARAV E, RYU S, et al. Systematic review and meta-analysis of real-world adherence to drug therapy for osteoporosis[J]. Mayo Clin Proc,2007,82(12):1493-1501. doi: 10.1016/S0025-6196(11)61093-8 [12] MOON S J, LEE W Y, HWANG J S, et al. Accuracy of a screening tool for medication adherence: a systematic review and meta-analysis of the Morisky Medication Adherence Scale-8[J]. PLoS One,2017,12(11):e0187139. doi: 10.1371/journal.pone.0187139 [13] TSUNEMI Y, ABE S, KOBAYASHI M, et al. Adherence to oral and topical medication in 445 patients with Tinea pedis as assessed by the Morisky Medication Adherence Scale-8[J]. Eur J Dermatol,2015,25(6):570-577. doi: 10.1684/ejd.2015.2650 [14] GUPTA G, MALLEFET P, KRESS D W, et al. Adherence to topical dermatological therapy: lessons from oral drug treatment[J]. Br J Dermatol,2009,161(2):221-227. doi: 10.1111/j.1365-2133.2009.09253.x [15] FURUE M, ONOZUKA D, TAKEUCHI S, et al. Poor adherence to oral and topical medication in 3096 dermatological patients as assessed by the Morisky Medication Adherence Scale-8[J]. Br J Dermatol,2015,172(1):272-275. doi: 10.1111/bjd.13377 -





 下载:
下载:

 下载:
下载: 

