-
抗菌肽是一种存在于各种生物体内的防御性多肽,是生物进化过程中留存的重要先天免疫组成部分[1]。鱼类是抗菌肽的重要来源之一,已被发现的鱼类抗菌肽已达上百种。Epinecidin-1抗菌肽于2006年首次从石斑鱼白细胞的cDNA文库被鉴定发现,其基因由3个内含子和4个外显子组成,编码一种由25个氨基酸(序列为FIFHIIKGLFHAGKMIHGLVTRRRH)组成的成熟抗菌肽。这种抗菌肽的分子量为2985.63,等电点为 12.31。Epinecidin-1抗菌肽属于piscidins 家族,具有两亲性的α-螺旋结构,两侧含有疏水和亲水残基,能破坏病原体细胞膜的完整性从而达到杀伤作用[2]。通常,Epinecidin-1抗菌肽mRNA在石斑鱼的各种器官组织中均能表达,尤其是在头肾、腮、皮肤等部位。在细菌脂多糖的刺激下,石斑鱼头肾内Epinecidin-1抗菌肽 mRNA的转录表达量显著增加,翻译出更多的Epinecidin-1抗菌肽用来抵御外来病原微生物的侵入[3]。
由于从生物样品中获得研究所需的大量抗菌肽相当困难,因此抗菌肽的化学合成已成为首选方法[4]。Epinecidin-1抗菌肽可以采用Fmoc固相多肽合成法制备获得,并通过反相高效液相色谱法与质谱法分别对其进行纯化与分析。与完整的Epinecidin-1抗菌肽相比,合成的21聚体Epinecidin-1抗菌肽也能保护鱼类免受感染,但总体活性较低。尽管如此,由于合成短肽更具成本效益,大多数研究还是选择21聚体Epinecidin-1抗菌肽,并在C端酰胺化,用以改善其抗菌活性[5]。合成的Epinecidin-1抗菌肽具有多种药理活性,包括抗病原微生物、免疫调节、抗癌、伤口愈合等,已被用于局部伤口的愈合治疗以及提高水产养殖鱼类的免疫力方面[6]。本文旨在介绍Epinecidin-1抗菌肽的作用机制、药理活性、局限性以及应用前景方面的研究进展,为进一步研究与应用提供借鉴。
-
虽然大量研究已经发现Epinecidin-1抗菌肽具有抗微生物、免疫调节、促伤口愈合活性等生物活性,但其作用机制还未完全明确。目前研究认为,Epinecidin-1抗菌肽的作用方式可分为直接杀伤作用与免疫调节作用。
-
抗菌肽的抗菌作用可部分归因于抗菌肽所带的正电荷与细菌表面的负电荷结构成分产生的静电吸引作用,而这种静电作用可以使抗菌肽非特异性吸附到细菌表面进行直接杀伤。根据酰胺化Epinecidin-1抗菌肽的结构,研究者已经提出几种不同的直接杀伤机制模型。一种作用机制是“地毯”模型。在该模型中,Epinecidin-1抗菌肽附着到目标细胞膜的磷脂头部基团而不插入疏水区域,通过中断膜曲率诱导膜崩解。另一种机制是“桶形”模型,即Epinecidin-1抗菌肽的两亲性α-螺旋直接插入细胞膜的亲脂性区域并产生跨膜孔,直接破坏细胞膜的完整性致其死亡[2]。Narayana等[7]通过透射电子显微镜发现Epinecidin-1处理的幽门螺杆菌以“鬼影”细胞(细胞核溶解消失,残留细胞轮廓)的形式出现,并提出Epinecidin-1选择性诱导细菌膜的负高斯曲率,引起膜的破坏以及跨膜孔的形成,进而使细胞的内容物泄漏并致其死亡。此外,研究者还提出了“环形”模型、“聚集”通道模型假说来解释抗菌肽的直接杀伤作用[8]。
-
除直接对膜的破坏杀伤作用外,Epinecidin-1抗菌肽能与宿主免疫细胞上的外膜蛋白或胞内蛋白相互作用,刺激多种信号转导途径,调节免疫相关基因并增加促炎细胞因子的产生与释放,从而增强宿主对细菌、病毒等病原体的免疫反应[9]。Su等[10]研究证明了Epinecidin-1抗菌肽可以通过抑制Toll样受体的内化以及增强下游信号(活性氧、Akt、p38和核因子κB)的传导来减轻G+菌磷壁酸所诱导的宿主炎症。Huang等[11]利用转录组测序技术与实时荧光定量PCR技术研究了Epinecidin-1抗菌肽在石斑鱼脾脏淋巴细胞的免疫调节作用。结果显示,该抗菌肽能显著上调白介素-1β、肿瘤坏死因子α、T细胞抗原受体以及主要组织相容性复合体,并通过上调细胞周期相关基因的表达来促进脾脏淋巴细胞的增殖。此外, Epinecidin-1还能通过上调斑马鱼中细胞骨架角蛋白和原肌球蛋白等基因的表达来稳定宿主细胞骨架,从而增强宿主对病原体的抗性[12]。
-
在体内外研究中,Epinecidin-1抗菌肽表现出对多种海洋G−菌、G+菌以及真菌的广谱抗菌活性,包括多种弧菌属、气单胞菌属、肠杆菌科、脑膜炎黄杆菌等 [2]。Epinecidin-1抗菌肽对部分耐药菌也具有很强的抗菌活性。Huang等[13]研究发现,2.5 mg/kg静脉给药Epinecidin-1抗菌肽可使耐甲氧西林的金黄色葡萄球菌(MRSA)感染的猪完全存活,而万古霉素治疗组存活率仅为80%。该抗菌肽可显著减少感染MRSA猪体内的细菌数,并有效控制MRSA诱导的炎症。Pan等[14]研究发现,Epinecidin-1抗菌肽对抗生素耐药的铜绿假单胞菌具有良好的抗菌活性,其对耐药铜绿假单胞菌的最小抑菌浓度(3.12 µg/ml)比亚胺培南(200 µg/ml)更低。Narayana等[7]研究了Epinecidin-1抗菌肽对不同幽门螺杆菌的作用。该抗菌肽的最小抑菌浓度和最小杀菌浓度分别为8~12 µg/ml与12.5~25 µg/ml,其对幽门螺杆菌的杀菌作用呈现剂量与时间依赖性。幽门螺杆菌在含2倍或1倍最小抑菌浓度的抗菌肽培养基内分别培养1 h与12 h后,细菌计数均能降低99%。Chen等[15]通过电子显微镜观察到Epinecidin-1抗菌肽能使白色念珠菌的细胞膜破裂、收缩,其最小抑菌浓度为25 µg/ml。
此外,Epinecidin-1抗菌肽可抑制多种类型的病毒,包括口蹄疫病毒,神经坏死病毒和日本脑炎病毒等。低浓度Epinecidin-1抗菌肽(6.2 µg/ml)可阻断口蹄疫病毒进入仓鼠肾细胞,而高浓度Epinecidin-1抗菌肽(125 µg/ml)对口蹄疫病毒有较强的杀伤作用[16]。Epinecidin-1抗菌肽与日本脑炎病毒共注射可以显著激活辅助型T细胞2来诱导脑炎病毒抗体的产生,调节免疫应答基因的表达,最终增强宿主对病毒的抗性[17]。
除广谱抗菌与抗病毒外,还有研究发现Epinecidin-1抗菌肽能杀伤多种寄生虫,抑制肿瘤细胞增殖,促进皮肤和神经损伤的修复。Epinecidin-1抗菌肽能显著抑制阴道毛滴虫的生长,其最小抑菌浓度为62.5 µg/ml[18]。Epinecidin-1抗菌肽也能通过增加细胞内钙水平,从而诱导活性氧的产生并激活钙蛋白酶,继而引起线粒体的损伤和肿瘤细胞的死亡[19]。Lumpkins等[20]研究发现Epinecidin-1抗菌肽能诱导神经胶质纤维酸性蛋白的产生,而该蛋白与星形胶质细胞活化修复神经损伤相关。
-
尽管Epinecidin-1抗菌肽已经在诸多研究中表现出多样的药理活性,但其潜在局限性也不容忽视。这些局限性包括生物利用度低下、潜在毒性、特定生理环境下不稳定以及潜在的耐药性等。
静脉给药是Epinecidin-1抗菌肽理想的给药途径,但由于肽链结构存在稳定的两亲性α-螺旋结构,其剂量依赖性溶血效应在静脉使用期间应特别关注。肌内注射75 mg/kg和100 mg/kg Epinecidin-1抗菌肽会使1/3的实验小鼠出现瞳孔缩小但没有全身中毒症状,且5 h后基本恢复正常,但这种潜在毒性也可能限制其在临床的应用[14]。Epinecidin-1抗菌肽虽然在实验动物模型上的应用被证明是相对安全的,但仍需要进一步研究以确定其在人体应用的最佳用药方式和剂量。
此外,Epinecidin-1抗菌肽作为一种多肽,口服给药容易被胃肠道酶快速降解且很难穿透肠黏膜,因此口服给药方式受到限制。进入血液的抗菌肽也会被血浆中蛋白水解酶失活,并通过肝脏和肾脏快速清除,导致其短暂的作用时间;到达靶器官的Epinecidin-1抗菌肽活性会因体内pH值、温度、离子等因素而受到影响,从而导致其作用效果不稳定[21]。当然,Epinecidin-1抗菌肽在杀伤病原微生物的过程中必然会出现耐药菌,因此,如何保持该抗菌肽的杀伤作用还有待进一步研究。
-
虽然Epinecidin-1抗菌肽存在一些局限性,但是研究人员可以通过多肽定向修饰改造、纳米载体递送等方法克服其使用限制,从而提高抗菌肽的稳定性、安全性以及生物利用度。鉴于Epinecidin-1抗菌肽的多种药理活性,其在抗感染、局部伤口愈合、水产养殖等方面存在巨大的潜在应用价值。如前文所述,Epinecidin-1抗菌肽能广谱杀伤抑制多种细菌(包括多重耐药菌MRSA、创伤弧菌、幽门螺旋杆菌等),真菌(白念珠菌),病毒(日本脑炎病毒、神经坏死病毒、口蹄疫病毒等),寄生虫(阴道毛滴虫)等病原体,这就意味着Epinecidin-1抗菌肽在抗病原微生物方面存在应用潜力,尤其适用于海洋病原微生物(包括创伤弧菌、副溶血性弧菌等)感染的治疗[22]。由于Epinecidin-1抗菌肽能抑制杀伤痤疮丙酸杆菌并诱导皮肤角质形成细胞增殖来促进伤口的愈合过程,故其与胶原蛋白联合使用策略可能对化妆品行业有潜在的商业价值[23]。Epinecidin-1抗菌肽能显著增强宿主对日本脑炎病毒灭活疫苗的免疫应答,因此具有成为新型蛋白类免疫佐剂的开发价值[17]。鉴于Epinecidin-1抗菌肽能通过线粒体超极化并产生活性氧诱导肿瘤细胞DNA损伤和坏死,因此,将其与靶向递送载体相结合有可能成为潜在的新型抗肿瘤药物[24]。此外,将Epinecidin-1抗菌肽基因转导至鱼类或者将其掺入鱼饲料中,在一定程度上能改善鱼类的免疫力,这在水产养殖领域存在相当大的应用价值[25]。
-
Epinecidin-1抗菌肽作为石斑鱼抵抗海洋病原体的第一道天然防御屏障,具有抗病原微生物、免疫调节、伤口愈合等多种药理活性。本文综述了该抗菌肽的作用机制与药理活性,并探讨了该抗菌肽的潜在局限性与应用前景。由于Epinecidin-1抗菌肽来源于海洋鱼类,且对多种海洋病原微生物具有显著的杀伤抑制作用,故在治疗海水浸泡伤感染方面具有潜在的转化应用潜力。未来,针对Epinecidin-1抗菌肽还需在药动学、药效学、潜在毒性、最佳治疗剂量等各方面开展更充分的研究。
Research progress on antibacterial peptides Epinecidin-1
-
摘要: Epinecidin-1抗菌肽是从石斑鱼中提取的一种小分子活性多肽,是其先天免疫防御系统抵抗各种病原体的第一道防线。体内外研究证实,Epinecidin-1抗菌肽不仅表现出广谱的抗病原体活性(包括细菌、真菌、病毒和寄生虫等),还具有免疫调节、抗癌以及伤口愈合等药理活性。归纳近年Epinecidin-1抗菌肽的有关研究,对该抗菌肽的作用机制、药理活性、潜在局限性及应用前景进行综述,为下一步研究提供依据。
-
关键词:
- 抗菌肽 /
- Epinecidin-1 /
- 作用机制
Abstract: The antimicrobial peptide Epinecidin-1 is a kind of small molecule active peptides extracted from Epinephelus coioides, which serves as the first line of defense for innate immune defense system of Epinephelus coioides against various pathogens. In vitro and in vivo studies have confirmed that the antimicrobial peptide Epinecidin-1 not only exhibits broad-spectrum anti-pathogen activities (including bacteria, fungi, viruses, and parasites, etc.), but also has pharmacological activities such as immune regulation, anti-cancer and wound healing. In this paper, the relevant research on the antimicrobial peptide Epinecidin-1 in recent years were summarized, including its mechanism of action, pharmacological activities, potential limitations and application prospects , so as to provide information for further research.-
Key words:
- antimicrobial peptides /
- Epinecidin-1 /
- mechanism
-
定量核磁共振技术(qNMR)在现代化学、生物医药、食品科学等领域中扮演着至关重要的角色[1, 2]。其原理是基于核磁共振现象,当将含有1H、13C、19F、31P等特定磁性核的样品置于外加磁场中,并施加一定的频率射频脉冲时,特定磁性核会吸收能量并进入激发态。当这些原子核回到基态时,会释放出能量,产生NMR信号[3]。通过分析这些信号的强度,可以定量分析样品中目标分子[4, 5]。与传统的化学分析方法相比,qNMR技术具有准确度高、操作简便、无需标记和高通量检测等优点,已相继被《美国药典》、《欧洲药典》、《中国药典》收录,并广泛应用于多个领域[6]。如用于药物成分的定量分析,检测食品中的添加剂和污染物,监测环境中的有害物质,评估环境污染程度。此外,qNMR还在代谢组学、材料科学等领域中有着重要的应用[7, 8]。
核磁共振磷谱是一种核磁共振分析方法。其用于鉴定含磷化合物的结构,定量分析含磷化合物的含量,或监测含磷化合物动力学及其在生物体中的代谢过程[9]。由于31P原子核天然丰度为100 %,旋磁比较高,化学位移范围宽,使得31P-NMR成为研究含磷化合物极为有效的工具[10, 11]。通过分析31P-NMR谱图,可以获得关于磷化合物的分子结构、化学环境等重要信息[12]。
磷酸氢钙咀嚼片是一种以磷酸氢钙为主要原料,蔗糖、淀粉、硬脂酸镁为辅料制成的补钙类药品,具有参与骨骼形成、骨组织重建、降低毛细血管通透性等药理作用,广泛应用于儿童生长发育的促进和钙质补充。现行中国药典采用乙二胺四醋酸二钠滴定法测定磷酸氢钙片剂中的磷酸氢钙的含量[13, 14],但该法干扰因素多、灵敏度低、操作复杂。本研究建立了一种核磁共振磷谱定量(31P-qNMR)测定磷酸氢钙咀嚼片中磷酸氢钙含量的方法,相比于现有测定方法,操作简单,且专属性强,快速准确。
1. 仪器与试剂
仪器:600 MHz NMR(Bruker,AVANCE II)、分析天平(Shimadzu,AUW220D)、5 mm 同轴核磁管(Wilmad,535-pp-7)。
样品与试剂:某公司磷酸氢钙咀嚼片、重水(Cambridge Isotope Laboratories, Ins)、六甲基磷酰三胺(Adamas,含量≥98.0%,)、磷酸氢钙对照品(中国食品药品检定研究院,批号100410-201802)、稀盐酸(Adamas,分析纯)。
2. 实验方法
2.1 溶液配制
2.1.1 供试品溶液的制备
取20片磷酸氢钙咀嚼片,精密称定后研细,精密称取细粉适量(约相当于含磷酸氢钙0.60 g)于100 ml量瓶中,加入10 ml 0.1 mol/L盐酸溶液,超声5 min后加入重水10 ml,用水稀释至刻度,摇匀后过滤。制得含磷酸氢钙浓度约为6 mg/ml的供试品溶液,精密量取260 μl于同轴核磁管外管。
2.1.2 内标物溶液配制
精密量取40 mg六甲基磷酰三胺于5 ml量瓶中,加入0.5 ml重水后,用水稀释至刻度,摇匀,精密量取220 μl于同轴核磁管内管。
2.1.3 对照品溶液配制
精密称定磷酸氢钙对照品5.009 6 g于100 ml量瓶中,加10 ml 0.1 mol/L 稀盐酸溶解后定容,摇匀后得浓度为50.096 mg/ml的磷酸氢钙对照品储备液,稀释至适当浓度后精密量取260 μl于同轴核磁管外管。
2.2 测定条件与处理
精密量取260 μl待测样品、220 μl内标物溶液分别置于同轴核磁管外管和内管,进行数据采集。采用zgpg30脉冲序列在25 ℃下获取31P-NMR谱。具体实验参数设置如下:谱宽频率(SWH)= 39 682.5 Hz,采样点数(TD)= 65 K,采样时间(AQ)= 0.825 s,采样次数(NS)= 128,空扫次数(DS)= 4,增益(RG)= 1 150,其他实验参数均采用仪器推荐参数。采用Topspin3.1 软件进行数据处理。
3. 方法学考察
3.1 专属性
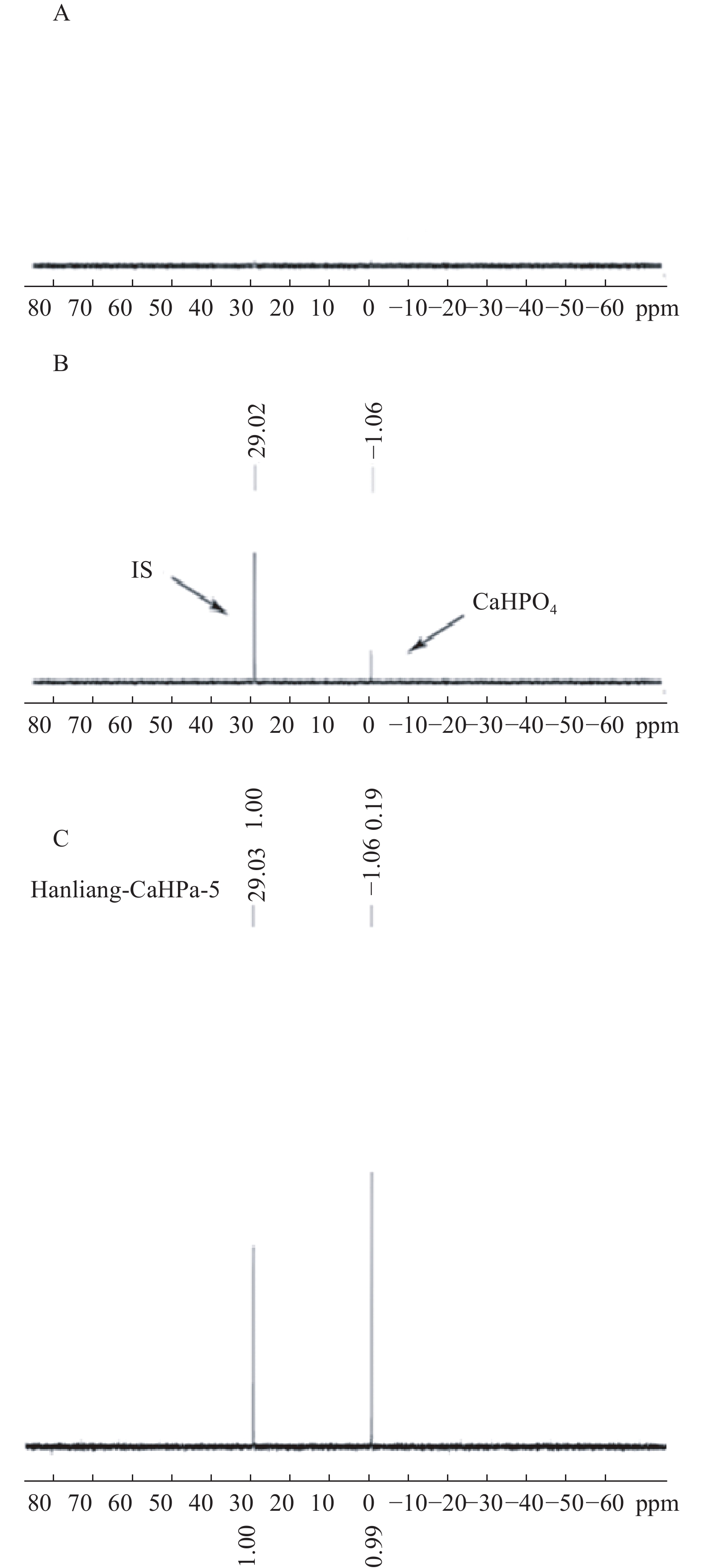
按“2.1”项对空白辅料、对照品、和实测样品进行处理后进样,图1表明辅料及溶剂成分对被测组分的测定没有干扰,且磷酸氢钙的化学位移为δ 1.06,内标的化学位移为δ 29.02,内标对药物的测定也没有干扰。
3.2 线性与范围
量取9.0、7.0、5.0、3.0、1.0 ml磷酸氢钙对照品储备液置于50 ml量瓶中,稀释至刻度,制成含磷酸氢钙对照品浓度为9.018、7.014、5.010、3.006、1.002 mg/ml 的标准曲线溶液。分别量取260 μl标准曲线溶液于同轴核磁管外管,按照“2.2”项下方法测定31P NMR谱。以磷酸氢钙对照品响应信号和内标响应信号比为纵坐标,标准曲线系列溶液浓度为横坐标(mg/ml)进行线性回归,计算得回归方程为:A=0.004 3+0.183 6C,表明磷酸氢钙在1.0~9.0 mg/ml 范围内线性范围较好,r=0.999 9。
3.3 重复性试验
按“2.1”项下重复精密称取6份片剂细粉,经相同处理后,按“2.2”项下进行检测,记录响应信号面积,根据工作曲线法计算其含量,得磷酸氢钙咀嚼片中磷酸氢钙含量为98.7 %,RSD为0.098 %,表明该方法重复性满足要求。
3.4 回收率测定
精密称定磷酸氢钙对照品1.002 g于100 ml量瓶中,加入10 ml 0.1 mol/L 盐酸溶解后加水至刻度线,摇匀后得浓度为10.02 mg/ml的磷酸氢钙对照品储备液。
移液管精密移取供试品储备液2.00 ml于5 ml容量瓶中,分别精确加入10.02 mg/ml对照品溶液0.75、1.00、1.25 ml,加水稀释至刻度线后得到低、中、高3种浓度的回收率测定溶液,每种浓度平行配制3份,测定并计算加样回收率,得平均回收率为98.02 %、98.16 %、98.47 %,RSD分别为 0.31 %、0.68 %、0.62 %(n=9),证明该方法准确度较好。
3.5 稳定性试验
取同一样品溶液分别在0、4、8、12 h下进行测定,记录供试品信号峰面积,计算样品中磷酸氢钙含量。4次测量的信号峰面积的RSD值仅为0.26 %,表明供试品溶液在室温下放置12 h稳定性较好。
3.6 磷酸氢钙含量测定
分别精密量取5份供试品溶液260 μl于同轴核磁管外管,按照“2.2”项下方法测定31P NMR谱图并计算样品中待测组分磷酸氢钙的含量,结果表明样品中磷酸氢钙平均含量为98.19 %,RSD = 0.10 %。
4. 结果与讨论
内标物的选择是定量核磁共振方法建立的关键,31P-qNMR定量检测中内标物质应选择结构稳定、不与待测样品发生反应、内标物信号峰与待测样品信号峰分离度高等特点。常见的磷核磁共振定量内标物有六甲基磷酰三胺(HMDA)、磷酸、甲基膦酸、亚甲基二磷酸等。其中,六甲基磷酰三胺易溶于氘代溶剂,且化学性质稳定,化学位移值约为δ 29.01,与待测物磷酸氢钙分离度好,无重叠,故本实验选取六甲基磷酰三胺作为内标物。经过方法学考察后,表明磷酸氢钙在1.0~9.0 mg/ml范围内线性相关,低、中、高3种浓度的加样回收率结果为98.0 %、98.1 %和98.4 %。本研究建立了一种精密度高、专属性强的含磷药物的含量检测方法,且无需自身对照物、前处理简便、检测速度快,为含磷药品质量控制提供了新的策略。
-
[1] SHABIR U, ALI S, MAGRAY A R, et al Fish antimicrobial peptides (AMP's) as essential and promising molecular therapeutic agents: a review[J]. Microb Pathog2018 114 50 56 .[2] YIN Z X, HE W, CHEN W J, et al . Cloning, expression and antimicrobial activity of an antimicrobial peptide, epinecidin-1, from the orange-spotted grouper, Epinephelus coioides[J]. Aquaculture2006 253 1-4 204 211 .[3] ZHUANG Z R, YANG X D, HUANG X Z, et al . Three new piscidins from orange-spotted grouper (Epinephelus coioides): Phylogeny, expression and functional characterization[J]. Fish Shellfish Immunol2017 66 240 253 .[4] HANEY E F, MANSOUR S C, HANCOCK R E W Antimicrobial peptides: an introduction[J]. Methods Mol Biol2017 1548 3 22 .[5] PAN C Y, CHEN J Y, CHENG Y S E, et al . Gene expression and localization of the epinecidin-1 antimicrobial peptide in the grouper (Epinephelus coioides), and its role in protecting fish against pathogenic infection[J]. DNA Cell Biol2007 26 6 403 413 .[6] CHEE P Y, MANG M, LAU E S, et al . Epinecidin-1, an antimicrobial peptide derived from grouper (Epinephelus coioides): pharmacological activities and applications[J]. Front Microbiol2019 10 2631 .[7] NARAYANA J L, HUANG H N, WU C J, et al . Epinecidin-1 antimicrobial activity: in vitro membrane Lysis and in vivo efficacy against Helicobacter pylori infection in a mouse model[J]. Biomaterials2015 61 41 51 .[8] 李云香, 姚倩, 任玫, 等 抗菌肽作用机制研究进展[J]. 动物医学进展2019 40 9 98 103 .[9] LEE S C, PAN C Y, CHEN J Y The antimicrobial peptide, epinecidin-1, mediates secretion of cytokines in the immune response to bacterial infection in mice[J]. Peptides2012 36 1 100 108 .[10] SU B C, CHEN J Y . Epinecidin-1: an orange-spotted grouper antimicrobial peptide that modulates Staphylococcus aureus lipoteichoic acid-induced inflammation in macrophage cells[J]. Fish Shellfish Immunol2020 99 362 367 .[11] HUANG X Z, HU B C, YANG X D, et al . The putative mature peptide of piscidin-1 modulates global transcriptional profile and proliferation of splenic lymphocytes in orange-spotted grouper (Epinephelus coioides)[J]. Fish Shellfish Immunol2019 86 1035 1043 .[12] HUANG T C, CHEN J Y Proteomic and functional analysis of zebrafish after administration of antimicrobial peptide epinecidin-1[J]. Fish Shellfish Immunol2013 34 2 593 598 .[13] HUANG H N, PAN C Y, SU B C, et al . Epinecidin-1 protects against methicillin resistant Staphylococcus aureus infection and Sepsis in pyemia pigs[J]. Mar Drugs2019 17 12 693 .[14] PAN C Y, CHEN J C, SHEEN J F, et al . Epinecidin-1 has immunomodulatory effects, facilitating its therapeutic use in a mouse model of Pseudomonas aeruginosa Sepsis[J]. Antimicrob Agents Chemother2014 58 8 4264 4274 .[15] CHEN J Y, PAN C Y. Use of epinecidin-1 peptides and anti-lipopolysaccharide factor peptides for treating microbial infection: US8377867[P]. 2013-02-19. [16] HUANG H N, PAN C Y, CHEN J Y . Grouper (Epinephelus coioides) antimicrobial peptide epinecidin-1 exhibits antiviral activity against foot-and-mouth disease virus in vitro[J]. Peptides2018 106 91 95 .[17] HUANG H N, PAN C Y, RAJANBABU V, et al Modulation of immune responses by the antimicrobial peptide, epinecidin (Epi)-1, and establishment of an Epi-1-based inactivated vaccine[J]. Biomaterials2011 32 14 3627 3636 .[18] HUANG H N, CHUANG C M, CHEN J Y, et al . Epinecidin-1: a marine fish antimicrobial peptide with therapeutic potential against Trichomonas vaginalis infection in mice[J]. Peptides2019 112 139 148 .[19] SU B C, LI C C, HORNG J L, et al Calcium-dependent calpain activation-mediated mitochondrial dysfunction and oxidative stress are required for cytotoxicity of epinecidin-1 in human synovial sarcoma SW982 cells[J]. Int J Mol Sci2020 21 6 2109 .[20] LUMPKINS K M, BOCHICCHIO G V, KELEDJIAN K, et al Glial fibrillary acidic protein is highly correlated with brain injury[J]. J Trauma2008 65 4 778 782 .[21] BATONI G, MAISETTA G, BRANCATISANO F L, et al Use of antimicrobial peptides against microbial biofilms: advantages and limits[J]. Curr Med Chem2011 18 2 256 279 .[22] BOLATCHIEV A . Antimicrobial peptides epinecidin-1 and beta-defesin-3 are effective against a broad spectrum of antibiotic-resistant bacterial isolates and increase survival rate in experimental Sepsis[J]. Antibiotics (Basel)2022 11 1 76 .[23] HUANG H N, RAJANBABU V, PAN C Y, et al Use of the antimicrobial peptide Epinecidin-1 to protect against MRSA infection in mice with skin injuries[J]. Biomaterials2013 34 38 10319 10327 .[24] SU B C, WU T H, HSU C H, et al . Distribution of positively charged amino acid residues in antimicrobial peptide epinecidin-1 is crucial for in vitro glioblastoma cytotoxicity and its underlying mechanisms[J]. Chem Biol Interact2020 315 108904 .[25] TING C H, CHEN Y C, CHEN J Y . Nile tilapia fry fed on antimicrobial peptide Epinecidin-1-expressing Artemia cyst exhibit enhanced immunity against acute bacterial infection[J]. Fish Shellfish Immunol, 2018, 81: 37-48. -

 点击查看大图
点击查看大图
计量
- 文章访问数: 5718
- HTML全文浏览量: 2116
- PDF下载量: 44
- 被引次数: 0




 下载:
下载:

 下载:
下载:
