-
阿尔茨海默病(AD)是一种以进行性记忆功能和神经行为障碍为表现的中枢神经系统退行性疾病。目前全球约有AD患者
5000 余万人,随着人口老龄化的进展,这一数字还将持续增加,给全球发展带来巨大的健康和经济负担[1] 。到目前为止,临床尚缺乏有效的AD治疗手段。胆碱酯酶抑制剂、NMDA拮抗剂等传统AD治疗药物效果有限,FDA新批准上市的Aβ单克隆抗体仑卡奈单抗等疗效尚存争议,且治疗费用昂贵[2] 。因此,开发经济、有效的AD治疗药物仍是当前研究热点。中药因其多靶点系统作用和低毒副作用的优势,近年来在AD等复杂疾病治疗药物发掘中发挥重要作用[3] 。中药葛根和知母临床应用历史悠久,葛根解肌退热、生津止渴,知母清热泻火、滋阴润燥,二者配伍可清热生津、滋阴润燥,改善代谢紊乱,对热邪灼津、痰浊阻窍所致的健忘呆钝、消渴等症具有治疗作用,主要代表方剂为玉液汤[4-6] 。近年来研究发现该药对的一些成分如葛根素[7] 、芒果苷[8] 、知母皂苷BⅡ[9] 等对AD具有药效作用。作为一种复杂的异质性疾病,AD的发生与糖尿病存在紧密的因果关联,也被称为脑型糖尿病(3型糖尿病)[10] 。但是目前鲜见葛根与知母配伍后在AD治疗中作用效果的报道。因此,本研究拟通过建立AD大鼠模型考察葛根和知母配伍防治AD的效果,同时运用代谢组学策略探究葛根与知母作为药对配伍后防治AD潜在的作用机制,为中药防治AD研究提供参考借鉴。
-
Agilent
1290 Infinity液相色谱仪和6538 UHD Accurate-Mass 四级杆飞行时间串联高分辨质谱仪(美国安捷伦公司);HERAEUS FRESCO 17高速冷冻离心机(美国赛默飞公司);ANALOG 涡旋振荡器(美国奥豪斯公司);Milli-Q Integral超纯水机(美国Millipore公司);十万分之一电子分析天平(日本A&D公司);Digbehav动物行为学分析系统-水迷宫(上海吉量软件科技有限公司)。 -
葛根(批号:A220901)与知母药材饮片(批号:
20220201 )购自上海市白鹿堂中药店,经海军军医大学药学系蒋益萍副教授鉴定为豆科植物野葛P. lobate(Willd.)Ohwi的干燥根和百合科植物知母A. asphodeloides Bge.的干燥根茎;乙醇(分析纯,国药集团上海化学试剂有限公司); 乙腈、甲酸(均为LC-MS级,赛默飞世尔科技中国有限公司);乙腈、甲醇(色谱纯,北京迪马科技有限公司);乌拉坦(批号:P2091859)、D-gal(批号:P1616089)和AlCl3(批号:P2391168)购自上海泰坦科技股份有限公司;生理氯化钠溶液(四川科伦药业股份有限公司);L-2-氯苯丙氨酸(98%,上海麦克林生化有限公司);超氧化物歧化酶(SOD)、丙二醛(MDA)和一氧化氮(NO)试剂盒购自上海源桔生物科技中心。 -
健康雄性清洁级SD大鼠,体重(200±20)g,购自浙江省实验动物中心,动物生产许可证号:SCXK(浙)2019-0002。大鼠饲养于海军军医大学药学系实验动物中心,笼饲条件为:温度恒定为(22±2)℃,湿度区间为40%~60%,昼夜循环时间为12 h。
-
分别取葛根、知母和葛根-知母药对(15∶12)粉末适量,以10倍体积70%乙醇浸泡,在85 ℃下加热回流提取90 min,滤过,滤渣以同等条件重复提取2次。合并3次滤液,60 ℃减压浓缩至无乙醇味,制备得到用于灌胃的提取液,密封保存于−20 ℃待用。
-
40只SD大鼠适应性喂养1周后按照体重随机分为空白对照组、AD模型组、葛根组、知母组和葛根-知母药对组共5组(n=8)。除对照组外,其余4组大鼠每日给予D-gal 300 mg/kg腹腔注射和AlCl3 200 mg/kg灌胃,连续给药21周建立AD动物模型。对照组每日给予等量的生理盐水(灌胃+腹腔注射)。自第14周起,3个中药干预组分别给予葛根、知母和葛根-知母药对提取液灌胃(相当于生药量:葛根6.25 g/(kg·d),知母5 g/(kg·d),药对11.25 g/(kg·d)。对照组和模型组大鼠灌胃等量纯水。
-
采用Morris水迷宫行为学实验评价大鼠的学习和记忆能力。水迷宫实验全程共6 d,其中包括5 d的定位航行训练和1 d的空间探索试验。利用动物行为学分析系统记录大鼠在定位航行训练期间每日的逃避潜伏时间和空间探索训练中的运动轨迹、穿越站台次数、各象限的运动距离和停留时间等参数,供分析评价使用。
-
行为学实验结束后,大鼠腹腔注射乌拉坦麻醉,经腹主动脉取血,静置后,在4 ℃、
4 000 r/min转速下离心10 min,取上清液分装冻存于−80 ℃,供后续分析用。 -
使用ELISA试剂盒,按照说明书步骤检测大鼠血清中的SOD、MDA、NO等氧化应激和脂质过氧化相关指标。
-
精密称取L-2-氯苯丙氨酸适量,加入甲醇溶解得浓度为5 mg/ml的内标母液,随后用甲醇稀释得到浓度为2 μg/ml的内标溶液。
-
各取200 μl解冻后的血清样本置于1.5 ml的离心管中,加入600 μl预冷的含内标的甲醇溶液,涡旋2 min后,在4 ℃、
12 500 r/min转速下离心15 min,取上清液供UPLC-Q/TOF-MS分析用。取各样本20 μl,混合得到质控(QC)样本。 -
色谱条件:反相色谱柱为Waters X Select HSS T3柱(2.1 mm×100 mm, 1.8 μm),亲水作用色谱柱为Waters Acquity UPLC BEH HILIC柱(2.1 mm×100 mm, 1.8 μm);进样量:2 μl;柱温:40 ℃;流动相为0.1%甲酸-水(A )和0.1%甲酸-乙腈溶液(B);T3柱梯度洗脱模式:0~2 min,2%B;2~17 min,2%~98% B;17~19 min,98%B。HILIC柱梯度洗脱模式:0~2 min,95%B;2~4 min,95%~89% B;4~10 min, 89% B;10~12 min, 89%~66% B;12~15 min, 66% B。流速:0.4 ml/min;色谱柱平衡时间:5 min。
质谱条件:采用 ESI 离子源,正、负离子检测模式;干燥气温度,350 ℃,干燥气体流量:11 L/min;毛细管电压:正离子模式为
4 000 V,负离子模式为3 500 V;碎裂电压:120 V;质谱扫描范围:50~1 500 m/z。 -
质谱数据用XCMS程序包进行预处理,按80%原则过滤无效数据并进行内标归一化处理。使用SIMCA 14.1(Umetrics公司,瑞典)进行偏最小二乘判别分析(PLS-DA)和正交矫正偏最小二乘判别分析(OPLS-DA)并进行模型验证,结合R2X、R2Y和Q2判断模型的拟合效果和预测效果。以变量权重值(VIP)>1、P<0.05且差异倍数(fold change,FC)>1.2或<0.8作为筛选标准,获得AD疾病关联生物标志物。借助HMDB数据库(https://hmdb.ca/)等在线代谢物质谱数据库对筛选得到的差异代谢物进行比对和注释。借助MetaboAnalyst 6.0(https://www.metaboanalyst.ca/)网站进行代谢通路分析。
-
使用SPSS Statistics 23(IBM公司,美国)和GraphPad Prism 8(Graphpad软件公司,美国)进行统计分析与绘图。两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05认为组间差异具有统计学意义。
-
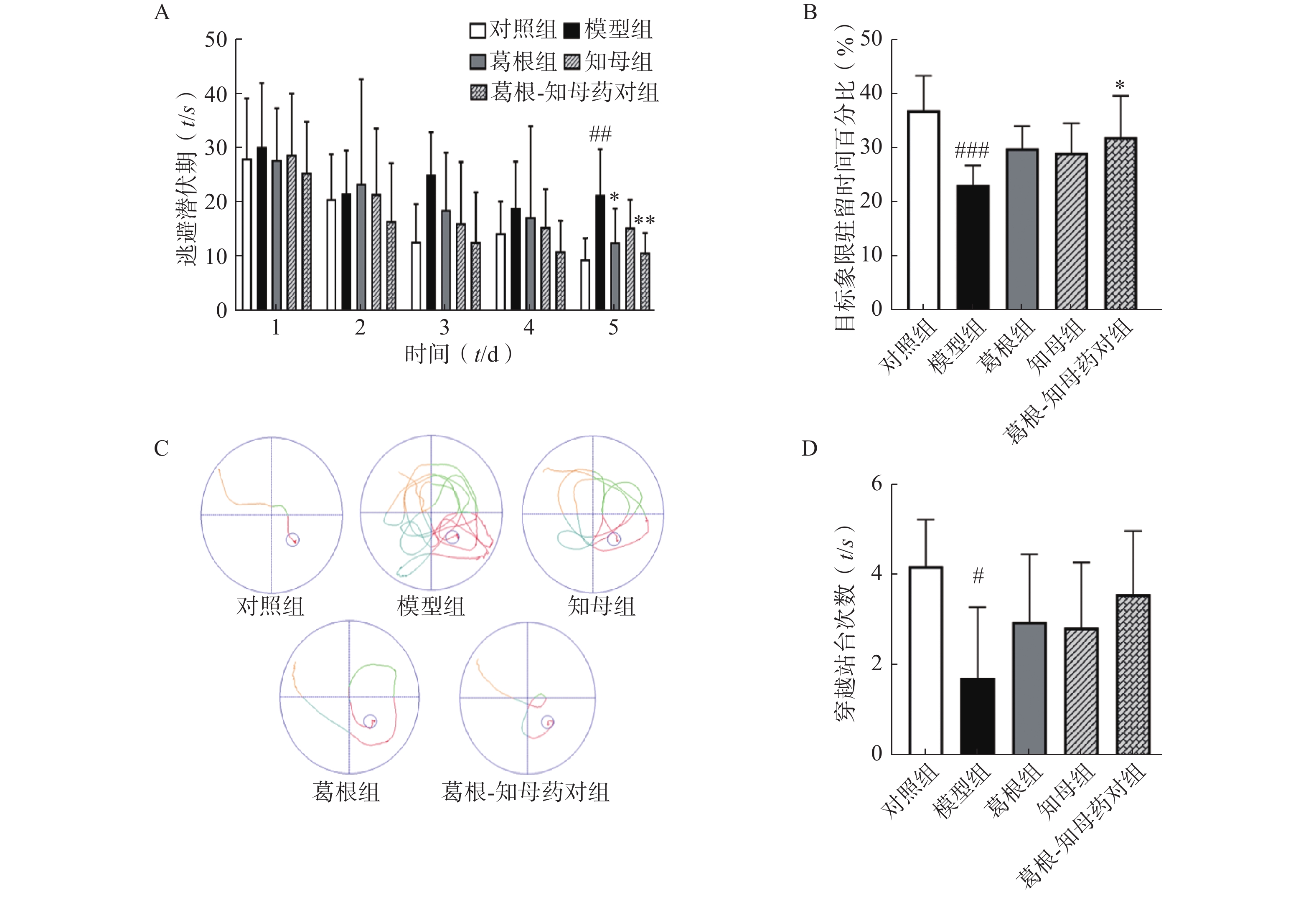
以水迷宫实验中大鼠逃避潜伏期、穿越站台所在位置次数以及站台所在象限的停留时间作为评价指标,考察大鼠的学习和记忆水平。结果如图1所示,定位航行训练期间,各组大鼠的逃避潜伏期随训练时间增加均呈下降趋势,其中模型组逃避潜伏期下降趋势较为平缓,对照组和3个中药干预组下降趋势均较模型组显著,对照组和葛根-知母药对组第5日逃避潜伏期较模型组均有极显著差异(P<0.01)。同样,空间探索实验中,模型组大鼠穿越站台次数以及站台所在象限的停留时间较对照组均显著减少,组间差异具有统计学意义(P<0.05)。中药干预后各组大鼠穿越站台次数及目标象限停留时间均有所增加,其中,葛根-知母药对组与模型组间差异具有统计学意义(P<0.05)。结果表明,造模后大鼠的学习和记忆能力出现下降,给予葛根、知母和葛根-知母药对干预均可不同程度改善大鼠的学习和记忆能力,以葛根-知母药对最为显著,效果优于单药。
-
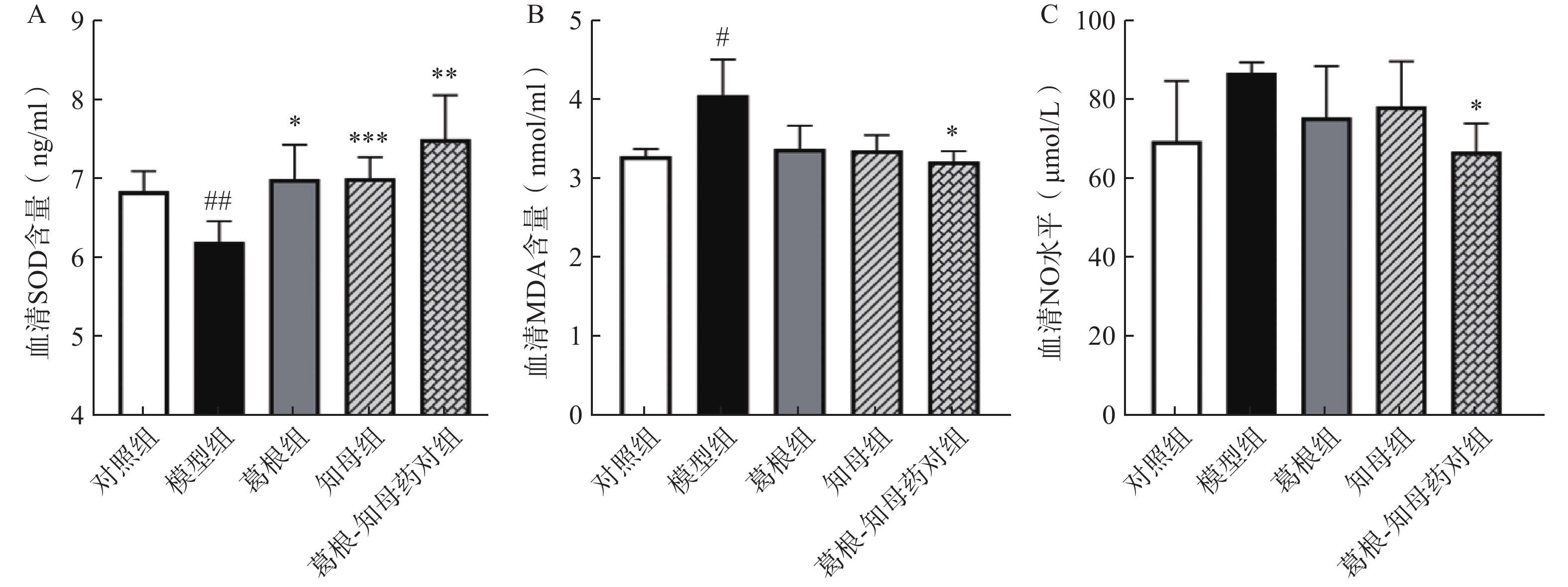
与对照组相比,模型组大鼠血清NO水平相对升高,MDA水平显著升高(P<0.05),SOD含量极显著降低(P<0.01)。中药干预后,各给药组血清NO和MDA水平出现不同程度降低,其中葛根-知母药对组降低效果最为明显,与模型组间差异具有统计学意义(P<0.05)。葛根、知母和葛根-知母药对给药组血清SOD含量较模型组均有所回调,组间差异具有统计学意义(P<0.05),见图2。
-
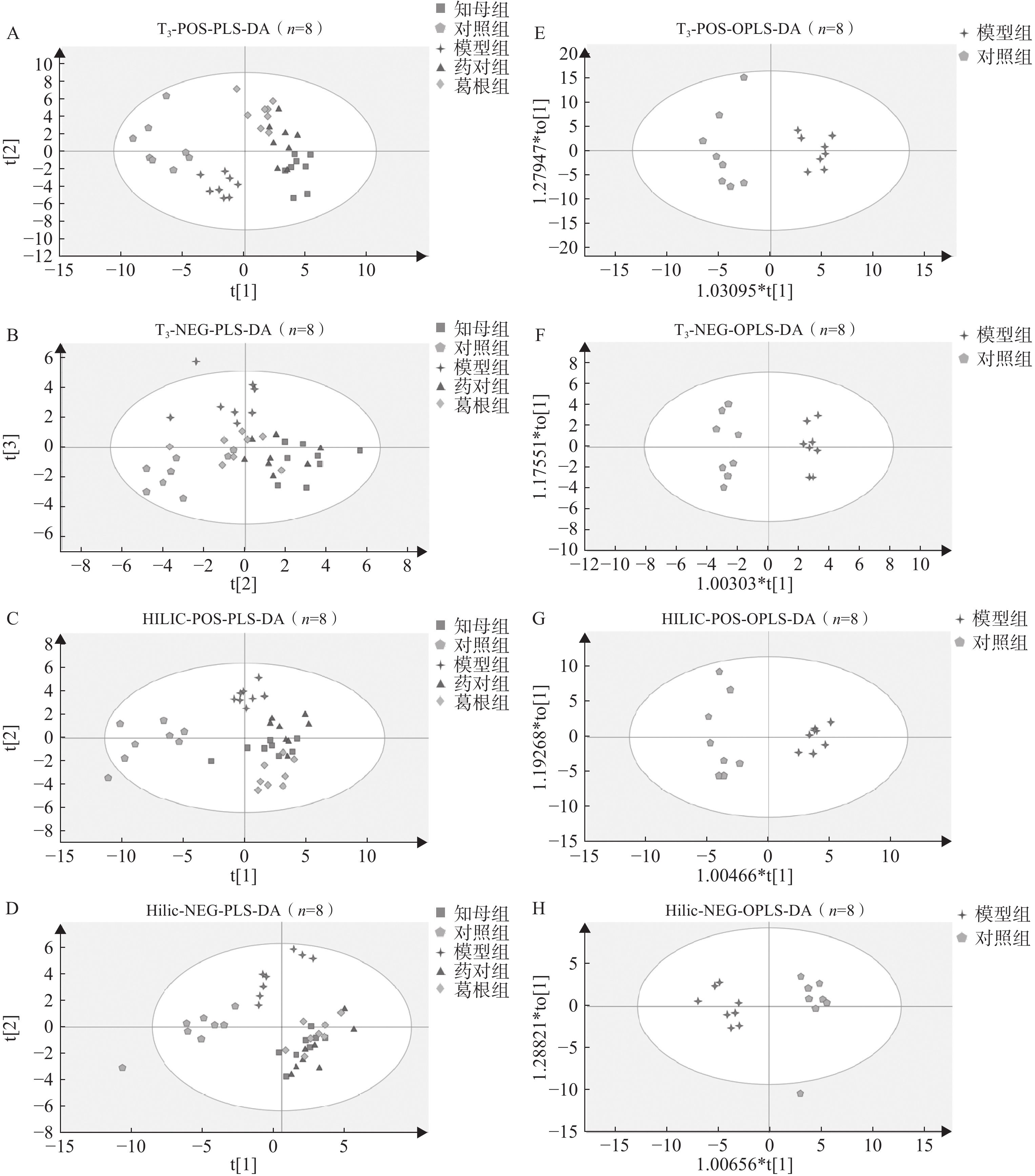
血清样本经UHPLC-Q/TOF-MS分析后得到各组大鼠血清代谢图谱,不同色谱柱分析条件下各组大鼠血清代谢轮廓存在一定差异。多元统计分析结果表明(图3),在PLS-DA多组分析模型中,空白对照组、AD模型组和3个中药干预组组间区分度较好,组内差异相对较小。PLS-DA模型200次置换检验结果显示,Q2回归线与Y轴截距小于0,R2和Q2曲线斜率始终为正值,且Q2<R2,表明模型未出现过拟合,具有相对可靠的解释和预测能力。在OPLS-DA模型中,不同分析条件下,AD模型组与空白对照组间完全分离,表明模型组与对照组间具有显著组间差异,CV-ANOVA验证结果证实所建立的OPLS-DA模型未出现过拟合,具备解释和预测能力。
-
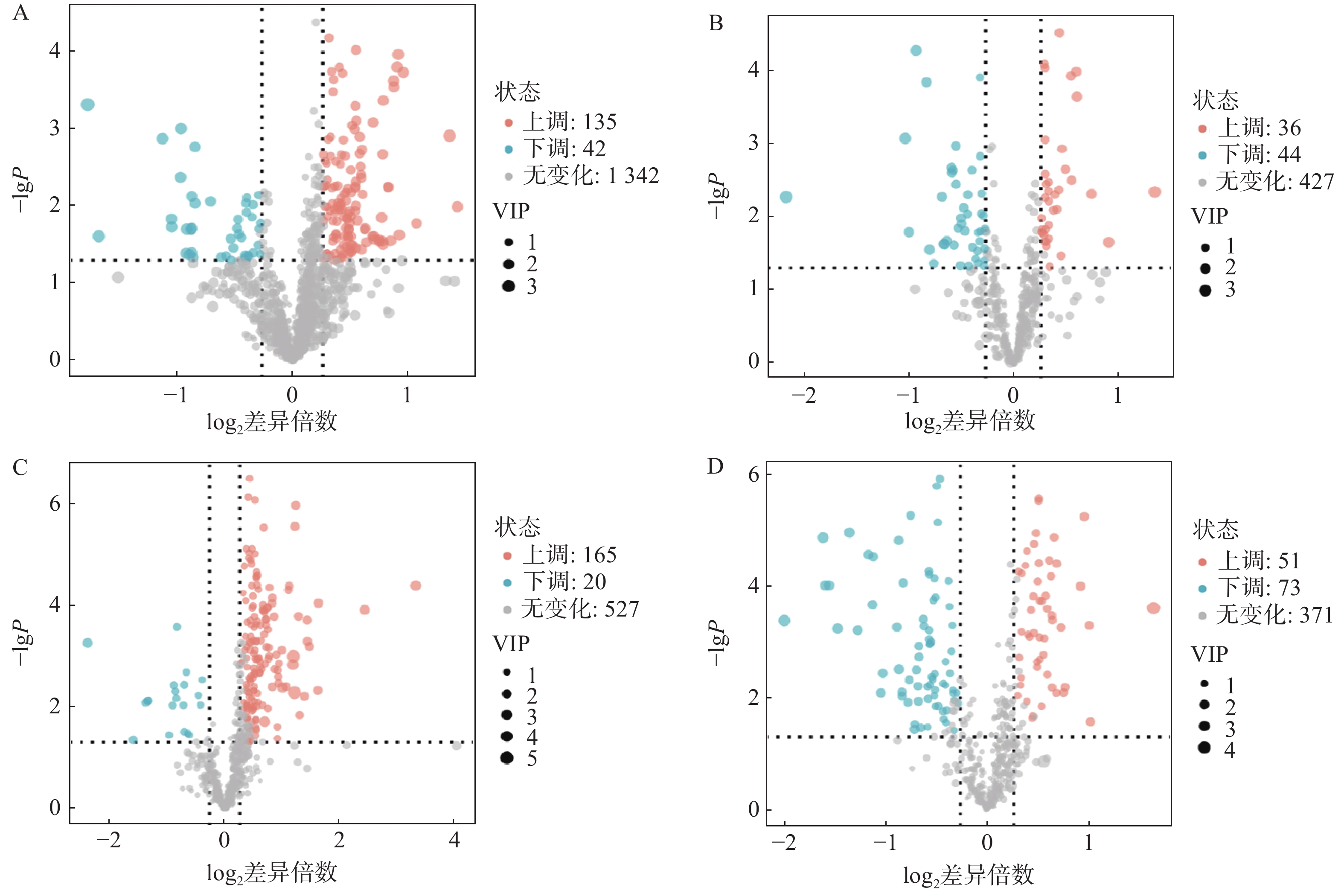
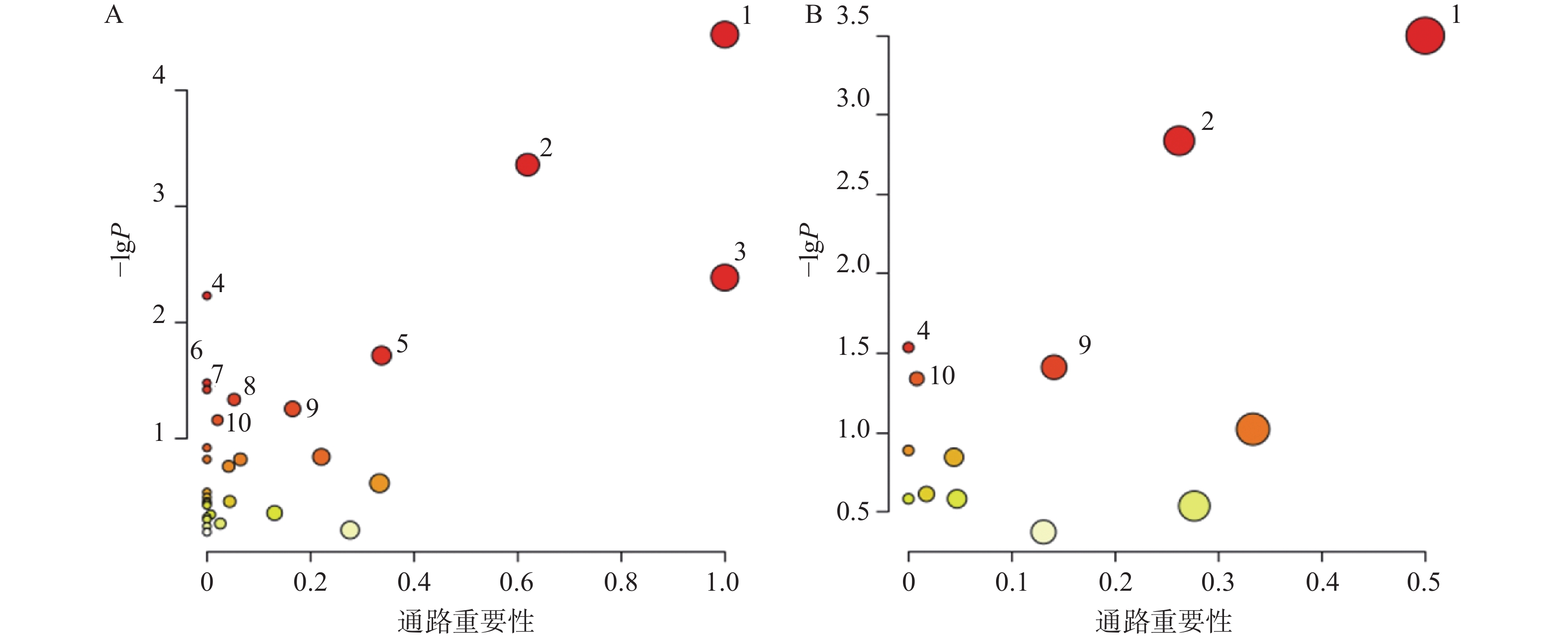
对T3柱和HILIC柱正、负离子模式下的代谢物信息进行差异化分析,以VIP值>1、P<0.05和FC>1.2或FC<0.8作为筛选标准,对不同模式下空白对照组与AD模型组的差异代谢物进行筛选,并以火山图形式呈现(图4)。图中橙色标记点为显著上调代谢物,蓝色标记点为显著下调代谢物。
利用HMDB数据库对差异代谢物质谱信息进行匹配和鉴定,在AD模型组与对照组间鉴定出70个AD相关的潜在生物标志物,其中由HILIC柱鉴定得到31个代谢物,T3柱鉴定得到45个代谢物,T3和HILIC柱共同鉴定得到的代谢物6个,具体如表1所示。
表 1 差异代谢物鉴定、趋势和相关通路分析结果
序号 代谢物 色谱柱 分子质量(m/z) 化学式 加合离子 趋势 相关通路 P 值 1 2-羟基丁酸 T3 127.0362 C4H8O3 M+Na ↑ 丙酸代谢 1.22E-03 2 肌酸 T3 132.0781 C4H9N3O2 M+H ↑# 甘氨酸、丝氨酸和苏氨酸代谢 6.98E-03 3 脯氨酸 T3、HILIC 138.0553 C5H9NO2 M+Na ↓#* 精氨酸和脯氨酸代谢 4.20E-03 4 L-天冬氨酸 T3 133.0606 C4H8N2O3 M+H ↑# 丙氨酸、天冬氨酸和
谷氨酸代谢2.36E-02 5 L-乙酰基肉碱 T3 204.1218 C9H17NO4 M+H ↑ 不饱和脂肪酸的生物合成 1.26E-03 6 棕榈酰肉碱 T3 400.3424 C23H45NO4 M+H ↑#* 脂肪酸降解 2.38E-04 7 喹啉酸 T3 168.0271 C7H5NO4 M+H ↑ 烟酸和烟酰胺代谢 4.97E-04 8 焦谷氨酸 T3 128.0329 C5H7NO3 M-H ↓# 谷胱甘肽代谢 2.89E-02 9 3b-羟基-5-胆酸 T3 357.2789 C24H38O3 M+H-H2O ↑ − 1.01E-02 10 香草酸 T3 151.0361 C8H8O4 M+H-H2O ↑ − 3.05E-03 11 肌酸酐 T3 136.0491 C4H7N3O M+Na ↑# − 1.89E-04 12 戊烯二酸 T3 153.0198 C5H6O4 M+Na ↑ − 8.96E-03 13 亚油酸 T3 303.2327 C18H32O2 M+Na ↑# 亚油酸代谢 2.45E-02 14 4-羟基丁酸 T3 103.0382 C4H8O3 M-H ↑# − 4.49E-03 15 糖原 T3 689.2111 C24H42O21 M+Na ↑ 淀粉和蔗糖代谢 2.24E-02 16 肉豆蔻酸 T3 211.2038 C14H28O2 M+H-H2O ↑# 脂肪酸生物合成 4.15E-02 17 丙酰肉碱 T3 218.1383 C10H19NO4 M+H ↓# 支链脂肪酸的氧化 1.97E-02 18 硬脂酰肉碱 T3 428.3734 C25H50NO4 M+H ↑#* 长链饱和脂肪酸的
线粒体β氧化2.84E-04 19 花生四烯酸 T3 327.232 C20H32O2 M+Na ↑#* 花生四烯酸代谢 1.53E-02 20 N1乙酰精胺 T3 267.208 C12H28N4O M+Na ↑# 赖氨酸降解 3.71E-02 21 N6, N6, N6-三甲基-L-赖氨酸 T3 189.16 C9H20N2O2 M+H ↑# α-亚麻酸代谢 4.44E-02 22 α-亚麻酸 T3 279.2316 C18H30O2 M+H ↑#* 初级胆汁酸生物合成 2.80E-02 23 24羟基胆固醇 T3 425.343 C27H46O2 M+Na ↑# 半胱氨酸和蛋氨酸代谢 8.17E-04 24 2-氧代-4-甲硫基丁酸 T3 131.0189 C5H8O3S M+H-H2O ↑ 不饱和脂肪酸的生物合成 1.14E-02 25 二十碳五烯酸 T3 285.2212 C20H30O2 M+H-H2O ↑# − 2.45E-02 26 油酰乙醇酰胺 T3 348.2891 C20H39NO2 M+Na ↑# − 8.42E-03 27 吲哚-3-丙酸 T3 190.0858 C11H11NO2 M+H ↓# − 4.79E-04 28 棕榈油酸 T3 237.2193 C16H30O2 M+H-H2O ↑#* − 5.79E-03 29 15(S)-羟基二十碳三烯酸 T3 345.2341 C20H34O3 M+Na ↑# − 9.83E-03 30 十四酰肉碱 T3、HILIC 372.3103 C21H41NO4 M+H ↑# − 1.15E-02 31 3-羟基马尿酸 T3 178.0501 C9H9NO4 M+H-H2O ↓#* − 9.53E-03 32 18-羟基花生四烯酸 T3 343.225 C20H32O3 M+Na ↑# − 3.91E-02 33 亚麻酰基肉碱 T3 424.3414 C25H46NO4 M+H ↑# − 4.25E-04 34 LysoPC(15:0/0:0) T3 526.3057 C23H48NO7P M+FA-H ↓#* − 2.55E-02 35 PC(18:1(9Z)e/2:0) T3 550.3872 C28H56NO7P M+H ↑#* − 2.11E-03 36 7-酮胆固醇 T3 401.3455 C27H44O2 M+H ↑#* − 1.08E-04 37 9-十六碳烯酰肉碱 T3 398.3152 C23H43NO4 M+H ↑# − 9.43E-05 38 16(17)-EpDPE T3 343.2219 C22H32O3 M-H ↑#* − 3.33E-02 39 十八烯酰肉碱 T3 426.3578 C25H47NO4 M+H ↑# − 1.84E-04 40 肉豆蔻酰肉碱 T3 370.2951 C21H39NO4 M+H ↑ − 4.25E-03 41 DL-乙酰肉碱 T3 204.1227 C9H17NO4 M+H ↑ 嘧啶代谢 1.85E-03 42 胞苷一磷酸 HILIC 368.0407 C9H14N3O8P M+FA-H ↓# 甘氨酸、丝氨酸和苏氨酸代谢 2.74E-02 43 胆碱 HILIC 86.0963 C5H14NO M+H-H2O ↑ 初级胆汁酸生物合成 1.20E-02 44 甘胆酸 HILIC 466.33 C26H43NO6 M+H ↑#* 苯丙氨酸、酪氨酸和色氨酸生物合成 2.43E-04 45 L-酪氨酸 HILIC 182.0812 C9H11NO3 M+H ↑#* 苯丙氨酸、酪氨酸和色氨酸生物合成 2.89E-03 46 苯丙氨酸 HILIC 166.0862 C9H11NO2 M+H ↑ 嘌呤代谢 1.68E-03 47 肌苷酸 HILIC 383.0262 C10H13N4O8P M+Cl ↓#* 丙氨酸、天冬氨酸和
谷氨酸代谢9.85E-04 48 L-天门冬氨酸 HILIC 134.0433 C4H7NO4 M+H ↑ 苯丙氨酸、酪氨酸和色氨酸生物合成 5.14E-04 49 苯丙酮酸 HILIC 165.0546 C9H8O3 M+H ↑#* 嘧啶代谢 6.25E-03 50 乳清酸 HILIC、T3 179.0029 C5H4N2O4 M+Na ↓#* 鞘脂代谢 3.04E-02 51 鞘氨醇 HILIC 302.3059 C18H39NO2 M+H ↑# 酪氨酸代谢 6.59E-04 52 香草扁桃酸 HILIC 233.0192 C9H10O5 M+Cl ↑#* 酪氨酸代谢 6.72E-05 53 酪胺 HILIC 120.079 C8H11NO M+H-H2O ↑ − 2.50E-03 54 3-氧代-4, 6 -胆二烯酸 HILIC 393.2315 C24H34O3 M+Na ↑# 初级胆汁酸生物合成 1.46E-02 55 鹅去氧胆酸 HILIC 437.2877 C24H40O4 M+FA-H ↑#* 丙氨酸、天冬氨酸和
谷氨酸代谢7.30E-04 56 谷氨酰胺 HILIC 169.0584 C5H10N2O3 M+Na ↑# − 5.06E-04 57 亮氨酸 HILIC 133.0855 C6H12O3 M+H ↑ − 5.18E-03 58 高-L-精氨酸 HILIC 189.1292 C7H16N4O2 M+H ↑#* − 1.22E-02 59 马尿酸 HILIC、T3 178.0516 C9H9NO3 M-H ↓# − 2.94E-02 60 牛磺胆酸3-硫酸盐 HILIC 596.2653 C26H45NO10S2 M+H ↑ − 1.78E-05 61 鹅去氧胆酸3-硫酸盐 HILIC 455.2515 C24H40O7S M+H-H2O ↑ 半胱氨酸和蛋氨酸代谢 2.76E-03 62 硫代半胱氨酸 HILIC 187.9645 C3H7NO2S2 M+Cl ↓# 亚油酸代谢 8.23E-05 63 13-L-过氧化氢亚油酸 HILIC 311.2187 C18H32O4 M-H ↓# − 4.63E-03 64 S-亚硝基谷胱甘肽 HILIC 381.0763 C10H16N4O7S M+FA-H ↓#* 鞘脂代谢 8.86E-05 65 LacCer(d18:1/12:0) HILIC 806.5705 C42H79NO13 M+H ↑ 花生四烯酸代谢 1.30E-04 66 LysoPC(14:0/0:0) HILIC、T3 512.3009 C22H46NO7P M+FA-H ↓ − 3.34E-02 67 2-(14,15-环氧二十碳三烯酰基)甘油 HILIC 395.2749 C23H38O5 M+H ↑ − 1.41E-03 68 赖氨酰苯丙氨酸 HILIC 294.1891 C15H23N3O3 M+H ↑ 醚脂代谢 2.52E-04 69 二十四碳四烯酸肉碱 HILIC、T3 526.3786 C31H53NO4 M+Na ↑ − 2.98E-05 70 1-(11Z二十二碳烯酰基)-3-磷酸甘油酯 HILIC 515.3163 C25H49O7P M+Na ↑ − 8.91E-07 注:↑表示模型组较对照组相对升高趋势,↓表示模型组较对照组相对下降趋势,P值为模型组与对照组间代谢物水平的t检验计算结果;
#表示代谢物经葛根-知母药对干预后具有回调趋势(共47个),*表示代谢物(共20个)经葛根-知母药对干预后回调差异具有统计学意义(P<0.05)。 -
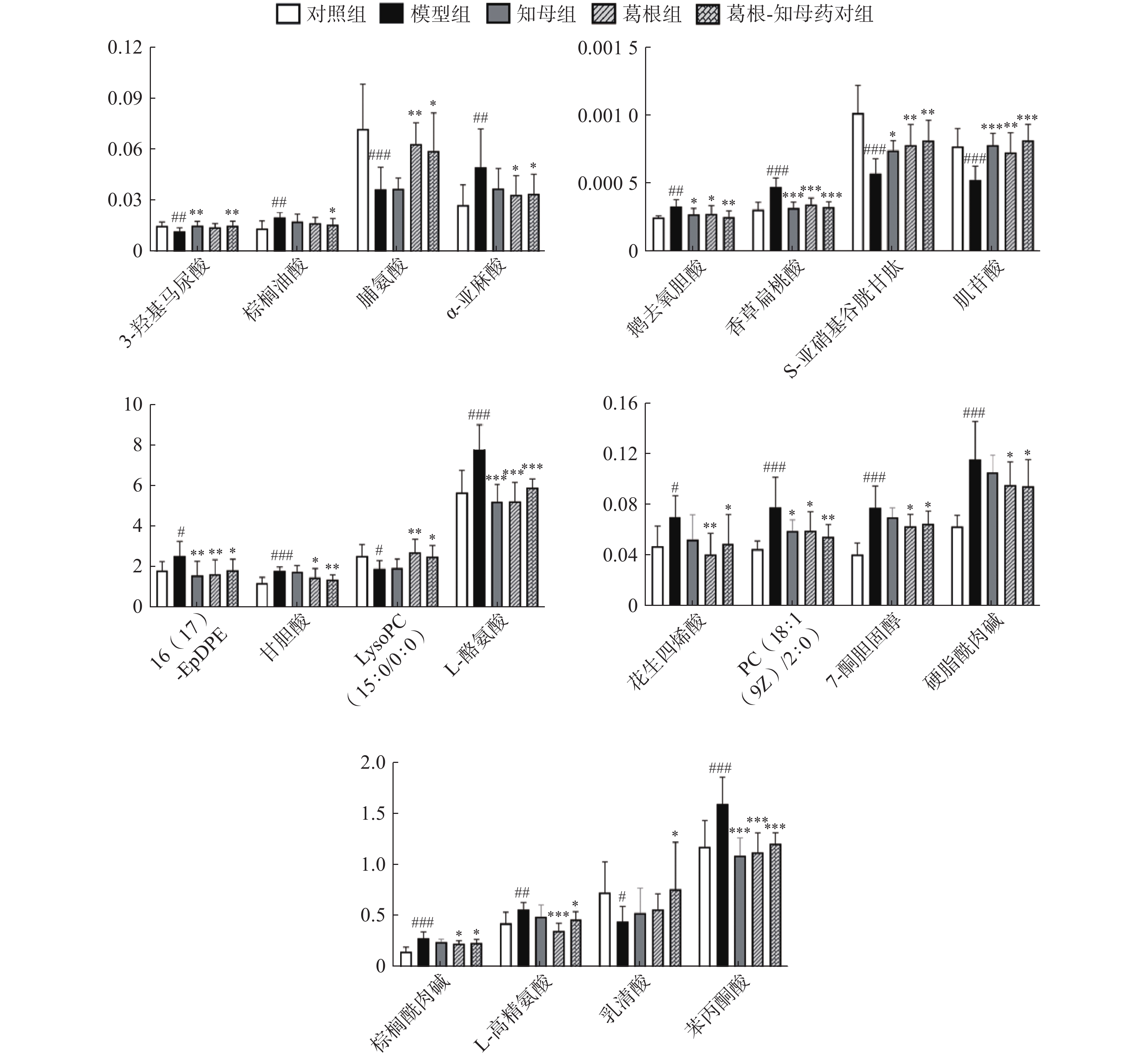
利用各组间的FC值变化情况判断药对干预后的回调代谢物。对于具有回调趋势的代谢物多组间变化情况进行单因素方差分析,P<0.05的代谢物确定为药对干预后显著回调的差异代谢物。结果显示,葛根-知母药对干预后出现回调的差异代谢物共计47个,其中,显著回调代谢物20个(表1和图5)。
对70个AD相关的差异代谢物和葛根-知母药对干预后显著回调的20个差异代谢物分别进行通路富集分析后发现(图6),AD模型大鼠潜在疾病生物标志物涉及通路主要包括苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢、亚油酸代谢、不饱和脂肪酸的生物合成、丙氨酸、天冬氨酸和谷氨酸代谢、精氨酸生物合成、酪氨酸代谢、嘧啶代谢等。葛根-知母药对干预可对苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢、不饱和脂肪酸的生物合成、酪氨酸代谢和初级胆汁酸生物合成等通路产生回调影响。
-
AD是一种复杂的中枢神经系统异质性疾病,具体病因尚不明确。目前已知可导致AD的因素包括基因突变、氧化应激、神经炎症以及多种环境和疾病因素[11] 。衰老被认为是AD最相关的危险因素[12] ,啮齿类动物长期摄入D-gal可产生包括氧化应激、炎症反应在内的多种与人类相似的衰老相关变化[13] 。铝元素可通过促进中枢神经系统炎症反应、降低脑中SOD活性,影响胆碱能神经传递、促进Tau蛋白磷酸化等形式诱导神经毒性,过量铝暴露与AD等中枢神经系统退行性疾病进展相关[14] 。研究表明,D-gal与AlCl3联合应用可产生类似于自然衰老的变化及AD相关特征[15] 。因此,本研究选取D-gal与AlCl3联合造模,通过大鼠长程给药模拟和还原AD相关的病程和病理变化,力求更加精准地反映AD患者体内代谢分子水平变化。药效学实验表明,D-gal和AlCl3联合给药后大鼠学习和记忆能力明显下降,体内氧化应激和炎症相关因子水平发生变化,表明该模型成功模拟AD相关的病理变化和特征。而葛根-知母药对干预可显著改善AD模型大鼠的学习和记忆能力,并回调SOD、NO和MDA等相关生化指标,改善和回调效果优于单药,表明葛根和知母配伍后在AD防治中具有一定的增效作用,具备进一步研究的价值。
代谢组学结果表明,葛根-知母药对可以显著回调血清中20种代谢物,主要涉及苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢、不饱和脂肪酸的生物合成、酪氨酸代谢等途径。酪氨酸是一些神经递质或者神经调节剂的前体。Liu[16]等对尸源样本进行非靶向和靶向代谢组学分析发现,AD患者海马中苯丙酮酸含量普遍上调,表明苯丙氨酸代谢失调可能是AD病理形成的重要机制。本研究同样发现AD模型大鼠血清中苯丙酮酸水平较对照组显著升高,葛根-知母药对可以显著回调苯丙酮酸至生理水平。脯氨酸是一种非必需氨基酸,参与氧化还原调控和细胞凋亡,既是活性氧(ROS)清除剂,也是ROS生产者,因此,平衡脯氨酸水平和脯氨酸相关代谢酶活性对维系细胞生理功能至关重要。脯氨酸代谢可能会通过ROS、细胞衰老和细胞免疫等机制影响神经元功能[17] 。Xu等[18]整合代谢组学与蛋白质组学结果发现,脱脂核桃粉可以通过升高小鼠脑组织中脯氨酸等多种氨基酸水平发挥对东莨菪碱诱导的AD小鼠神经保护机制。这与本实验结果相似,葛根-知母药对可以通过回调脯氨酸水平发挥AD防治作用。
此外,本研究发现多种回调代谢物与脂质代谢密切相关。花生四烯酸和α-亚麻酸是由多不饱和脂肪酸氧化产生的脂氧化物,广泛参与机体炎症、免疫等多种生理病理进程。花生四烯酸升高可进一步提高氧化应激水平,与AD等疾病进程紧密相关[19] 。AD与胆汁酸代谢异常之间存在紧密关联,这可能与肠-肝-脑轴机制相关。有研究表明AD患者血浆中胆汁酸水平升高[20] 。磷脂是保持细胞膜完整性的主要物质,溶血磷脂酰胆碱是磷脂的降解产物,与磷脂代谢密切相关,磷脂代谢异常可导致溶血磷脂酰胆碱下调,表现为细胞凋亡及信号转导异常,是AD的潜在诱因之一[21] 。本研究表明,葛根-知母药对的AD防治作用效果可能与显著回调血清中花生四烯酸、α-亚麻酸、甘胆酸、鹅去氧胆酸和溶血磷脂酰胆碱水平相关。
ROS产生与消除之间的不平衡被称为氧化应激,氧化应激是AD等疾病的关键因素和共同点。NO是ROS的一种,也是神经传递和炎症相关的重要因素。高水平ROS会触发不饱和脂肪酸的脂质过氧化,导致MDA等高反应性化合物的产生,因此MDA是脂质过氧化和氧化应激的标志。SOD是抵消ROS有害影响最有效的一线防御机制。SOD可以通过去除超氧自由基防止更具破坏力的过氧亚硝酸盐生成,并维持体内NO在生理相关水平[22, 23] 。代谢组学结果提示,葛根-知母药对回调干预的多种途径与氧化应激和脂质过氧化相关。ELISA实验结果进一步表明,葛根-知母药对干预可提高AD大鼠体内SOD水平,回调NO和MDA至生理水平,提示葛根-知母药对可以通过调节氧化应激和脂质过氧化,维持体内NO的生理水平对AD产生防治作用。
综上,本文通过建立AD大鼠模型考察了葛根-知母药对防治AD的作用效果,药对药效优于单药;运用代谢组学策略揭示其改善AD大鼠学习和记忆能力相关的潜在代谢物和代谢路径,其作用机制可能与调节苯丙氨酸、酪氨酸和色氨酸生物合成等代谢通路、改善氧化应激和脂质过氧化水平等相关,为中药药对防治AD的临床应用和进一步开发提供了科学依据。
Study on the pharmacological effects and mechanism of Gegen-Zhimu herb pair in preventing and treating Alzheimer's disease by UHPLC-Q/TOF-MS metabolomics strategy
-
摘要:
目的 运用LC-MS血清代谢组学策略评价葛根-知母药对防治阿尔茨海默病(AD)的药效并探讨其潜在作用机制。 方法 采用氯化铝(AlCl3)和D-半乳糖(D-gal)联合给药21周建立AD大鼠模型,中药干预组分别予以葛根、知母和葛根-知母药对提取液灌胃8周,通过Morris水迷宫实验和超氧化物歧化酶(SOD)、一氧化氮(NO)以及丙二醛(MDA)等生化指标评价模型效果和药效;开展基于UHPLC-Q/TOF-MS的代谢组学研究,并通过MetaboAnalyst在线网站分析相关代谢通路。 结果 AD模型组大鼠学习和记忆能力较对照组显著下降,氧化应激和脂质过氧化物水平显著升高(P<0.05),SOD含量极显著降低(P<0.01),葛根-知母药对干预能显著改善AD模型大鼠的学习记忆能力,逆转氧化应激和脂质过氧化水平,提高血清SOD含量,且效果优于单药。通过代谢组学分析,在AD模型组与对照组间共鉴定出70种差异代谢物,主要涉及苯丙氨酸、酪氨酸和色氨酸生物合成、苯丙氨酸代谢、不饱和脂肪酸的生物合成等10条通路;葛根-知母药对干预可以回调其中47种代谢物,20种回调代谢物组间差异具有统计学意义(P<0.05),涉及苯丙氨酸、酪氨酸和色氨酸生物合成等6条通路。 结论 葛根-知母药对能够显著改善AD大鼠模型的学习和记忆能力,其作用机制可能与改善氧化应激和脂质过氧化水平,增加血清SOD含量,调节苯丙氨酸、酪氨酸和色氨酸生物合成等通路相关。 Abstract:Objective To evaluate the efficacy of Puerariae lobatae radix (PLR) and Anemarrhenae Rhizoma (AR) in preventing and treating Alzheimer’s disease (AD) and explore its potential mechanism of action by LC-MS serum metabolomics strategy. Methods The AD rat model was established by administering aluminum chloride (AlCl3) and D-galactose (D-gal) for 20 weeks. The traditional Chinese medicine intervention group was given the PLR, AR, and PLR-AR extracts for 8 weeks by gavage. The model effect and efficacy were evaluated by Morris water maze test and biochemical indicators including SOD, NO, and MDA; Metabolomics research based on the UHPLC-Q/TOF-MS method was conducted, and relevant metabolic pathways were analyzed through the MetaboAnalyst online website. Results The learning and memory abilities of AD model rats were significantly decreased compared with the control group, and the levels of oxidative stress and lipid peroxides were significantly increased (P<0.05), while the SOD content was decreased considerably (P<0.01). The learning and memory abilities of AD model rats were improved, oxidative stress and lipid peroxidation levels were reversed, and serum SOD content was increased significantly after the intervention of PLR-AR, with better effects than single drugs. Through metabolomics, 70 differential metabolites were identified between the AD model group and the control group, mainly involving 10 pathways, including phenylalanine, tyrosine, and tryptophan biosynthesis, phenylalanine metabolism, and unsaturated fatty acid biosynthesis, et.al. The intervention of PLR-AR could adjust 47 metabolites, with 20 metabolites showing significant differences (P<0.05). The significantly adjusted metabolites involve 6 pathways, including phenylalanine, tyrosine, and tryptophan biosynthesis, et al. Conclusion The combination of PLR and AR could significantly improve the learning and memory abilities of AD rat models. The mechanism may be related to the improvement of oxidative stress and lipid peroxidation levels, the increase of serum SOD content, and the regulation of phenylalanine, tyrosine, and tryptophan biosynthesis pathways. -
Key words:
- Alzheimer's disease /
- metabolomics /
- Gegen-Zhimu /
- herb pair /
- mechanism
-
胶质瘤是成人最常见的原发性脑肿瘤之一,占恶性脑肿瘤的70%以上,具有恶性程度高、侵袭性强、治疗效果及预后差等特点,临床主要治疗手段为手术切除、放化疗或两者联合治疗[1]。然而,血脑屏障(BBB)的选择通透性以及肿瘤细胞的多药耐药(MDR)特点给胶质瘤的治疗带来了挑战[2]。
BBB指的是位于中枢神经系统的一种无孔微血管结构,主要由血管内皮细胞以及位于内皮细胞层囊腔表面的壁细胞组成[3]。BBB的主要功能是维护大脑内环境的稳态,严格管控物质进出大脑,保障大脑功能的正常运行。然而,这种保护作用限制了很多药物进入脑内,使得一些治疗脑部疾病的药物难以在病灶部位达到有效药物浓度,成为药物治疗脑部疾病的重要制约因素[3-4]。
冰片属芳香开窍类中药,又名2-茨醇,属于小分子脂溶性双环单萜类物质,其主要有效成分为龙脑。在《中国药典》2020版中,收录的冰片有两种:一种通过人工合成而得,名为冰片,又名合成龙脑;另一种为经樟科植物樟[Cinnamomum cam phora(L.)Presl]的新鲜枝、叶提取加工而得的天然冰片,又名右旋龙脑[5]。现代药理学研究表明冰片具有促进药物透过各种体内外屏障,抗菌、保护心脑血管、镇痛抗炎以及防止血栓等多种药理作用[6-7]。近年来,许多研究表明冰片与抗胶质瘤的化疗药物联合应用,可以明显提高化疗药物的生物利用度和治疗疗效,本文就近年来冰片对胶质瘤化疗的辅助治疗临床前研究作一综述,以期为胶质瘤的临床治疗提供新的思路。
1. 冰片与化疗药物联用辅助治疗胶质瘤
冰片作为一种新型的单萜类化学增敏剂,可以增加体内外BBB的通透性,当冰片与化疗药物联用时,可促进化疗药物顺利透过BBB进入肿瘤部位,从而提高化疗药物的生物利用度和疗效。
冰片能改善化疗药物的药动学,提高药物在肿瘤部位的蓄积。例如,段美美等[8]在考察天然冰片对顺铂在大鼠原位C6脑胶质瘤模型体内药动学及脑组织分布的影响中发现,在血浆中,与0.5%CMC-Na的溶媒对照组相比,冰片高剂量联用组t1/2β、Cmax显著增大,AUC显著减小;而在脑组织中,与溶媒对照组相比,冰片高、低剂量联用组AUC均显著增大,这说明天然冰片使顺铂更多的向脑组织转运,提高了顺铂在脑组织的生物利用度。此外,组织病理学观察发现,联用组的胶质瘤细胞核密度降低,细胞凋亡率升高。类似地,郭军洽等[9]同样证明了天然冰片可促进甲氨蝶呤(MTX)透过BBB,提高其在病灶部位的生物利用度,并且发现MTX药动学参数的改变与冰片呈剂量相关性,高剂量冰片能显著提高MTX的瘤区脑组织生物利用度。由此可见,冰片可以有效提高化疗药物的BBB透过率,改善药物在脑组织的生物利用度,为促进化疗药物增效提供有力的依据。
吉西他滨是一种临床上用于非小细胞肺癌和胰腺癌的化疗药物,有研究发现,瘤腔内直接注射吉西他滨对脑胶质瘤的治疗效果良好[10],但由于该药水溶性较大,因此静脉给药后吉西他滨难以透过血脑屏障,脑部的生物利用度很低。张帆等[11]考察了冰片对吉西他滨药动学的影响,通过构建大鼠原位9Lacz胶质瘤模型,采用微透析法收集给药后脑肿瘤部位的脑脊液,实时监测冰片对吉西他滨在大鼠脑组织的浓度变化。结果发现,与单用吉西他滨组比较,吉西他滨联合冰片给药组Cmax及AUC均增加,t1/2延长,表明冰片提高了吉西他滨在9Lacz脑胶质瘤模型大鼠脑肿瘤区域的生物利用度。
为客观评价药动学的改善带来的确切疗效,进一步探究冰片对化疗药物抗胶质瘤的促进作用,有学者进行了两者联合用药的药效学研究。范成普等[12]在大鼠C6脑胶质瘤模型中将冰片和替莫唑胺联合应用,探讨了冰片对替莫唑胺疗效的影响。结果发现,与空白对照组、单用替莫唑胺组以及单用冰片组相比,冰片联合替莫唑胺组的肿瘤体积显著减小;另外,肿瘤组织HE染色显示,肿瘤细胞核密度以及细胞凋亡率与其它三组相比最低,细胞增殖受到抑制。该实验说明了冰片可以促进肿瘤细胞凋亡、减小肿瘤体积,增强替莫唑胺的抗胶质瘤作用。
冰片还可以与纳米药物联合应用提高药物的靶向性。CCKRK肽是一种与肿瘤新生血管内皮细胞的硫酸乙酰肝素受体高度亲和的配体[13]。Lv等[14]将冰片与CCKRK肽修饰的紫杉醇前药自组装氧化还原响应纳米粒(CGKRK-PSNPs)联用,结果发现,冰片可增强CGKRK-PSNPs在体外血脑屏障模型中的转运;在裸鼠颅内U87MG胶质瘤中,通过实时荧光图像观察到CGKRK-PSNPs与冰片联用时药物的较高积累,且裸鼠中位生存期(39天)延长,这表明冰片促进了CGKRK-PSNPs纳米粒进入BBB,从而提高其抗胶质瘤疗效。
以上研究通过构建动物胶质瘤模型,通过灌胃冰片结合化疗药物注射的方式将两者联合应用研究了冰片对化疗药物的影响。一方面,从药动学的角度阐明了冰片可以有效促进化疗药物透过BBB,提高脑组织生物利用度;另一方面,通过药效学实验结果证明了冰片可以提高化疗药物的抗胶质瘤效果。
2. 冰片与化疗药物共载增效
研究发现,纳米递药系统能够帮助药物更好地穿过BBB,在中枢神经系统发挥治疗作用[15]。因此,在基于冰片能促进药物跨BBB的基础上,有学者尝试将冰片与化疗药物共载于纳米递药系统中,形成冰片药物复合纳米粒,以期更方便更高效地将化疗药物靶向递送至脑组织。
经冰片修饰的多柔比星纳米粒能提高其在小鼠体内的抗胶质瘤效果。Meng等[16]将冰片与DSPE-PEG(2000)-COOH结合,合成了一种新型载体DSPE-PEG(2000)-BO,并将多柔比星载入其中,利用该载体通过静电自组装法制备了冰片修饰的负载阿霉素的纳米胶束(DOX BO-PMs)。体外研究结果显示,DOX BO-PMs显著提高了多柔比星通过BBB的运输效率以及抑制胶质瘤细胞增殖的作用;体内药效学研究显示,DOX BO-PMs显著抑制胶质母细胞瘤的生长和转移。
研究发现,冰片与京尼平苷经鼻灌注联合给药,京尼平苷的生物利用度增加[17],这说明冰片可以促进药物在鼻腔的吸收。赵等[18]采用乳化-溶剂挥发法制备出一种载多西紫杉醇的经鼻给药纳米靶向系统(DTX-Bo-RGD-NPs) ,该给药系统由冰片与精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp, RGD)共同修饰。利用荧光染料Dir与纳米粒结合,经大鼠C6胶质瘤模型评价了DTX-Bo-RGD-NPs的体内靶向性,结果发现,DTX-Bo-RGD-NPs中的Dir在脑肿瘤组织中的荧光强度是未加冰片修饰的(DTX-RGD-NPs)1.74倍;C6大鼠脑胶质瘤原位模型药效学结果显示,DTX-RGD-NPs组荷瘤大鼠生存期为18.5天,而DTX-Bo-RGD-NPs组的生存期为21天;DTX-Bo-RGD-NPs的肿瘤细胞凋亡率是DTX-RGD-NPs的1.40倍。这说明冰片与化疗药物共载显著提高经鼻给药的纳米药物向脑组织转运,有望为难治性疾病脑胶质瘤的治疗提供一种新型的经鼻给药治疗手段, 提高难治性脑胶质瘤的治疗效果。
冰片与化疗药物共载制备成纳米给药系统相比普通单一药物的纳米粒表现出更强的脑靶向作用。与直接联用相比,共载的形式将更方便于临床使用,但是冰片与药物物理混合还是共修饰或共载的效果比较还有待研究。
3. 冰片辅助化疗增效机制
3.1 诱导活性氧产生
活性氧(ROS)是由线粒体和其他细胞器产生的一组寿命较短、高活性的含氧分子,可诱导DNA损伤[19]。癌细胞区别于正常细胞的特征之一是它们能够产生更多的ROS,以及它们对抗氧化防御系统的依赖性增强[20]。许多化疗药物可通过诱导ROS产生,促进胶质瘤细胞的凋亡[7,21-23],现在一些研究发现冰片也具有相同促进作用。
冰片与化疗药物联用可增加ROS的产生达到增强抗胶质瘤效果。Cao等[24]发现天然冰片联用顺铂使U251细胞活力降低,亚G1期细胞数量增加;免疫印迹实验表明天然冰片通过激活含半胱氨酸的天冬氨酸蛋白水解酶(Caspases) 和触发ROS过度产生来促进顺铂诱导肿瘤细胞凋亡;郭源源等[25]也同样发现冰片通过增加细胞ROS水平增强紫杉醇的抗U87细胞作用。Liu等[26]利用冰片增强ROS产生的特点,将天然冰片与抗胶质瘤药物替莫唑胺联用,发现裸鼠U251胶质瘤模型的肿瘤体积相比对照组显著减小。
3.2 打开BBB的紧密连接
紧密连接是维持BBB功能的重要组成部分,控制着依靠浓度梯度被动运输进入大脑的物质。紧密连接由闭锁蛋白(occludin)、闭合蛋白(claudins)、连接黏附分子家族(JAM)以及与它们相连的紧密连接蛋白(ZO)组成[27]。
冰片可逆性开放紧密连接。陈艳明等[28]在体外血脑屏障模型的研究中发现,冰片能使细胞间紧密连接变得松散、细胞吞饮囊泡增大、数量增多,而移除冰片24 h后上述作用消失,这说明冰片开放BBB的作用可逆。
Duan等[29]在大鼠C6胶质瘤模型中研究了天然冰片对BBB通透性的影响,通过顺铂在大鼠脑内的浓度变化评价天然冰片对BBB的开放程度,结果发现,与对照组相比,冰片低剂量组和高剂量组中顺铂在脑组织的生物利用度显著提高;免疫组化及ELISA实验表明冰片可逆下调了ZO-1和纤维型肌动蛋白(F-actin)的表达水平。这说明冰片可能通过下调紧密连接相关蛋白的表达增加了BBB的通透性,从而促进了顺铂进入脑内。
3.3 抑制P-糖蛋白的活性,逆转化疗药物耐药
P-糖蛋白(P-gp)是一种由MDR基因编码的糖蛋白,主要存在于血管内皮细胞中,参与各种药物和毒素的外排,P-gp在肿瘤细胞中大量表达是导致肿瘤细胞耐药的主要原因,后续研究发现P-gp在血脑屏障毛细血管上也有大量表达[30-32]。因此,克服P-gp的外排作用一方面可以使化疗药物更多的透过血脑屏障,提高并维持药物在脑脊液的浓度;另一方面也可以减少肿瘤细胞的耐药性。
维拉帕米是一种P-gp抑制剂,研究发现维拉帕米能够在体外逆转P-gp引起的耐药性[33]。陈艳明等[34]研究表明冰片可以通过抑制细胞膜上P-gp的活性明显地增强长春新碱所致人宫颈癌细胞系(Hela)和犬肾细胞系(MDCK)的细胞毒性,而这种作用与P-gp拮抗剂维拉帕米相似。Tang等[35]制备出一种共载冰片和紫杉醇的脂质白蛋白纳米粒(BOR/PTX LANs) ,以P-gp抑制剂环孢霉素A作为阳性对照,发现冰片通过抑制P-gp的外排作用增加C6细胞对紫杉醇的摄取。
Wang等[36]以维拉帕米作为阳性对照,以罗丹明123(Rh123)的大鼠肠吸收参数和表观渗透系数(Papp)为考察指标研究冰片对P-gp的影响。结果发现,冰片显著增加Caco-2细胞对Rh123的吸收,提高Rh123在大鼠空肠和回肠的吸收速率和Papp,该实验证实了冰片可以抑制肠道中P-gp的表达。Yu等[37]发现大鼠口服冰片后海马体和下丘脑中的Rh123明显增加,说明冰片对这两个区域中P-gp的抑制作用较强。进一步通过蛋白表达实验和逆转录聚合酶链反应(RT-PCR)发现冰片对P-gp的抑制作用与降低海马体和下丘脑中多药耐药基因1a(MDR1a)、多药耐药蛋白基因1b(MDR1b)、多药耐药蛋白1(Mrp1)有关。
3.4 下调缺氧诱导因子-1α的表达
缺氧诱导因子-1α(HIF-1α)是一种转录因子,在肿瘤细胞的缺氧微环境中被激活,有研究发现HIF-1α的表达水平与胶质瘤的病理分级呈正相关[38]。
合成冰片通过靶向mTORC1/eIF4E通路下调HIF-1α表达,诱导原发胶质瘤细胞凋亡从而抑制肿瘤生长。Wang等[39]研究了合成冰片对大鼠C6胶质瘤移植模型以及人原发性胶质瘤细胞增殖的抑制作用。研究结果表明,与对照组相比,冰片组显著地抑制了肿瘤生长,诱导胶质瘤细胞凋亡,且具有浓度依赖性;蛋白印迹实验表明冰片可以下调Bcl-2的表达,上调Bax和caspase-3的表达;而在细胞转染了过表达HIF-1α的质粒后,这种作用被逆转,这说明冰片是通过HIF-1α介导诱导人原代培养胶质瘤细胞凋亡。此外,还发现mTORC1 siRNA抑制了eIF4E的表达,eIF4E siRNA抑制了HIF-1α的表达,提示mTORC1/eIF4E通路参与缺氧条件下人脑胶质瘤原代培养细胞HIF-1α的表达调控。
4. 结语
冰片与化疗药物联用增加药物透过BBB,提高病灶部位有效药物浓度,增强抗胶质瘤效果;冰片与化疗药物共载制备成冰片药物复合纳米粒使纳米粒的靶向性进一步增强,给药更加方便。冰片增效作用机制主要包括诱导ROS产生,增强对肿瘤细胞的DNA损伤作用;打开BBB的紧密连接,提高化疗药物生物利用度;抑制P-gp,有效逆转肿瘤细胞的MDR;下调HIF-1α的表达,诱导胶质瘤细胞凋亡等。冰片的辅助作用有效地改善化疗药物对胶质瘤细胞的多药耐药性,降低血脑屏障对化疗药物的阻碍与外排作用。但值得注意的是,基于冰片与化疗药物联合应用于胶质瘤的研究还处在临床前研究阶段,目前也暂无相关制剂上市,要实现从实验室到临床的转变还需解决一些问题,比如冰片种类的选择、冰片增效的安全有效剂量范围等。冰片与化疗药物联用及共载达到靶向增效目的是一种新型的给药策略,有望为胶质瘤的临床治疗提供新的思路与方法,具有广阔的开发前景。
-
表 1 差异代谢物鉴定、趋势和相关通路分析结果
序号 代谢物 色谱柱 分子质量(m/z) 化学式 加合离子 趋势 相关通路 P 值 1 2-羟基丁酸 T3 127.0362 C4H8O3 M+Na ↑ 丙酸代谢 1.22E-03 2 肌酸 T3 132.0781 C4H9N3O2 M+H ↑# 甘氨酸、丝氨酸和苏氨酸代谢 6.98E-03 3 脯氨酸 T3、HILIC 138.0553 C5H9NO2 M+Na ↓#* 精氨酸和脯氨酸代谢 4.20E-03 4 L-天冬氨酸 T3 133.0606 C4H8N2O3 M+H ↑# 丙氨酸、天冬氨酸和
谷氨酸代谢2.36E-02 5 L-乙酰基肉碱 T3 204.1218 C9H17NO4 M+H ↑ 不饱和脂肪酸的生物合成 1.26E-03 6 棕榈酰肉碱 T3 400.3424 C23H45NO4 M+H ↑#* 脂肪酸降解 2.38E-04 7 喹啉酸 T3 168.0271 C7H5NO4 M+H ↑ 烟酸和烟酰胺代谢 4.97E-04 8 焦谷氨酸 T3 128.0329 C5H7NO3 M-H ↓# 谷胱甘肽代谢 2.89E-02 9 3b-羟基-5-胆酸 T3 357.2789 C24H38O3 M+H-H2O ↑ − 1.01E-02 10 香草酸 T3 151.0361 C8H8O4 M+H-H2O ↑ − 3.05E-03 11 肌酸酐 T3 136.0491 C4H7N3O M+Na ↑# − 1.89E-04 12 戊烯二酸 T3 153.0198 C5H6O4 M+Na ↑ − 8.96E-03 13 亚油酸 T3 303.2327 C18H32O2 M+Na ↑# 亚油酸代谢 2.45E-02 14 4-羟基丁酸 T3 103.0382 C4H8O3 M-H ↑# − 4.49E-03 15 糖原 T3 689.2111 C24H42O21 M+Na ↑ 淀粉和蔗糖代谢 2.24E-02 16 肉豆蔻酸 T3 211.2038 C14H28O2 M+H-H2O ↑# 脂肪酸生物合成 4.15E-02 17 丙酰肉碱 T3 218.1383 C10H19NO4 M+H ↓# 支链脂肪酸的氧化 1.97E-02 18 硬脂酰肉碱 T3 428.3734 C25H50NO4 M+H ↑#* 长链饱和脂肪酸的
线粒体β氧化2.84E-04 19 花生四烯酸 T3 327.232 C20H32O2 M+Na ↑#* 花生四烯酸代谢 1.53E-02 20 N1乙酰精胺 T3 267.208 C12H28N4O M+Na ↑# 赖氨酸降解 3.71E-02 21 N6, N6, N6-三甲基-L-赖氨酸 T3 189.16 C9H20N2O2 M+H ↑# α-亚麻酸代谢 4.44E-02 22 α-亚麻酸 T3 279.2316 C18H30O2 M+H ↑#* 初级胆汁酸生物合成 2.80E-02 23 24羟基胆固醇 T3 425.343 C27H46O2 M+Na ↑# 半胱氨酸和蛋氨酸代谢 8.17E-04 24 2-氧代-4-甲硫基丁酸 T3 131.0189 C5H8O3S M+H-H2O ↑ 不饱和脂肪酸的生物合成 1.14E-02 25 二十碳五烯酸 T3 285.2212 C20H30O2 M+H-H2O ↑# − 2.45E-02 26 油酰乙醇酰胺 T3 348.2891 C20H39NO2 M+Na ↑# − 8.42E-03 27 吲哚-3-丙酸 T3 190.0858 C11H11NO2 M+H ↓# − 4.79E-04 28 棕榈油酸 T3 237.2193 C16H30O2 M+H-H2O ↑#* − 5.79E-03 29 15(S)-羟基二十碳三烯酸 T3 345.2341 C20H34O3 M+Na ↑# − 9.83E-03 30 十四酰肉碱 T3、HILIC 372.3103 C21H41NO4 M+H ↑# − 1.15E-02 31 3-羟基马尿酸 T3 178.0501 C9H9NO4 M+H-H2O ↓#* − 9.53E-03 32 18-羟基花生四烯酸 T3 343.225 C20H32O3 M+Na ↑# − 3.91E-02 33 亚麻酰基肉碱 T3 424.3414 C25H46NO4 M+H ↑# − 4.25E-04 34 LysoPC(15:0/0:0) T3 526.3057 C23H48NO7P M+FA-H ↓#* − 2.55E-02 35 PC(18:1(9Z)e/2:0) T3 550.3872 C28H56NO7P M+H ↑#* − 2.11E-03 36 7-酮胆固醇 T3 401.3455 C27H44O2 M+H ↑#* − 1.08E-04 37 9-十六碳烯酰肉碱 T3 398.3152 C23H43NO4 M+H ↑# − 9.43E-05 38 16(17)-EpDPE T3 343.2219 C22H32O3 M-H ↑#* − 3.33E-02 39 十八烯酰肉碱 T3 426.3578 C25H47NO4 M+H ↑# − 1.84E-04 40 肉豆蔻酰肉碱 T3 370.2951 C21H39NO4 M+H ↑ − 4.25E-03 41 DL-乙酰肉碱 T3 204.1227 C9H17NO4 M+H ↑ 嘧啶代谢 1.85E-03 42 胞苷一磷酸 HILIC 368.0407 C9H14N3O8P M+FA-H ↓# 甘氨酸、丝氨酸和苏氨酸代谢 2.74E-02 43 胆碱 HILIC 86.0963 C5H14NO M+H-H2O ↑ 初级胆汁酸生物合成 1.20E-02 44 甘胆酸 HILIC 466.33 C26H43NO6 M+H ↑#* 苯丙氨酸、酪氨酸和色氨酸生物合成 2.43E-04 45 L-酪氨酸 HILIC 182.0812 C9H11NO3 M+H ↑#* 苯丙氨酸、酪氨酸和色氨酸生物合成 2.89E-03 46 苯丙氨酸 HILIC 166.0862 C9H11NO2 M+H ↑ 嘌呤代谢 1.68E-03 47 肌苷酸 HILIC 383.0262 C10H13N4O8P M+Cl ↓#* 丙氨酸、天冬氨酸和
谷氨酸代谢9.85E-04 48 L-天门冬氨酸 HILIC 134.0433 C4H7NO4 M+H ↑ 苯丙氨酸、酪氨酸和色氨酸生物合成 5.14E-04 49 苯丙酮酸 HILIC 165.0546 C9H8O3 M+H ↑#* 嘧啶代谢 6.25E-03 50 乳清酸 HILIC、T3 179.0029 C5H4N2O4 M+Na ↓#* 鞘脂代谢 3.04E-02 51 鞘氨醇 HILIC 302.3059 C18H39NO2 M+H ↑# 酪氨酸代谢 6.59E-04 52 香草扁桃酸 HILIC 233.0192 C9H10O5 M+Cl ↑#* 酪氨酸代谢 6.72E-05 53 酪胺 HILIC 120.079 C8H11NO M+H-H2O ↑ − 2.50E-03 54 3-氧代-4, 6 -胆二烯酸 HILIC 393.2315 C24H34O3 M+Na ↑# 初级胆汁酸生物合成 1.46E-02 55 鹅去氧胆酸 HILIC 437.2877 C24H40O4 M+FA-H ↑#* 丙氨酸、天冬氨酸和
谷氨酸代谢7.30E-04 56 谷氨酰胺 HILIC 169.0584 C5H10N2O3 M+Na ↑# − 5.06E-04 57 亮氨酸 HILIC 133.0855 C6H12O3 M+H ↑ − 5.18E-03 58 高-L-精氨酸 HILIC 189.1292 C7H16N4O2 M+H ↑#* − 1.22E-02 59 马尿酸 HILIC、T3 178.0516 C9H9NO3 M-H ↓# − 2.94E-02 60 牛磺胆酸3-硫酸盐 HILIC 596.2653 C26H45NO10S2 M+H ↑ − 1.78E-05 61 鹅去氧胆酸3-硫酸盐 HILIC 455.2515 C24H40O7S M+H-H2O ↑ 半胱氨酸和蛋氨酸代谢 2.76E-03 62 硫代半胱氨酸 HILIC 187.9645 C3H7NO2S2 M+Cl ↓# 亚油酸代谢 8.23E-05 63 13-L-过氧化氢亚油酸 HILIC 311.2187 C18H32O4 M-H ↓# − 4.63E-03 64 S-亚硝基谷胱甘肽 HILIC 381.0763 C10H16N4O7S M+FA-H ↓#* 鞘脂代谢 8.86E-05 65 LacCer(d18:1/12:0) HILIC 806.5705 C42H79NO13 M+H ↑ 花生四烯酸代谢 1.30E-04 66 LysoPC(14:0/0:0) HILIC、T3 512.3009 C22H46NO7P M+FA-H ↓ − 3.34E-02 67 2-(14,15-环氧二十碳三烯酰基)甘油 HILIC 395.2749 C23H38O5 M+H ↑ − 1.41E-03 68 赖氨酰苯丙氨酸 HILIC 294.1891 C15H23N3O3 M+H ↑ 醚脂代谢 2.52E-04 69 二十四碳四烯酸肉碱 HILIC、T3 526.3786 C31H53NO4 M+Na ↑ − 2.98E-05 70 1-(11Z二十二碳烯酰基)-3-磷酸甘油酯 HILIC 515.3163 C25H49O7P M+Na ↑ − 8.91E-07 注:↑表示模型组较对照组相对升高趋势,↓表示模型组较对照组相对下降趋势,P值为模型组与对照组间代谢物水平的t检验计算结果;
#表示代谢物经葛根-知母药对干预后具有回调趋势(共47个),*表示代谢物(共20个)经葛根-知母药对干预后回调差异具有统计学意义(P<0.05)。 -
[1] SCHELTEN P, De STROOPE B, KIVIPELTO M, et al. Alzheimer's disease[J]. The Lancet, 2021, 397(10284):1577-1590. doi: 10.1016/S0140-6736(20)32205-4 [2] KIM A Y, JERDI S A, MACDONALD R, et al. Alzheimer’s disease and its treatment-yesterday, today, and tomorrow[J]. Front Pharmacol, 2024, 15:1399121. doi: 10.3389/fphar.2024.1399121 [3] YAN H Y, FENG L N, LI M Q. The role of traditional Chinese medicine natural products in β-amyloid deposition and tau protein hyperphosphorylation in Alzheimer’s disease[J]. Drug Des Devel Ther, 2023, 17:3295-3323. doi: 10.2147/DDDT.S380612 [4] 郭凤, 郝蕊, 陈鹏德, 等. 基于肠道菌群和肠黏膜屏障探讨玉液汤防治气阴两虚证糖尿病肾病大鼠的作用研究[J]. 世界科学技术-中医药现代化, 2024, 26(05):1308-1319. [5] 国家药典委员会. 中华人民共和国药典-二部: 2020年版[M]. 北京: 中国医药科技出版社, 2020: 329-527. [6] 韩莉花, 袁欣, 杨真儿, 等. 葛根知母药对调控HMGB1/RAGE/NF-κB通路改善糖尿病大鼠认知障碍[J]. 中药药理与临床, 2020, 36(1):124-130. [7] LIU X, HUANG R, WAN J Y. Puerarin: a potential natural neuroprotective agent for neurological disorders[J]. Biomed Pharmacother, 2023, 162:114581. doi: 10.1016/j.biopha.2023.114581 [8] ZHANG Q, YAN Y P. The role of natural flavonoids on neuroinflammation as a therapeutic target for Alzheimer’s disease: a narrative review[J]. Neural Regen Res, 2023, 18(12):2582-2591. doi: 10.4103/1673-5374.373680 [9] CHEN W Y, LI R T, ZHU S Q, et al. Nasal timosaponin BII dually sensitive in situ hydrogels for the prevention of Alzheimer’s disease induced by lipopolysaccharides[J]. Int J Pharm, 2020, 578:119115. doi: 10.1016/j.ijpharm.2020.119115 [10] CHUNG Y, LEE H, INITIATIVE T A D N. Correlation between Alzheimer’s disease and type 2 diabetes using non-negative matrix factorization[J]. Sci Rep, 2021, 11(1):15265. doi: 10.1038/s41598-021-94048-0 [11] ZHAI W J, ZHAO M, WEI C X, et al. Obesity-induced chronic low-grade inflammation in adipose tissue: a pathway to Alzheimer’s disease[J]. Ageing Res Rev, 2024, 99:102402. doi: 10.1016/j.arr.2024.102402 [12] KELLER J N. Age-related neuropathology, cognitive decline, and Alzheimer’s disease[J]. Ageing Res Rev, 2006, 5(1):1-13. doi: 10.1016/j.arr.2005.06.002 [13] FIRDAUS Z, SINGH N, PRAJAPATI S K, et al. Centella asiatica prevents D-galactose-Induced cognitive deficits, oxidative stress and neurodegeneration in the adult rat brain[J]. Drug Chem Toxicol, 2022, 45(3):1417-1426. doi: 10.1080/01480545.2020.1833907 [14] TYCZYŃSKA M, GĘDEK M, BRACHET A, et al. Trace elements in Alzheimer’s disease and dementia: the current state of knowledge[J]. J Clin Med, 2024, 13(8):2381. doi: 10.3390/jcm13082381 [15] CHIROMA S M, MOHD MOKLAS M A, MAT TAIB C N, et al. D-galactose and aluminium chloride induced rat model with cognitive impairments[J]. Biomedecine Pharmacother, 2018, 103:1602-1608. doi: 10.1016/j.biopha.2018.04.152 [16] LIU P, YANG Q, YU N, et al. Phenylalanine metabolism is dysregulated in human hippocampus with Alzheimer’s disease related pathological changes[J]. J Alzheimers Dis, 2021, 83(2):609-622. doi: 10.3233/JAD-210461 [17] YAO Y X, HAN W P. Proline metabolism in neurological and psychiatric disorders[J]. Mol Cells, 2022, 45(11):781-788. doi: 10.14348/molcells.2022.0115 [18] XU X J, DING Y, LIU M H, et al. Neuroprotective mechanisms of defatted walnut powder against scopolamine-induced Alzheimer’s disease in mice revealed through metabolomics and proteomics analyses[J]. J Ethnopharmacol, 2024, 319(Pt 1): 117107. [19] XU M T, LIU D, WANG L L. Role of oxylipins in ovarian function and disease: a comprehensive review[J]. Biomed Pharmacother, 2024, 178:117242. doi: 10.1016/j.biopha.2024.117242 [20] SHAO Y P, OUYANG Y, LI T B, et al. Alteration of metabolic profile and potential biomarkers in the plasma of Alzheimer’s disease[J]. Aging Dis, 2020, 11(6):1459-1470. doi: 10.14336/AD.2020.0217 [21] 周玲, 刘颖, 贡盈歌, 等. 阿尔茨海默病模型小鼠脑组织生物标记物代谢组学分析[J]. 沈阳药科大学学报, 2016, 33(6):459-465. [22] JOMOVA K, ALOMAR S Y, ALWASEL S H, et al. Several lines of antioxidant defense against oxidative stress: antioxidant enzymes, nanomaterials with multiple enzyme-mimicking activities, and low-molecular-weight antioxidants[J]. Arch Toxicol, 2024, 98(5):1323-1367. doi: 10.1007/s00204-024-03696-4 [23] SEIDITA A, CUSIMANO A, GIULIANO A, et al. Oxidative stress as a target for non-pharmacological intervention in MAFLD: could there be a role for EVOO?[J]. Antioxidants, 2024, 13(6):731. doi: 10.3390/antiox13060731 -





 下载:
下载: