-
鸡骨草(Abri Herba)来源于豆科相思子属植物广州相思子(Abrus cantoniensis Hance),野生资源主要集中分布于岭南地区以及中南半岛等地,《中华人民共和国药典》(2020年版)[1]及部分地方中药材标准[2]、中药饮片炮制规范[3]等均有收录,药用具有利湿退黄、清热解毒、疏肝止痛之功,常用于湿热黄疸、胁肋不舒、胃脘胀痛、乳痈肿痛、急慢性肝炎、胆囊炎等。鸡骨草含有多种活性物质,包括皂苷类[4]、黄酮类、生物碱类[5]、多糖[6]、氨基酸[7]、挥发油及脂肪酸[8]等,如相思子皂苷Ⅰ、大豆皂苷、槐花皂苷、夏佛塔苷、异夏佛塔苷、相思子碱、刺桐碱等。文献研究发现,鸡骨草具有促进伤口愈合[9]、抗菌[10]、抗病毒[11]、抗氧化[12]、抗肿瘤、免疫调节[13]、抗肝炎病毒[14]、降脂保肝[15-16]等作用,民间也常用鸡骨草制作药膳、凉茶,具有较高的食用价值。目前鸡骨草法定质量标准主要对鸡骨草性状、显微、薄层色谱法(TLC)鉴别相思子碱等项做了初步的质量控制,相思子碱能够较好地反应鸡骨草正品的特性,但是相思子碱在相思子属其他植物中亦有发现,专属性不强,目前市场上常见有相思子属毛相思子(Abrus mollis Hance)与其混淆应用。通过网络药理学[17]及分子对接技术[18]寻找适合鸡骨草质量控制的质量标志物(Q-marker)[19-20],建立符合鸡骨草药用活性特征的质量标准,能够更好地鉴定鸡骨草的质量及药用食用价值。
-
赛默飞Vanquish Core型液相色谱仪(赛默飞世尔科技有限公司);岛津LC-20A型液相色谱仪(日本岛津株式会社);SK7200H超声波清洗器(上海科导超声仪器有限公司);RH-600A高速多功能粉碎机(浙江荣洁工资有限公司);XS105DU电子天平(梅特勒-托利多公司);鼓风式干燥箱(上海般诺生物科技有限公司);色谱柱:Thermo AcclaimTM 120 C18(4.6 mm×250 mm,5 μm,120Å,赛默飞世尔科技有限公司)、Agilent ZORBAX SB-C18(4.6 mm×250 mm,5 μm,安捷伦科技公司)、Diamonsil® C18(4.6 mm×250 mm,5 μm,北京迪马科技有限公司)。
-
鸡骨草(经海军军医大学药学系黄宝康教授鉴定为豆科植物广州相思子Abrus cantoniensis Hance的干燥全草),药材市场采购或产地采集,根据采集地不同分别设置批号为JGC-xx(采集序号)-xxx(样品序号),共13个批次;相思子碱对照品(中国食品药品检定研究院,批号:111808-202003)、刺桐碱对照品(中国食品药品检定研究院,批号:112058-202001)、夏佛塔苷对照品(中国食品药品检定研究院,批号:111912-202204,纯度:94.9%)、异夏佛塔苷对照品(四川维克奇生物科技有限公司,纯度:98%);乙腈、甲醇(色谱纯,Merck公司);甲酸(分析级,国药集团);蒸馏水(广州屈臣氏食品饮料有限公司)。
-
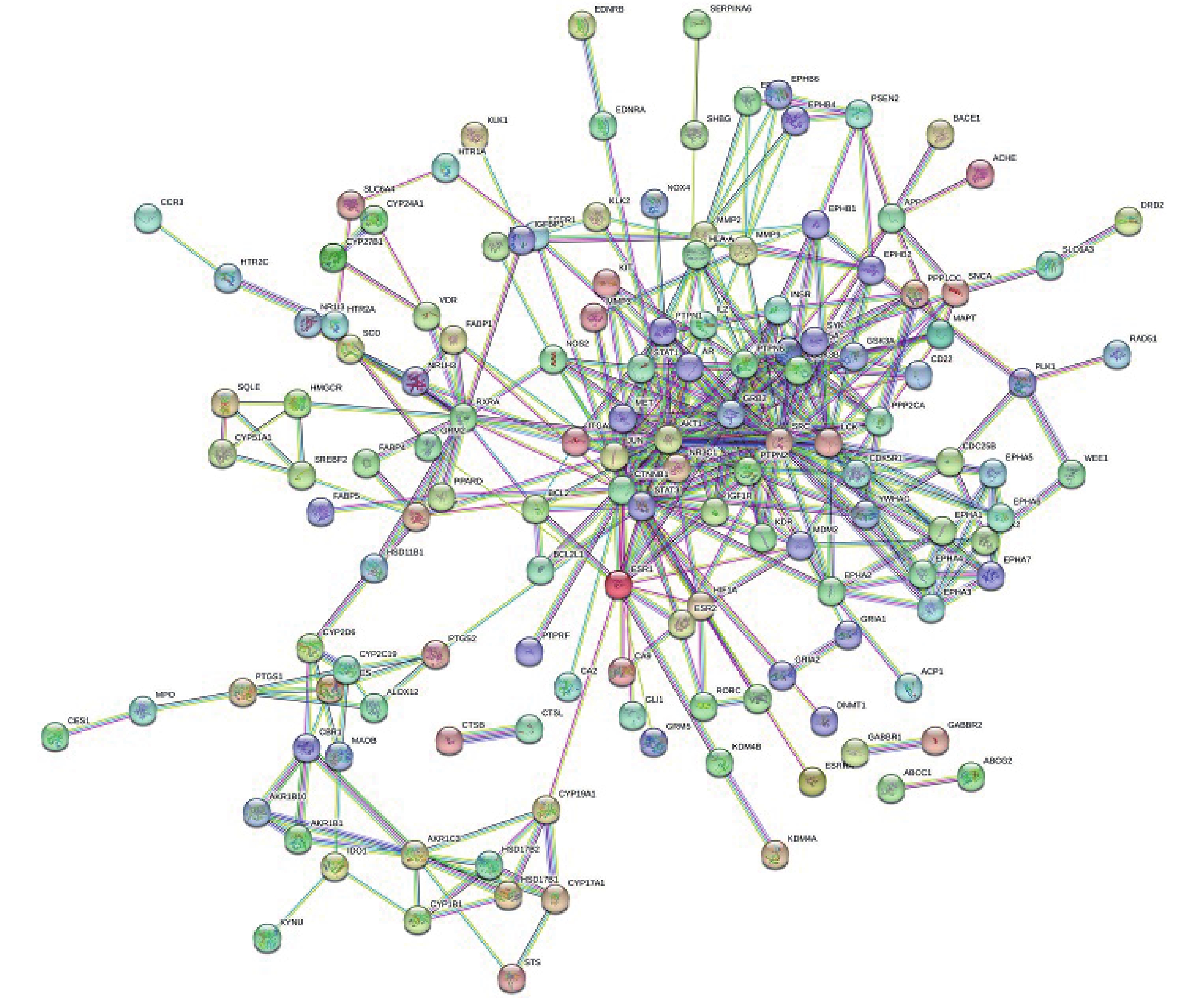
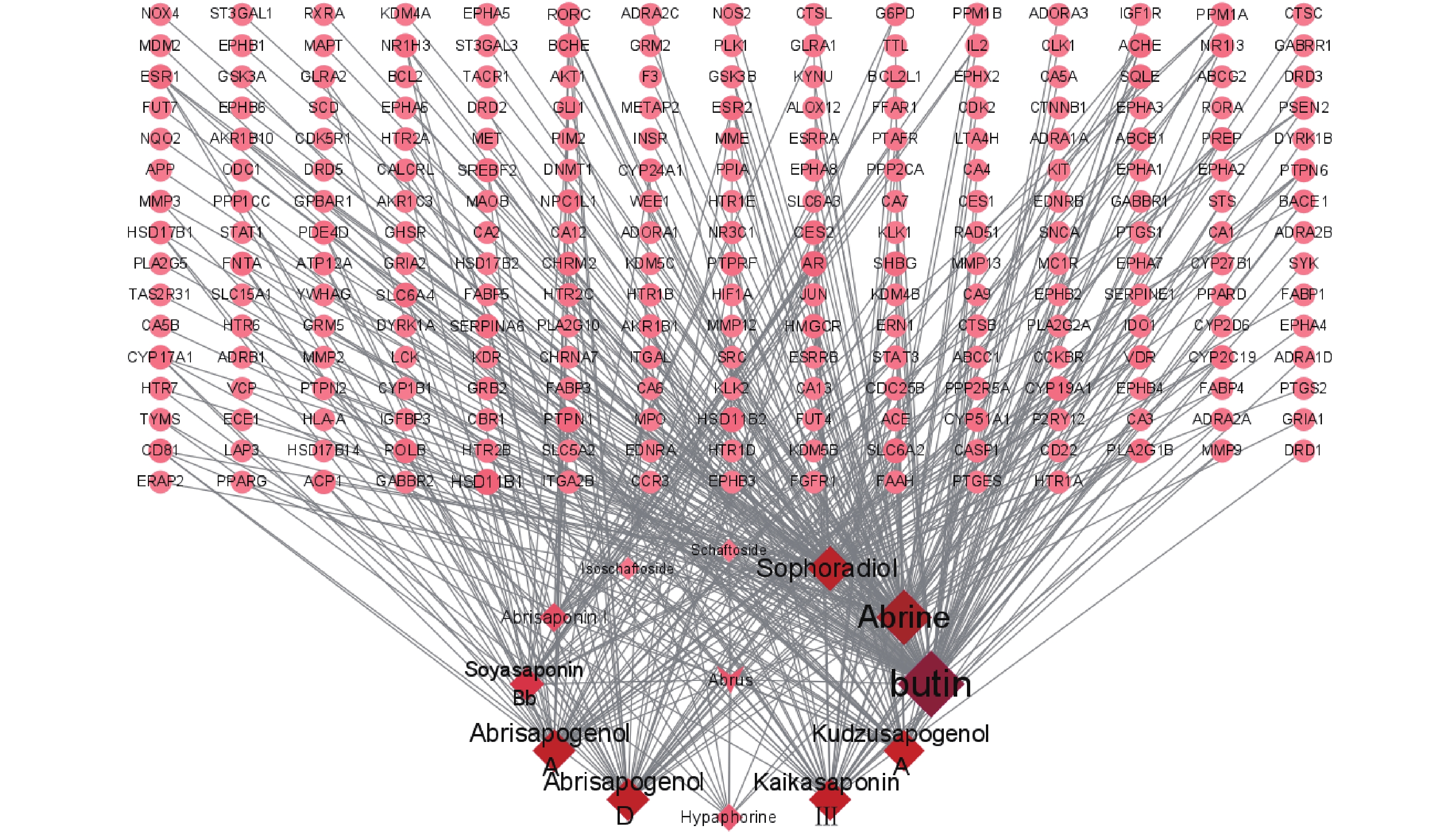
检索中药网络药理学常用数据库与分析平台TCMSP(https://old.tcmsp-e.com/tcmsp.php)、TCMID(http://www.megabionet.org/tcmid/)、ETCM(http://www.tcmip.cn/ETCM/index.php/Home/Index/)等,结合鸡骨草主要活性化合物文献检索,根据OB值、OD值以及类药5原则等,获取鸡骨草中活性明确且具有成药性的化合物,再通过 Pubchem查询相关化合物Canonical SMILES 编号,输入Swiss Target Prediction(http://www.swisstargetprediction.ch/)获取化合物所对应的靶标蛋白的Uniprot ID。共选取Soyasaponin Bb、Kaikasaponin Ⅲ、Abrisapogenol A、Abrisapogenol D、Sophoradiol、Kudzusapogenol A、 Abrisaponin I、Abrine、Hypaphorine、Schaftoside、Isoschaftoside、butin等12种不同结构的化合物,筛选其药理活性作用靶点,筛去重复靶标,最终获得237个靶标,通过Cytoscape3.8.2软件构建“鸡骨草-成分-潜在靶点”可视化网络图(图1)。网络中包括250个节点和440条边,平均节点度值3.520。
-
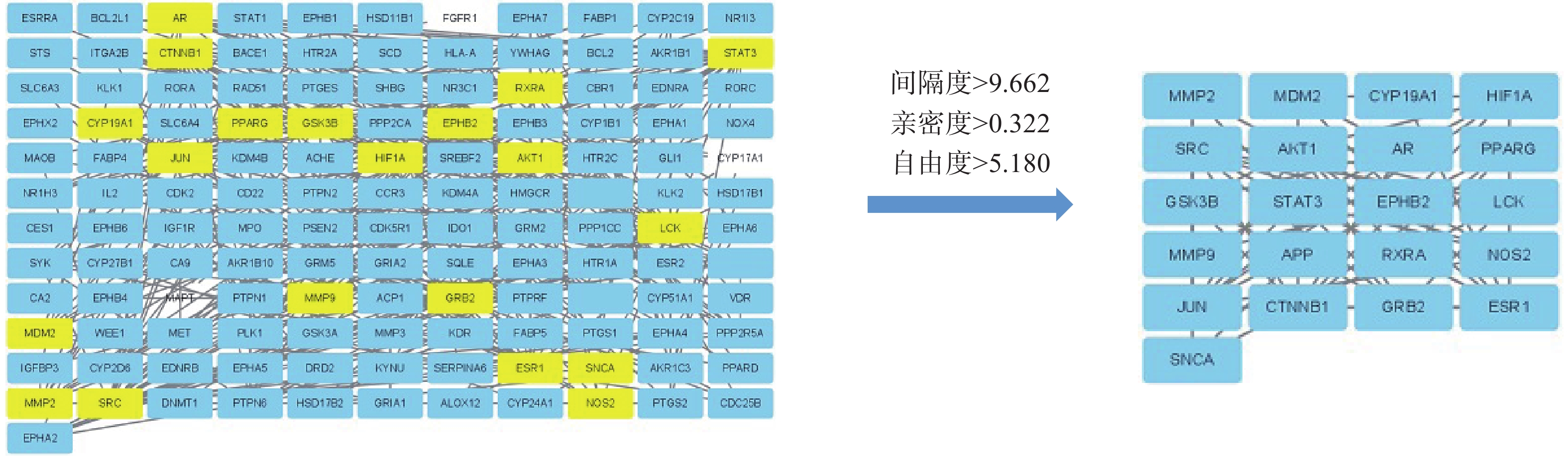
将“2.1.1”项下筛选所得靶标导入STRING 11.0 在线数据库(https://string-db.org/cgi/input.pl)进行PPI 网络分析。选择物种为“Homo sapiens”,蛋白交互参数评分值为“high confidence>0.9”,隐藏网络中无联系的节点,其余参数设置不变,获得化合物靶点PPI网络图(图2)。结果共获得237个节点,360条边,平均节点度为3.04,预期边数135,PPI富集P值<1.0e-16。再将PPI结果以TSV文本格式导入Cytoscape 3.8.2软件中,进行拓扑属性分析,选取亲密度、间隔度、自由度3个重要参数,共计筛选21个网络参数大于均值(0.322、9.662、5.180)的核心靶标(图3)。包括信号传导与转录激活因子3(STAT3)、基质金属蛋白酶2、9(MMP2、9)、蛋白激酶(AKT1)、表面活性蛋白C(SRC)、淋巴细胞特异蛋白酪氨酸激酶(LCK)、雌激素受体alpha(ESRα)、过氧化物酶体增生激活受体γ(PPARγ)、一氧化氮合酶2(NOS2)、缺氧诱导因子-1alpha(HIF1A)、生长因子受体结合蛋白2(GRB2)、双微体2蛋白(MDM2)、糖原合酶激酶3Β(GSK3B)、酪氨酸蛋白激酶受体B2(EPHB2)、α-突触核蛋白(SNCA)等靶标。
-
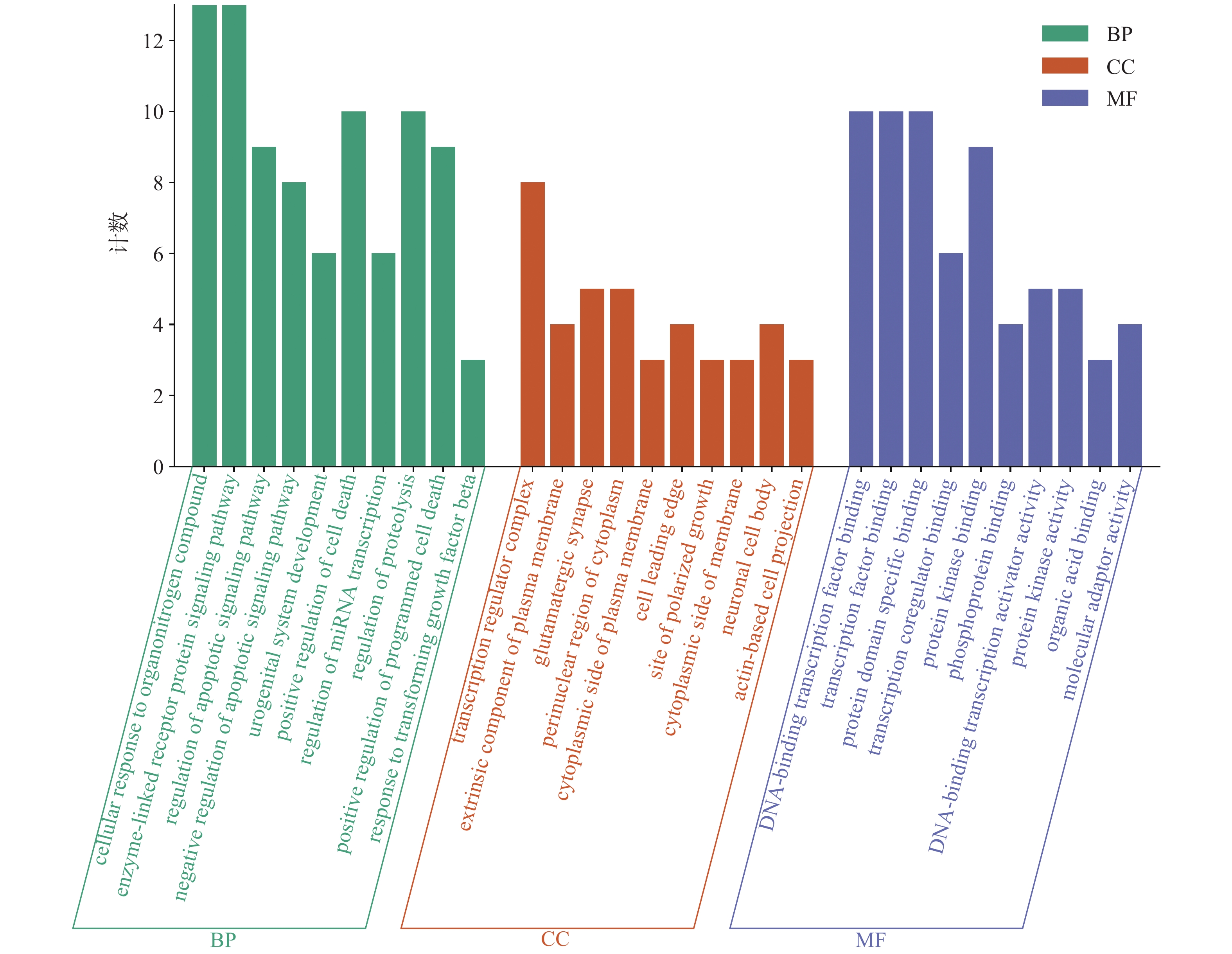
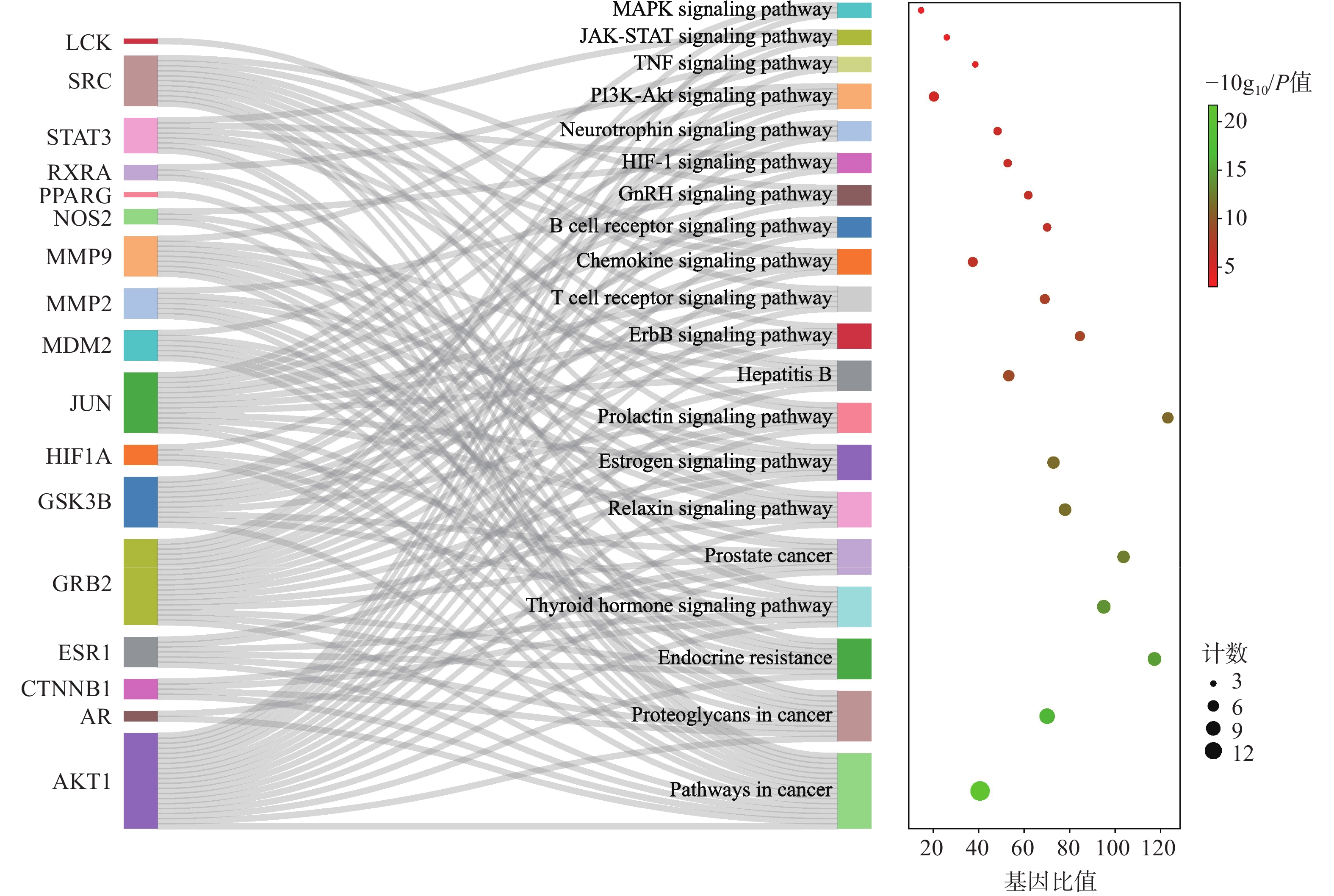
应用metascape 数据库(https://metascape.org/gp/index.html)对21个主要潜在的靶点进行基因本体(GO)功能和基因组百科全书(KEGG)通路富集分析。其中,靶点经生物过程(BP)相关条目463 条,主要涉及细胞凋亡正调控(positive regulation of cell death)、蛋白质水解调控(regulation of proteolysis)、细胞对有机氮化合物的反应(cellular response to organonitrogen compound)、TGF-β响应(response to transforming growth factor-beta)等;细胞组分(CC)有34个条目,主要涉及复合物转录调节(transcription regulator complex)、谷氨酸突触(glutamatergic synapse)、细胞质核周区(perinuclear region of cytoplasm)等;分子功能(MF)有42个条目,主要涉及DNA-结合转录因子结合(DNA-binding transcription factor binding)、转录因子结合(transcription factor binding)、蛋白质结构域特异性结合(protein domain specific binding)、蛋白激酶活性(protein kinase activity)、分子适配器活性(molecular adaptor activity)等,各选取显著性前10 条目展示(图4)。KEGG通路富集分析得到79个通路条目,选取显著性前20的条目通过桑基图呈现(图5)。Y轴为信号通路,X轴为该通路靶向基因占总基因的比率,气泡颜色表示该通路基因富集的显著性,气泡大小表示该通路的基因数量。其中AKT1、STAT3、HIF1A、GRB2、MMP9等主要靶点蛋白与松弛素信号通路(relaxin signaling pathway)、甲状腺激素信号通路(thyroid hormone signaling pathway)、B细胞受体信号通路(B cell receptor signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)、ErbB信号途径(ErbB signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、JAK-STAT 信号通路(JAK-STAT signaling pathway)、乙型肝炎(hepatitis B)等具有较强的关联性。
-
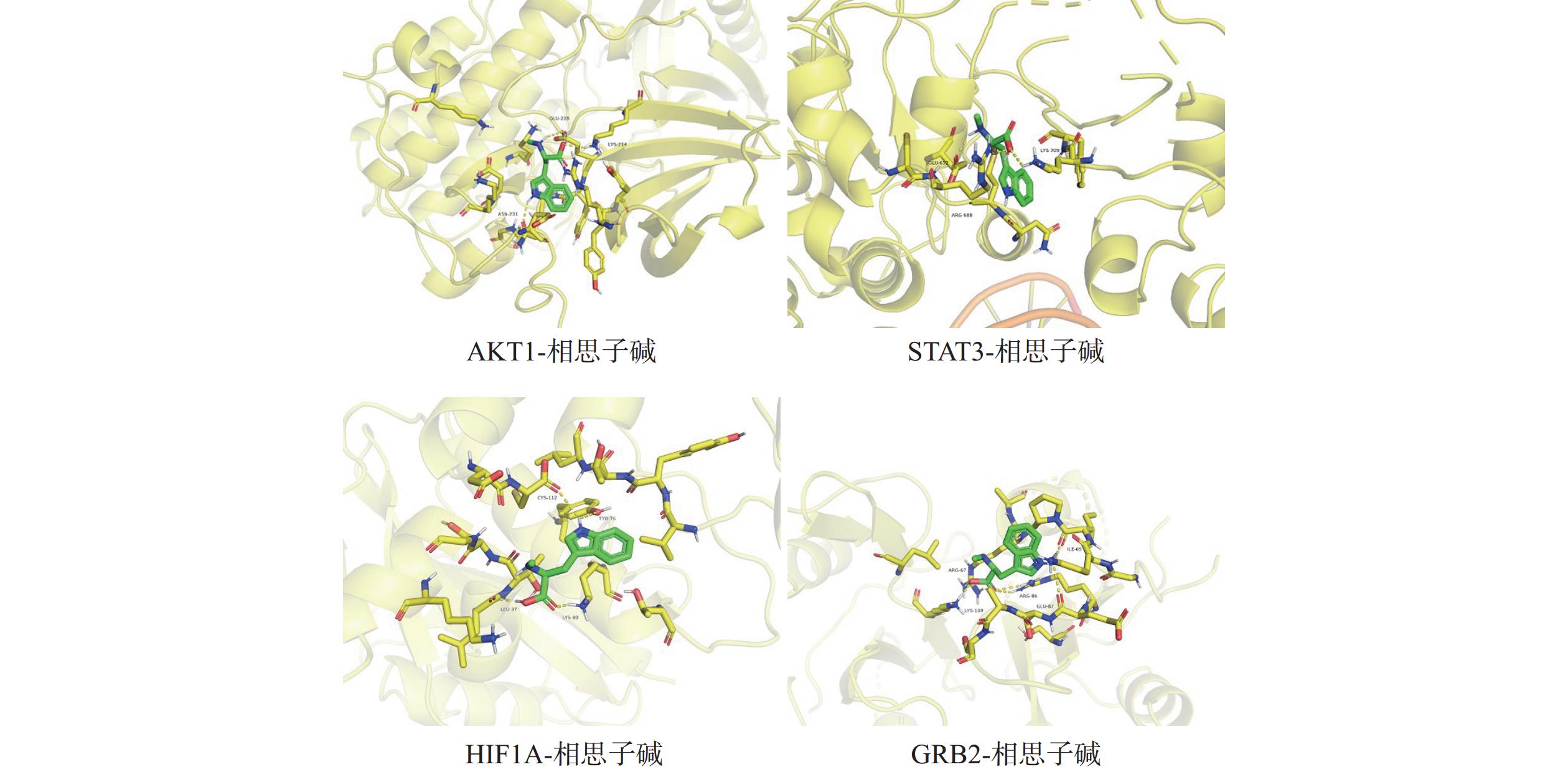
通过PubChem获取相思子碱、刺桐碱、夏佛塔苷等化合物3D结构,根据自由度选取“成分-靶点-通路”网络中靠前的靶标,检索PDB数据库(http://www.rcsb.org/)获得靶标蛋白结构,再将蛋白与化合物结构文件导入 pymol 软件进行去水、加氢、删除重复链等预处理,模拟化合物与靶标作用模式,计算结合能,结合能小于0表明可以自由结合,结果如表1、图6所示。
表 1 成分-靶标分子对接结果
靶标 PDB ID 活性成分 结合能(kcal/mol) AKT1 4GAH 相思子碱 −4.67 刺桐碱 −4.34 夏佛塔苷 −2.98 STAT3 5AX3 相思子碱 −4.72 刺桐碱 −4.56 夏佛塔苷 −2.82 HIF1A 3OUI 相思子碱 −4.02 刺桐碱 −3.93 夏佛塔苷 −2.36 大豆皂苷Bb −0.27 GRB2 3IMD 相思子碱 −5.0 刺桐碱 −5.66 夏佛塔苷 −4.68 大豆皂苷Bb −2.46 MMP2 8H78 相思子碱 −7.21 刺桐碱 −7.02 夏佛塔苷 −5.83 大豆皂苷Bb −4.28 -
成分分析采用C18色谱柱(Thermo、Agilent、Diamonsil);流动相采用梯度洗脱,A相为乙腈,B相为0.2%甲酸溶液,梯度洗脱程序:0~10 min(5%~10%B);10~20 min(10%~12%B);20~30 min(12%~13%B);30~35 min(13%~14%B);35~40 min(14%~16%B);40~55 min(16%~18%B);55~60 min(18%~20%B);60~65 min(20%~22%B);65~70 min(22%~30%B);70~75 min(30%~40%B);75~80 min(40%~60%B);80~85 min(60%~75%B);85~95 min(75%~75%B)。柱温设置为25℃、30℃、35℃。流速:0.8 ml/min、1.0 ml/min、1.2 ml/min。检测波长278 nm。进样量:10 μl。
-
①对照品储备液的制备:精密称取相思子碱、刺桐碱、夏佛塔苷、异夏佛塔苷对照品5~10 mg,分别置10 ml容量瓶中,加甲醇定容,摇匀,制备对照品储备液。②供试品溶液的制备:精密称取样品粉末1 g置锥形瓶中,加甲醇50 ml,称定重量,加热回流提取2 h,取出,称定,补足损失的量,滤过,回收溶剂,残渣加甲醇5 ml使溶解,微孔滤膜过滤,制得供试品溶液。
-
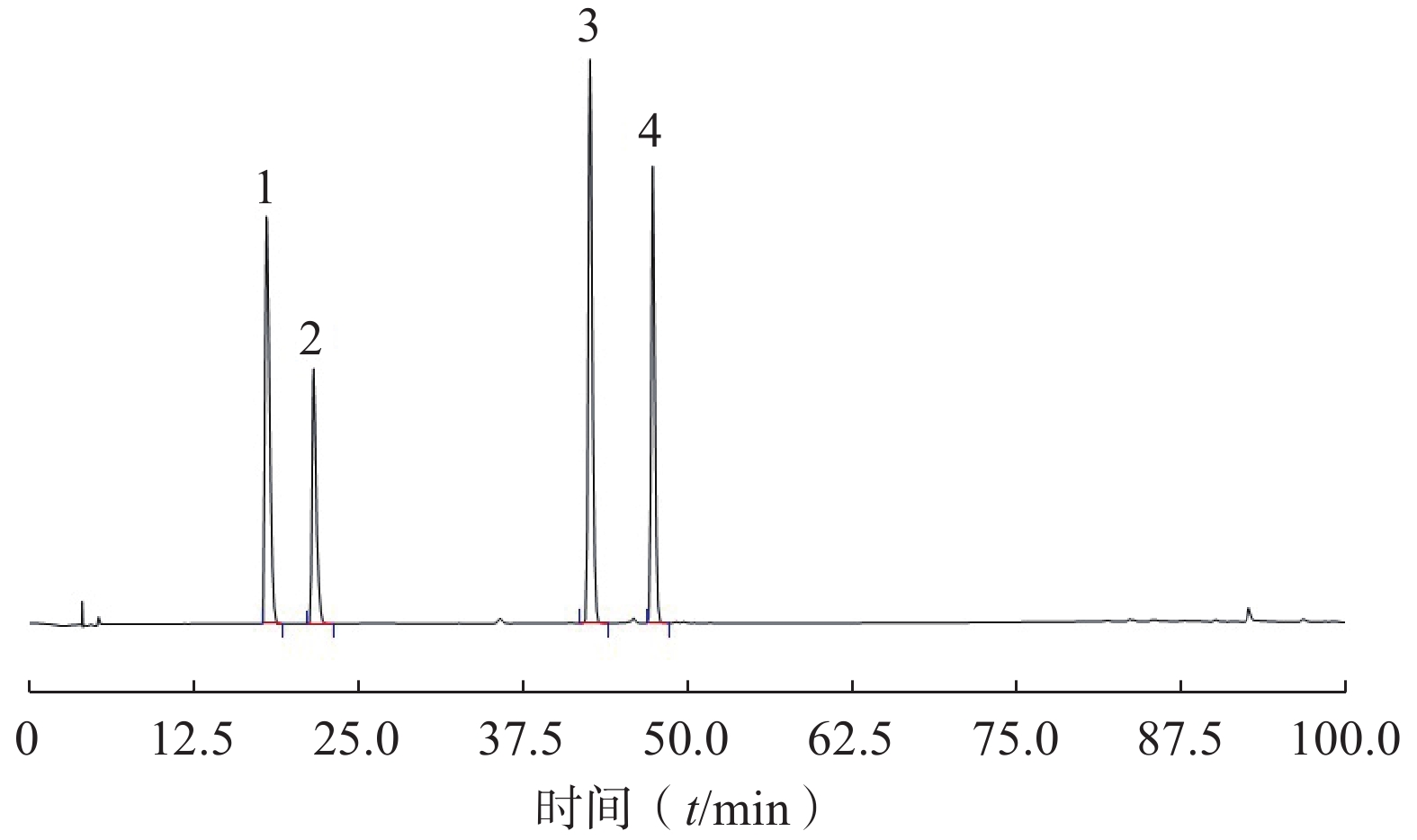
精密量取混合对照品溶液10 μl注入液相色谱仪,测定对照品保留时间及峰面积,平行测定5次,计算相思子碱、刺桐碱、夏佛塔苷、异夏佛塔苷保留时间及峰面积RSD,保留时间RSD分别为0.6%、0.7%、0.4%、0.3%,峰面积RSD均为0.3%(图7、表2)。
表 2 对照品色谱峰相对保留时间
峰 名称 保留时间
(t/min)相对保留
时间精密度
RSD(%)峰1 相思子碱 18.058 1.00 0.6 峰2 刺桐碱 21.658 1.20 0.7 峰3 夏佛塔苷 42.865 2.37 0.4 峰4 异夏佛塔苷 47.433 2.63 0.3 -
取供试品JGC01-010按照2.3.2项下供试品溶液制备法制备供试品溶液,分别在0、2、4、12、24 h测定相思子碱、刺桐碱、夏佛塔苷、异夏佛塔苷对照品保留时间,计算RSD,分别为0.09%、0.10%、0.05%、0.05%(表3)。
表 3 稳定性实验色谱峰保留时间(t/min)
时间(t/h) 相思子碱 刺桐碱 夏佛塔苷 异夏佛塔苷 0 16.892 20.783 42.283 46.967 2 16.892 20.783 42.283 46.967 4 16.900 20.808 42.308 47.000 8 16.867 20.758 42.258 46.950 12 16.858 20.742 42.242 46.942 24 16.875 20.775 42.300 47.000 RSD(%) 0.09 0.10 0.05 0.05 -
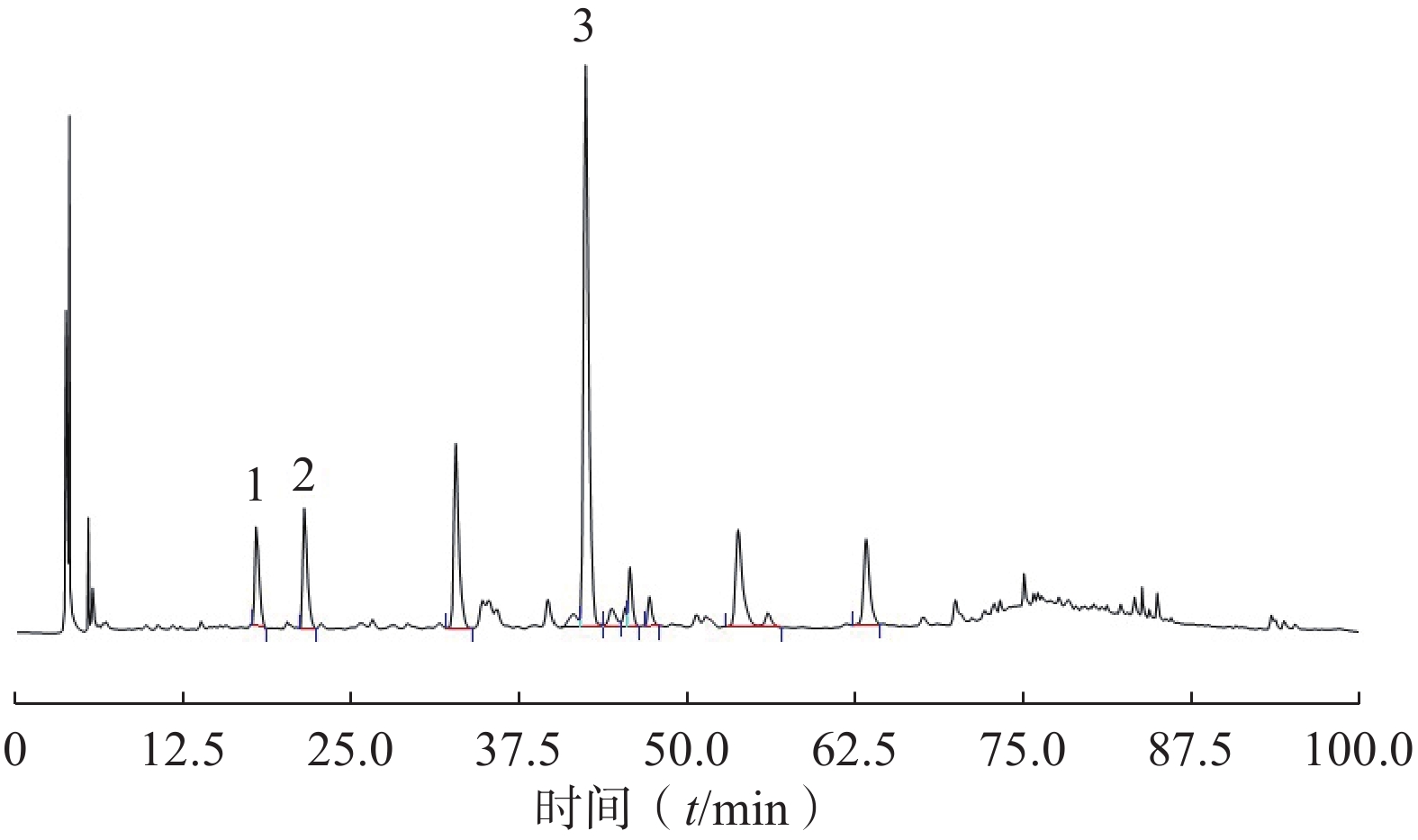
测定13批样品,记录样品中相思子碱、刺桐碱、夏佛塔苷、异夏佛塔苷等色谱峰的保留时间及峰面积,并计算其相对保留时间及偏差(表4 )。根据出峰时间及样品化合物峰型特征分析,部分供试品中异夏佛塔苷未检测到或含量较低超出仪器检出范围,不具有共有峰特征。因此选择相思子碱、刺桐碱、夏佛塔苷等3种化合物的色谱峰作为特征峰,相对保留时间为1.00、1.21、2.39,可控制偏差范围±5%。参考《中华人民共和国药典》(2020年版)通则指导原则的有关规定,拟定供试品色谱中应呈现相思子碱、刺桐碱、夏佛塔苷3种化合物的特征峰,并应与对照品色谱峰保留时间相对应(图8)。
表 4 样品特征峰相对保留时间(n=13)
样品 相思子碱峰 刺桐碱峰 夏佛塔苷峰 异夏佛塔苷峰 保留时间
(t/min)相对保
留时间保留时间
(t/min)相对保
留时间保留时间
(t/min)相对保
留时间保留时间
(t/min)相对保
留时间对照品 18.058 1.00 21.658 1.20 42.865 2.37 47.433 2.63 JGC-01-001 17.717 1.00 21.175 1.20 42.400 2.39 46.767 2.64 JGC-01-002 17.733 1.00 21.183 1.19 42.200 2.38 46.917 2.65 JGC-01-003 18.025 1.00 21.658 1.20 42.900 2.38 − − JGC-01-004 18.033 1.00 21.683 1.20 43.950 2.44 47.483 2.63 JGC-01-006 18.183 1.00 21.408 1.18 42.700 2.35 47.542 2.61 JGC-01-007 17.967 1.00 21.675 1.21 42.933 2.39 − − JGC-01-010 16.881 1.00 20.775 1.22 42.279 2.49 47.000 2.78 JGC-03-004 17.650 1.00 21.225 1.20 42.475 2.41 − − JGC-03-012 17.833 1.00 21.350 1.20 42.325 2.37 48.392 2.71 JGC-04-003 17.000 1.00 21.575 1.27 42.175 2.48 47.083 2.77 JGC-04-004 17.475 1.00 21.500 1.23 42.417 2.43 45.683 2.61 JGC-04-006 17.975 1.00 22.650 1.26 42.417 2.36 − − JGC-04-007 17.892 1.00 21.400 1.20 42.708 2.39 47.067 2.63 平均值 17.720 1.00 21.481 1.21 42.606 2.40 47.104 2.67 RSD(%) 2.1 0.0 1.9 2.1 1.1 1.7 1.4 2.3 注:“-”为样品中未检测到相关色谱峰。 -
分别采用Thermo、Agilent、Diamonsil色谱柱考察色谱柱的影响;柱温在20℃、25℃、30℃考察柱温的影响;流速为0.8、1.0、1.2 ml/min考察流速的影响。根据测定数据分析,色谱柱、柱温、流速均对特征峰相对保留时间具有一定的影响,其中流速及色谱柱型号对峰3、峰4影响较大,各色谱峰的影响RSD小于5.0%,属于可接受的范围(表5)。
表 5 不同色谱条件对相对保留时间的影响(n=3)
色谱条件 相对保留时间 峰1 峰2 峰3 峰4 色谱柱 Thermo 1.00 1.20 2.37 2.63 Agilent 1.00 1.22 2.54 2.93 Diamonsil 1.00 1.24 2.51 2.82 平均値 1.00 1.22 2.47 2.79 RSD(%) 0.00 1.30 3.00 4.40 柱温(℃) 25 1.00 1.20 2.34 2.60 30 1.00 1.20 2.37 2.63 35 1.00 1.19 2.34 2.64 平均値 1.00 1.20 2.35 2.62 RSD(%) 0.00 1.40 1.10 0.70 流速(ml/min) 0.8 1.00 1.20 2.37 2.63 1.0 1.00 1.20 2.53 2.85 1.2 1.00 1.19 2.66 3.08 平均値 1.00 1.20 2.52 2.85 RSD(%) 0.00 0.40 4.70 6.40 -
运用网络药理学的方法对中药成分进行研究,然后预测其药理活性作用测靶点、分析通路,再通过实验验证,探索中药的作用机制[21],进而预测中药作用的物质基础,寻找中药质量标志物,能够较好地结合中药的药效建立质量控制标准[22]。通过网络药理学预测发现,鸡骨草主要成分相思子碱、刺桐碱、夏佛塔苷等药理活性与STAT3、MMP2、AR、AKT1、SPC、LCK、ESR1、CTNNB1、PPARγ、NOS2、HIF1A等靶标有关,可能作用于松弛素信号通路、HIF-1信号通路、ErbB信号途径、PI3K-Akt信号通路、JAK-STAT 信号通路等多种信号通路。实验研究发现,相思子碱可以通过抑制NOS、VEGF的表达,促进IL-1β刺激的人软骨细胞C28/I2进行细胞增殖并抑制细胞凋亡,进而起到治疗骨性关节炎的作用[23]。刺桐碱可以通过PI3K-Akt信号通路调控PPARγ起到抗炎的作用[24]。夏佛塔苷及异夏佛塔苷等能够通过调控PPARα及其下游蛋白,减少促炎性细胞因子生成,产生抗炎、抗氧化等作用,具有潜在的非酒精性脂肪肝治疗作用[25]。异夏佛塔苷可有效抑制脂多糖诱导的iNOS生成和促炎性细胞因子(TNF-α、IL-1β和COX2)的表达,能够显著降低脂多糖诱导的HIF1A、HK2和PFKFB3蛋白的表达[26]。文献报道的实验研究结果进一步验证了网络药理学的预测结果。因此,网络药理学在基于药理活性的鸡骨草质量标志物预测上具有一定价值,能够为鸡骨草质量标准的建立提供药效预测及研究基础。
鸡骨草药用为全草,但市场上鸡骨草药材叶损失严重,这是否会造成药材成分及其含量的变化进而影响药材质量?该实验分别取鸡骨草(JGC-003-012)供试品根、茎、叶等不同部位粉末1 g,参照2.3.2项下制备供试品溶液,测定药材不同部位相思子碱、刺桐碱、夏佛塔苷等化合物的含量,记录保留时间及峰面积。计算含量发现根、茎、叶等不同部位所含3种成分含量分别为根:0.12%、0.08%、未检出;茎:0.02%、0.01%、0.06%;叶:未检出、0.01%、0.20%,相思子碱及刺桐碱主要存在于根、茎中,夏佛塔苷主要存在于叶和茎中,与文献报道[27]一致。因此保证根、茎、叶的相对存量是保障鸡骨草药材质量的重要因素。另外该实验同时测定了13批次鸡骨草药材的水分、总灰分、酸不溶性灰分及浸出物的量,对鸡骨草质量标准的研究具有一定意义。
鸡骨草除药用外,岭南多地常用于食疗保健中。由于相思子属鸡骨草、毛鸡骨草等基源相近、形态相似、民间及中医临床上常同功效应用,市场上常有毛鸡骨草等混淆或掺伪为鸡骨草药材,而现行版《中华人民共和国药典》(一部)2020年版及部分收载鸡骨草的中药标准等对鸡骨草质量的控制主要集中在性状和相思子碱的薄层鉴别上,而相思子碱在相思子属相思子、毛鸡骨草、美丽相思子等植物中均有发现,仅以此为指标化合物专属性不强。目前基于化学成分与药理活性的关联为依据制定中药质量仍然是中药质量标准研究的主要方向。本实验通过网络药理学与分子对接预测鸡骨草主要活性成分,筛选出药理活性较强的成分,并以此为基础,建立鸡骨草质量控制的HPLC特征图谱,最终选择相思子碱、刺桐碱、夏佛塔苷等作为鸡骨草特征图谱的质量标志物。
Prediction of characteristic chromatogram for Abri Herba based on network pharmacology and molecular docking
-
摘要:
目的 基于网络药理学与分子对接预测鸡骨草潜在质量标志物,并以此建立质量控制特征图谱。 方法 运用多种数据库通过网络药理学的方法构建“鸡骨草-成分-靶点-通路”网络关系结合分子对接,预测鸡骨草潜在的质量标志物,在此基础上采用高效液相色谱法建立鸡骨草特征图谱。 结果 通过网络药理学预测发现,鸡骨草中相思子碱、刺桐碱、夏佛塔苷等成分与AKT1、STAT3、HIF1A、GRB2、MMP9等主要靶点蛋白关联密切,可作用HIF-1、PI3K-Akt、JAK-STAT 等信号通路,是鸡骨草潜在的质量标志物,以此为依据通过HPLC检测,根据保留时间建立鸡骨草特征图谱。 结论 通过网络药理学与分子对接预测结合HPLC检测,建立以相思子碱、刺桐碱及夏佛塔苷等成分为质量标志物的鸡骨草特征图谱,能够结合成分与药理活性控制鸡骨草的质量。 Abstract:Objective To predict the potential Q-markers of Abri Herba based on network pharmacology and molecular docking and establish a quality control characteristic. Methods The network relationship of “Abri Herba - component - target - pathway” was constructed by using a variety of databases and the method of network pharmacology. The potential Q-markers of Abri Herba were predicted and then the characteristic Chromatogram of Abri Herba was established by high performance liquid chromatography Results Through the network pharmacological prediction, it was found that the components of abrine hypaphorine, schaftoside in Abri Herba were closely associated with the main targets, such as AKT1, STAT3, HIF1A, GRB2, MMP9, which could act on HIF-1, PI3K-Akt, JAK-STAT and other signaling pathways and have good pharmacological activities to be potential Q-markers of Abri Herba. Then HPLC was used to establish the characteristic according to retention time. Conclusion Through network pharmacology and molecular dock-prediction combined with HPLC detection, the characteristic chromatogram was established with the components of abrine hypaphorine, schaftoside as Q-markers, which could control the quality of Abri Herba by combining the components and pharmacological activities. -
Key words:
- Abri Herba /
- network pharmacology /
- Q-markers /
- characteristic chromatogram
-
糖尿病患者长期的高血糖环境显著影响自主神经系统,导致消化系统功能紊乱,表现为腹胀、便秘或腹泻等一系列消化不良的现象[1]。结肠镜检查作为评估结直肠疾病的关键工具,特别是在早期结肠癌的检测中扮演着不可或缺的角色。然而,不充分的肠道准备工作会直接影响检查的有效性。临床实践中,3 000 ml复方聚乙二醇电解质散剂被广泛采纳作为肠道准备的标准方案[2]。但对于糖尿病患者群体,一方面,自主神经损害减弱了胃肠道的正常蠕动;另一方面,部分患者接受的胰高血糖素样肽-1受体激动剂(GLP-1Ra)治疗进一步延缓了胃排空速度。在这两重因素共同作用下,糖尿病患者面临肠道清洁不佳的难题,严重影响了结肠镜检查的质量和病变检出率[3, 4]。胆宁片能改善消化过程,减少肠道负担,进一步促进排便[5],可显著优化糖尿病患者在接受结肠镜检查前的肠道准备状态,进而提升检查的准确性和舒适度。既往曾有研究报道胆宁片可改善2型糖尿病患者的便秘,但未见探讨其在肠道准备中的作用[6]。本研究旨在探索将胆宁片与复方聚乙二醇电解质散的预处理方案应用于糖尿病患者的结肠镜检查,评估胆宁片对提高肠道准备合格率的应用效果,现报告如下。
1. 资料与方法
1.1 一般资料
选取2022年11月至2024 年5月在海军军医大学第一附属医院内分泌科住院并行结肠镜检查的100例2型糖尿病患者为研究对象。根据是否使用GLP-1Ra类降糖药物(使用GLP-1Ra类药物共22名患者)进行分层随机,分为两组,每组各50例。所有研究对象均签署了知情同意书,本研究已通过我院伦理委员会批准。
纳入标准:①患者必须满足世界卫生组织(WHO)确立的2型糖尿病确诊标准;②研究对象的年龄≥30岁;③日常生活能力评估,即Barthel指数得分,须高于60分。④文化程度高中及以上。
排除标准:①糖尿病病情波动不定,且伴有如心脑血管突发事件等严重并发疾病的患者;②正处于糖尿病急性并发症发作期的患者;③患有急性胆囊炎、急性化脓性胆囊炎或任何急腹症状况、炎症性肠病、消化道梗阻、腹腔手术史、肝硬化、严重肾功能不全、帕金森病、心力衰竭的患者;④存在精神心理性疾病病史或近1周服三环类药物的患者;⑤过度肥胖(BMI>30)的患者[7-9]。
1.2 方法
1.2.1 对照组
①患者教育与心理准备:在肠道准备阶段之初,对参与者进行详尽的教育宣讲,着重说明肠道准备的必要性及其实施步骤,旨在减轻或消除患者面对结肠镜检查时可能产生的焦虑感,营造积极合作的氛围[10]。②膳食管理:要求受试者在结肠镜检查前1 d采用低残渣、半流质饮食模式,晚餐只可吃易消化的半流质食品,避免摄入富含纤维的食物。于检查当日清晨开始禁食,以减少肠道内容物,便于后续检查顺利进行[11]。③药物准备:在进行结肠镜检查前10 h,受试者应分次服用完68.56 g复方聚乙二醇电解质散(组成包括聚乙二醇4 000、无水硫酸钠、氯化钠、氯化钾和碳酸氢钠),药物需溶解在1 000 ml温水中。检查前6 h,受试者再次分次服用完137.12 g复方聚乙二醇电解质散,药物溶解在2 000 ml温水中,以确保肠道得到充分的清洁准备[12]。
1.2.2 实验组
在对照组的基础上从检查前2 d开始,口服胆宁片每日3次,每次5片,共服2 d,其余常规准备方案同对照组。
1.3 观察指标
肠道准备质量评估:采用波士顿量表(Boston Bowel Preparation Scale,BBPS),由肠镜室医生评估各组肠道准备质量。该量表将全结肠分为3个主要的结肠区域,分别为右半结肠(盲肠和升结肠)、横结肠(肝曲到脾曲的部分)、左半结肠(降结肠、乙状结肠和直肠)。每个区域的清洁度分数如下:0分:由于无法清除的固体或液体粪便导致整段肠黏膜无法观察;1分:由于污斑、混浊液体、残留粪便导致部分肠黏膜无法观察;2分:肠道黏膜观察良好,但残留少量污斑、混浊液体、粪便;3分:肠道黏膜观察良好,基本无残留污斑、混浊液体、粪便。每个区域的评分范围是从0~3分,总评分范围是0~9分,最终得分<6分为差,6~7分为良,8~9分为优。总评分越高表明肠道准备质量越好,有助于提高结肠镜检查的准确性和效率[13, 14]。
1.4 统计学方法
采用 SPSS 26.0 软件对数据进行统计分析,符合正态分布的计量资料以(均数±标准差)表示,组间比较用t检验;不符合正态分布的计量资料以中位数和四分位数区间表示,组间比较用非参数检验。计数资料(n, %)用卡方检验比较,以P<0.05 为差异有统计学意义。
2. 结果
2.1 一般资料
本研究共收集100名2型糖尿病患者,随机分为对照组和实验组,每组各50名,对照组和实验组各有11例患者使用GLP-1Ra类降糖药物。其中,对照组平均年龄(56.38±9.44)岁,男性占比72.0%(36/50),平均糖尿病病程(11.26±6.59)年,BMI为(24.21±1.76)kg/m2,糖化血红蛋白为(7.93±1.21)%;实验组平均年龄(57.42±9.99)岁,男性占比68.0%(34/50),平均病程(9.52±7.23)年,BMI为(24.31±2.47)kg/m2,糖化血红蛋白为(7.89±1.21)%。两组间基础资料对比,差异均无统计学意义(P>0.05)。
2.2 BBPS评价两组患者肠道准备质量
根据BBPS评分,评分为“优”的,实验组占66%,显著高于对照组的28%。评分为“良”的,两组都占30%。评分为“差”的,实验组仅4%,远低于对照组的42%。实验组平均分为(7.44±1.03),对照组为(5.58±1.98)。实验组在肠道准备方面表现明显优于对照组,且差异具有统计学意义(P<0.001),见表1。
表 1 BBPS评价肠道准备情况组别 评分 t值 P值 优 良 差 卡方值 P值 对照组 5.58±1.98 −0.589 <0.001 14
(28%)15
(30%)21
(42%)23.377 <0.001 实验组 7.44±1.03 33
(66%)15
(30%)2
(4%)2.3 BBPS评价两组使用GLP-1Ra药物的患者肠道准备质量
对照组和实验组各有11例患者使用GLP-1Ra类降糖药物,对使用GLP-1Ra的糖尿病患者单独进行比较:实验组的BBPS平均得分为(6.64±0.81),高于对照组的平均得分(3.64±0.92);实验组BBPS评分有1人被评为优,10人被评为良,而对照组全部为差。因两组样本量过小,无法进行统计学分析,但以上结果仍提示在使用了GLP-1Ra的情况下,实验组的肠道准备质量优于对照组。
3. 讨论
在进行结肠镜检查前的肠道准备中,糖尿病患者遇到的挑战尤为显著,这与他们复杂的生理病理特征密切相关。血糖水平对胃部活动和排空有直接调控作用。高血糖状态下,胃排空速度受到抑制,造成胃肠道的感觉与运动功能紊乱。病程较长的糖尿病患者可能存在神经病变,尤其是在消化系统方面导致一系列消化不良的症状,如腹胀、便秘或腹泻,影响胃肠道平滑肌的健康与功能,从而影响肠道准备的充分性[15]。
结肠镜检查对于评估结直肠疾病至关重要,尤其在早期结肠癌筛查中发挥关键作用。然而,若肠道准备不充分,可能会延长检查时间并增加并发症风险,直接影响检查的准确性和安全性[16]。尽管3 000 ml复方聚乙二醇电解质散剂是肠道准备的常用标准方案,但糖尿病患者因自主神经受损和使用GLP-1Ra药物治疗的影响,胃肠道蠕动减慢,胃排空延迟,使得肠道清洁难度增加,将直接影响结肠镜检查的效果[17]。
本研究结果显示,胆宁片能够显著改善糖尿病患者的肠道准备效果,尤其是在使用GLP-1Ra的患者中,作用更为明显。胆宁片是一种中药制剂,含有大黄、虎杖、青皮、陈皮、郁金和山楂等成分。山楂促进消化液分泌,增强胃肠蠕动,帮助消化油腻食物,同时还有一定的降脂作用;大黄具有较强的泻下作用,可以清除体内积热,改善便秘症状,并且有解毒、清热的效果;陈皮燥湿化痰,对脾胃功能不佳、消化不良有一定的辅助治疗效果;虎杖具有解毒、活血化瘀的功效,对于体内瘀血、炎症有一定的缓解作用;青皮疏肝理气,适用于肝气郁结引起的消化不良等症状。几种成分共同作用能有效清热、促进肠道运动、疏肝解郁、促进消化酶分泌、加速食物消化、减少肠道负担,同时增强胆汁分泌,帮助脂肪乳化,软化大便,利于排便[18]。
本研究同样面临一些局限性:第一,样本规模较为局限;第二,在探究糖尿病患者治疗方案时,未能细致分类伴随病症及所用降糖药物,此疏忽可能模糊了药物效能与不良反应情况;第三,缺乏对患者依从性的详细记录。未来仍需增加样本量、完善干预措施、评估相关药物以进一步验证和完善方案。
-
表 1 成分-靶标分子对接结果
靶标 PDB ID 活性成分 结合能(kcal/mol) AKT1 4GAH 相思子碱 −4.67 刺桐碱 −4.34 夏佛塔苷 −2.98 STAT3 5AX3 相思子碱 −4.72 刺桐碱 −4.56 夏佛塔苷 −2.82 HIF1A 3OUI 相思子碱 −4.02 刺桐碱 −3.93 夏佛塔苷 −2.36 大豆皂苷Bb −0.27 GRB2 3IMD 相思子碱 −5.0 刺桐碱 −5.66 夏佛塔苷 −4.68 大豆皂苷Bb −2.46 MMP2 8H78 相思子碱 −7.21 刺桐碱 −7.02 夏佛塔苷 −5.83 大豆皂苷Bb −4.28 表 2 对照品色谱峰相对保留时间
峰 名称 保留时间
(t/min)相对保留
时间精密度
RSD(%)峰1 相思子碱 18.058 1.00 0.6 峰2 刺桐碱 21.658 1.20 0.7 峰3 夏佛塔苷 42.865 2.37 0.4 峰4 异夏佛塔苷 47.433 2.63 0.3 表 3 稳定性实验色谱峰保留时间(t/min)
时间(t/h) 相思子碱 刺桐碱 夏佛塔苷 异夏佛塔苷 0 16.892 20.783 42.283 46.967 2 16.892 20.783 42.283 46.967 4 16.900 20.808 42.308 47.000 8 16.867 20.758 42.258 46.950 12 16.858 20.742 42.242 46.942 24 16.875 20.775 42.300 47.000 RSD(%) 0.09 0.10 0.05 0.05 表 4 样品特征峰相对保留时间(n=13)
样品 相思子碱峰 刺桐碱峰 夏佛塔苷峰 异夏佛塔苷峰 保留时间
(t/min)相对保
留时间保留时间
(t/min)相对保
留时间保留时间
(t/min)相对保
留时间保留时间
(t/min)相对保
留时间对照品 18.058 1.00 21.658 1.20 42.865 2.37 47.433 2.63 JGC-01-001 17.717 1.00 21.175 1.20 42.400 2.39 46.767 2.64 JGC-01-002 17.733 1.00 21.183 1.19 42.200 2.38 46.917 2.65 JGC-01-003 18.025 1.00 21.658 1.20 42.900 2.38 − − JGC-01-004 18.033 1.00 21.683 1.20 43.950 2.44 47.483 2.63 JGC-01-006 18.183 1.00 21.408 1.18 42.700 2.35 47.542 2.61 JGC-01-007 17.967 1.00 21.675 1.21 42.933 2.39 − − JGC-01-010 16.881 1.00 20.775 1.22 42.279 2.49 47.000 2.78 JGC-03-004 17.650 1.00 21.225 1.20 42.475 2.41 − − JGC-03-012 17.833 1.00 21.350 1.20 42.325 2.37 48.392 2.71 JGC-04-003 17.000 1.00 21.575 1.27 42.175 2.48 47.083 2.77 JGC-04-004 17.475 1.00 21.500 1.23 42.417 2.43 45.683 2.61 JGC-04-006 17.975 1.00 22.650 1.26 42.417 2.36 − − JGC-04-007 17.892 1.00 21.400 1.20 42.708 2.39 47.067 2.63 平均值 17.720 1.00 21.481 1.21 42.606 2.40 47.104 2.67 RSD(%) 2.1 0.0 1.9 2.1 1.1 1.7 1.4 2.3 注:“-”为样品中未检测到相关色谱峰。 表 5 不同色谱条件对相对保留时间的影响(n=3)
色谱条件 相对保留时间 峰1 峰2 峰3 峰4 色谱柱 Thermo 1.00 1.20 2.37 2.63 Agilent 1.00 1.22 2.54 2.93 Diamonsil 1.00 1.24 2.51 2.82 平均値 1.00 1.22 2.47 2.79 RSD(%) 0.00 1.30 3.00 4.40 柱温(℃) 25 1.00 1.20 2.34 2.60 30 1.00 1.20 2.37 2.63 35 1.00 1.19 2.34 2.64 平均値 1.00 1.20 2.35 2.62 RSD(%) 0.00 1.40 1.10 0.70 流速(ml/min) 0.8 1.00 1.20 2.37 2.63 1.0 1.00 1.20 2.53 2.85 1.2 1.00 1.19 2.66 3.08 平均値 1.00 1.20 2.52 2.85 RSD(%) 0.00 0.40 4.70 6.40 -
[1] 国家药典委员会. 中华人民共和国药典(一部)2020年版 [S]. 北京: 中国医药科技出版社, 2020. [2] 香港特别行政区卫生署. 香港中药材标准(第六册)[S]. 香港: 中华人民共和国香港特别行政区卫生署, 2014: 11-23. [3] 安徽省食品药品监督管理局. 安徽省中药饮片炮制规范(2019年版)[S]. 合肥: 安徽科学技术出版社, 2019: 162-163. [4] YAO X C, LI Z Q, GONG X M, et al. Total saponins extracted from Abrus cantoniensis Hance suppress hepatitis B virus replication in vitro and in rAAV8-1.3HBV transfected mice[J]. J Ethnopharmacol, 2020, 249(0):112366. doi: 10.1016/j.jep.2019.112366 [5] LIU R N, YAN W Y, HAN Q J, et al. Simultaneous detection of four flavonoids and two alkaloids in rat plasma by LC-MS/MS and its application to a comparative study of the pharmacokinetics between Abri Herba and Abri mollis Herba extract after oral administration[J]. J Sep Sci, 2019, 42(7):1341-1350. doi: 10.1002/jssc.201801122 [6] 秦建鲜, 黄锁义. 鸡骨草分级多糖的体外抗氧化活性[J]. 中国临床药理学杂志, 2017, 33(23):2411-2415. [7] 徐柯心, 贾子尧, 王宝丽, 等. 鸡骨草化学成分研究进展[J]. 辽宁中医药大学学报, 2017, 19(7):125-129. [8] 肖晓, 许重远, 杨德俊, 等. 鸡骨草与毛鸡骨草挥发油及脂肪酸成分的比较分析[J]. 药学实践杂志, 2017, 35(1):39-42. [9] ZENG Q, XIE H, SONG H J, et al. In vivo wound healing activity of Abrus cantoniensis extract[J]. Evid Based Complementary Altern Med, 2016, 2016:1-7. [10] NIE X, LIU H F, XU X Y, et al. Antibacterial activity of the ethyl acetate part of Abrus cantoniensis against Staphylococcus aureus[J]. J Bio X Res, 2021, 4(2):47-52. [11] 刘相文, 侯林, 崔清华, 等. 鸡骨草不同洗脱部位体外抗病毒实验研究[J]. 中华中医药学刊, 2017, 35(9):2277-2279. [12] YANG M, SHEN Q, LI L Q, et al. Phytochemical profiles, antioxidant activities of functional herb Abrus cantoniensis and Abrus mollis[J]. Food Chem, 2015, 177:304-312. doi: 10.1016/j.foodchem.2015.01.054 [13] WU S W, FU X, YOU L J, et al. Antioxidant, antitumor and immunomodulatory activities of water-soluble polysaccharides in Abrus cantoniensis[J]. Int J Biol Macromol, 2016, 89:707-716. doi: 10.1016/j.ijbiomac.2016.04.005 [14] 姚香草, 肖晓, 黄宝康, 等. 鸡骨草抗病毒性乙型病毒性肝炎活性的分子对接及体外活性研究[J]. 中国临床药理学杂志, 2019, 35(5):439-441,448. [15] 黄凯文, 吴菲, 李常青, 等. 鸡骨草对非酒精性脂肪肝大鼠肝组织SREBP-1c表达的影响[J]. 中药材, 2015, 38(11):2368-2371. [16] 姚香草, 薛兢兢, 肖晓, 等. 鸡骨草总皂苷对化学性及免疫性肝损伤的保护作用[J]. 中国临床药理学杂志, 2019, 35(18):2071-2074. [17] ZHANG R Z, ZHU X E, BAI H, et al. Network pharmacology databases for traditional Chinese medicine: review and assessment[J]. Front Pharmacol, 2019, 10:123. doi: 10.3389/fphar.2019.00123 [18] 李太平, 吴芳芳, 孙晖, 等. 基于网络药理学和分子对接探究壮药鸡骨草治疗乙型肝炎的作用机制[J]. 现代药物与临床, 2022, 37(1):33-41. [19] 刘昌孝, 陈士林, 肖小河, 等. 中药质量标志物(Q-Marker): 中药产品质量控制的新概念[J]. 中草药, 2016, 47(9):1443-1457. [20] LI D T, LV B, WANG D, et al. Network pharmacology and bioactive equivalence assessment integrated strategy driven Q-markers discovery for da-Cheng-qi decoction to attenuate intestinal obstruction[J]. Phytomedicine, 2020, 72(0):153236. doi: 10.1016/j.phymed.2020.153236 [21] ZHOU Z C, CHEN B, CHEN S M, et al. Applications of network pharmacology in traditional Chinese medicine research[J]. Evid Based Complementary Altern Med, 2020, 2020:1-7. [22] 林源, 朱雪艳, 黄豆豆, 等. 基于UPLC-MS法及网络药理学预测紫红参质量标志物[J]. 中成药, 2023, 45(2):613-619. [23] MENG Y, YIN D Z, QIU S Q, et al. Abrine promotes cell proliferation and inhibits apoptosis of interleukin-1β-stimulated chondrocytes via PIM2/VEGF signalling in osteoarthritis[J]. Phytomedicine, 2022, 96(Suppl C):153906. doi: 10.1016/j.phymed.2021.153906 [24] SUN H J, ZHU X X, CAI W W, et al. Hypaphorine attenuates lipopolysaccharide-induced endothelial inflammation via regulation of TLR4 and PPAR-γ dependent on PI3K/akt/mTOR signal pathway[J]. Int J Mol Sci, 2017, 18(4):844. doi: 10.3390/ijms18040844 [25] HU X L, NIU Y J, CHEN M, et al. Preventive effects of total flavonoid C-glycosides from Abrus mollis on nonalcoholic fatty liver disease through activating the PPARα signaling pathway[J]. Planta Med, 2019, 85(8):678-688. doi: 10.1055/a-0895-5838 [26] GUAN S Y, SUN L B, WANG X H, et al. Isoschaftoside inhibits lipopolysaccharide-induced inflammation in microglia through regulation of HIF-1α-mediated metabolic reprogramming[J]. Evid Based Complementary Altern Med, 2022, 2022:1-8. [27] 刁璇, 吴熙, 丘艺涵, 等. 鸡骨草中不同药用部位相思子碱和夏佛塔苷含量测定[J]. 中国药业, 2020, 29(17):77-80. -





 下载:
下载:
 下载:
下载: