-
成纤维细胞的增殖和活化引起的细胞外基质(extracellular matrix,ECM)的累积是肺纤维化的主要病理基础[1]。肺纤维化治疗难度大,且发展到晚期纤维化过程不可逆转,而一些药物的长期使用会提高肺纤维化的发生风险,对于这临床的一类并发症应格外重视。来氟米特(leflunomide,LEF)是治疗类风湿性关节炎的常用药物,但是有临床报道称,长期服用LEF可能提高肺纤维化的发生风险,但是也有研究认为LEF对肺纤维化影响不大[2]。微小RNA(microRNA,miRNA)长度约为18~22个核苷酸,虽然不具备编码功能,但是可通过识别和碱基配对的方式与靶基因信使RNA(message RNA,mRNA)的3'非翻译区(3'UTR)结合,从而参与基因表达的调控[3]。miR-449a具有抑制肿瘤细胞的增殖并诱导凋亡的作用[4],并且最新研究发现miR-449a可能与肺纤维化有关,在二氧化硅诱导的肺纤维化模型中,miR-449a可通过调节自噬缓解纤维化[5]。c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)是调节细胞增殖、凋亡和分化的重要蛋白,其磷酸化后可通过信号转导调控细胞生物学行为[6]。本文发现了miR-449a的过表达会显著缓解由LEF引起的肺成纤维细胞的增殖,而沉默miR-449a对细胞的影响相反,这可能是LEF引起肺纤维化的机制之一,报道如下。
-
人肺成纤维细胞MRC-5购自美国ATCC;LEF(苏州长征-欣凯制药有限公司,国药准字H20000550);RPMI-1640培养基以及血清购自美国Gibco公司;miR-449a mimic和inhibitor质粒由Genepharma公司构建;
LipofectamineTM 2000(美国Invitrogen公司);荧光显微镜(Olympus BX51);Model 680酶标仪(Bio-Rad,美国);流式细胞仪(BD FACScanto II,Becton Dickinson,美国)。CCK-8试剂盒(武汉华美公司);凋亡试剂盒(美国Thermo Fisher);PVDF膜(美国Bio-Rad公司);抗体购自美国Abcam公司,逆转录试剂盒TaKaRa和SYBR Prellix Ex TaqTM实时PCR试剂盒购自TaKaRa(日本)。
-
MRC-5细胞在RPMI-1640培养基中培养,温度为37 ℃,CO2浓度为5%。细胞被分为6组,即对照组、LEF组、LEF+mimic组、mimic组、LEF+inhibitor组和inhibitor组。其中LEF+mimic组和mimic组通过转染miR-449a mimic质粒过表达miR-449a的水平,LEF+inhibitor组和inhibitor组通过转染miR-449a inhibitor质粒使miR-449a的水平降低。对照组转染空载质粒。LEF组、LEF+mimic组和LEF+inhibitor组分别在5 mg/L LEF的条件下培养48 h。
-
将细胞裂解后收集总RNA并检测纯度,通过逆转录试剂盒合成cDNA,然后进行PCR反应,步骤如下:95 ℃下2 min,95 ℃下15 s,60 ℃下25 s和72 ℃下60 s,共进行40个循环。以U6作为内参,使用2-ΔΔCT法分析miR-449a水平。引物序列如下(5′-3′),miR-449a上游引物:TGCGGTGGCAGTGTATTGTTAGC,下游引物:CCAGTGCAGGGTCCGAGGT;U6上游引物:GGGCAGGAAGAGGGCCTAT,下游引物:TATGGCTAGCATGACTGGT。
-
将细胞调节至2×104个细胞/ml的密度,接种于96孔板中,100 μl/孔。再培养24、48和72 h后将10 μl的CCK-8试剂加入至每孔中,37 ℃下培养2 h。在酶标仪上测量450 nm处的吸光度(A),计算相对细胞活力。
-
分别将各组细胞200个细胞在6孔板中培养,每3天补充一次培养基,培养2周。用PBS洗涤细胞并加入甲醇固定15 min,加入使用结晶紫染色30 min,在显微镜下观察克隆形成的数目,≥50个细胞的集落为一个克隆形成。
-
将细胞洗涤后重悬于结合缓冲液中,使细胞浓度为2.5×105个/ml。根据试剂盒说明书将试剂加入细胞中,并通过流式细胞术分析细胞凋亡情况。
-
通过免疫荧光染色检测α平滑肌肌动蛋白(α smooth muscle actin,α-SMA)和胶质蛋白I(collagen I,Col I)的表达情况分析细胞的表型和细胞外基质。然后将细胞在4 ℃下使用α-SMA的抗体染色过夜,用异硫氰酸四甲基罗丹明的山羊抗兔抗体染色30 min。然后再于避光条件下利用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)对细胞核染色10 min,通过荧光显微镜观察。
-
通过Western blot检测JNK和磷酸化JNK(p-JNK)蛋白的水平。将细胞裂解、离心收集总蛋白并检测蛋白浓度。使用10%的SDS-PAGE凝胶用于电泳分离蛋白,电泳后使用PVDF膜转膜并在室温下用5%无脂牛奶封闭2 h。分别加入一抗(稀释1:1 000)室温震荡2 h,后在4 ℃孵育过夜,加入二抗(稀释1:5 000),孵育3 h。通过Quantity One软件分析条带的灰度值并以GAPDH为参照计算目标蛋白质的表达量。
-
实验数据采用SPSS 19软件进行处理,实验结果以平均值±标准偏差(SD)表示,组间比较采用单因素方差分析和t检验,统计学显著性表示为P<0.05。
-
使用qPCR检测各组细胞中miR-449a表达水平。结果显示mimic组miR-449a水平显著高于对照组,inhibitor组的miR-449a表达水平显著低于对照组(P<0.05),说明转染实验成功。LEF组的miR-449a水平显著低于对照组(P<0.05),并且LEF+mimic组的miR-449a的表达水平显著高于LEF组,LEF+inhibitor组的miR-449a显著低于LEF组(P<0.05)。表明LEF可抑制人成纤维细胞中miR-449a的表达,见表1。
表 1 各组miR-449a表达水平比较
组别 miR-449a 对照组 1.16±0.08 LEF组 0.58±0.05* LEF+mimic组 2.04±0.16# mimic组 6.32±0.63* LEF+inhibitor组 0.41±0.06# inhibitor组 0.77±0.07* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
使用CCK-8法检测各组细胞的相对细胞活力。结果显示在第48小时和第72小时,LEF组和inhibitor组的细胞活力显著高于对照组(P<0.05),而mimic组的细胞活力显著低于对照组(P<0.05)。此外,LEF+mimic组的细胞活力显著低于LEF组,LEF+inhibitor组的细胞活力显著高于LEF组(P<0.05),过表达miR-449a可部分逆转LEF对促进人成纤维细胞的细胞活力的作用,而降低miR-449a的水平会进一步促进细胞活力,见表2。
表 2 各组细胞的相对细胞活力比较(%)
组别 24 h 48 h 72 h 对照组 100.07±1.83 100.76±2.07 100.16±1.96 LEF组 103.67±2.06 110.83±2.15* 121.17±2.65* LEF+mimic组 99.98±2.14 98.57±2.11# 97.37±2.01# mimic组 97.54±1.97 91.79±2.35* 81.77±1.78* LEF+inhibitor组 107.68±2.08 118.67±3.07# 132.84±2.07# inhibitor组 104.31±1.79 111.38±2.67* 119.35±2.18* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
LEF组和inhibitor组的克隆形成数目显著高于对照组而细胞凋亡率低于对照组(P<0.05),mimic组的克隆形成数目显著低于对照组而细胞凋亡率显著高于对照组(P<0.05)。此外,LEF+mimic组的克隆形成数目显著低于LEF组而细胞凋亡率显著高于LEF组(P<0.05),LEF+inhibitor组的克隆形成数目在LEF的基础上进一步升高而细胞凋亡率进一步降低(P<0.05)。过表达miR-449a可逆转LEF促进肺成纤维细胞增殖和抑制凋亡的作用,而低表达miR-449a会加剧LEF的作用,见表3。
表 3 各组细胞增殖和凋亡情况比较
组别 克隆形成数目(个) 细胞凋亡率(%) 对照组 54.32±4.36 5.53±0.94 LEF组 87.66±7.24* 3.11±0.76* LEF+mimic组 60.82±6.06# 6.73±1.26# mimic组 31.12±3.78* 17.32±3.28* LEF+inhibitor组 119.35±5.08# 2.14±0.62# inhibitor组 92.71±7.89* 3.45±0.83* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
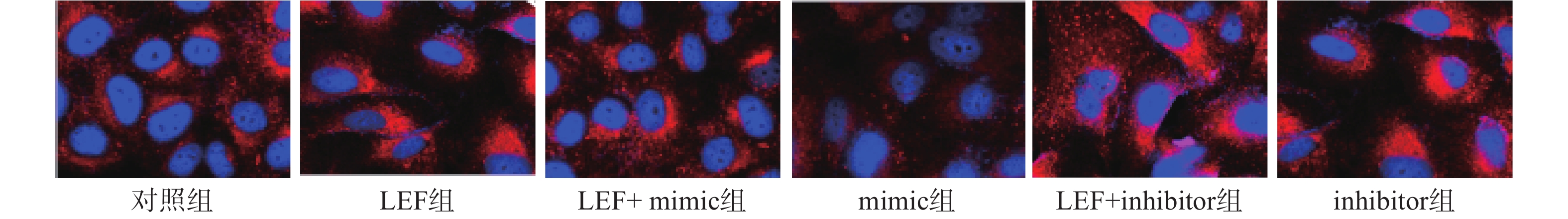
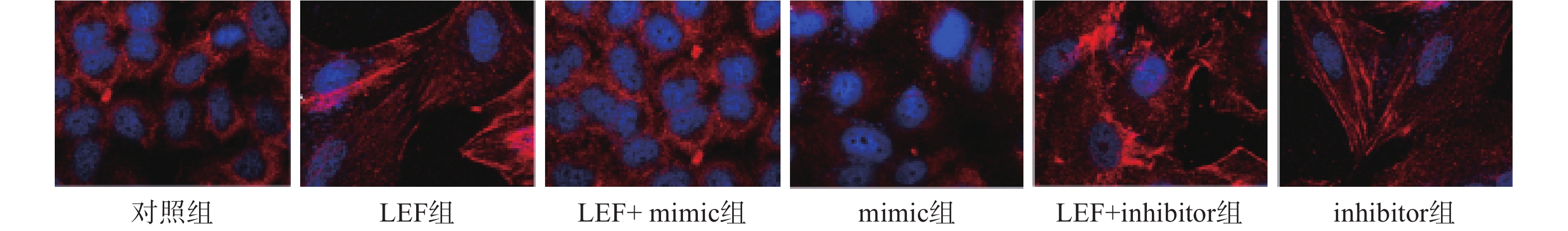
本次研究通过免疫荧光技术检测了各组α-SMA的水平来分析细胞向肌细胞转化情况,检测Col I的水平来分析ECM水平。其中蓝色荧光为细胞核,红色荧光为α-SMA或Col I蛋白。LEF组和inhibitor组的荧光强度显著高于对照组(P<0.05),而mimic组的相对荧光强度低于对照组(P<0.05)。此外,LEF+mimic组的相对荧光强度显著低于LEF组(P<0.05),LEF+inhibitor组的相对荧光强度显著高于LEF组(P<0.05)。过表达miR-449a可部分逆转LEF对促进人成纤维细胞α-SMA和Col I表达的促进作用,见图1、图2和表4。
表 4 各组细胞α-SMA相对荧光强度比较
组别 α-SMA Col I 对照组 1.02±0.11 1.24±0.14 LEF组 2.36±0.47* 2.57±0.38* LEF+mimic组 1.53±0.34# 1.89±0.25# mimic组 0.47±0.05* 0.45±0.06* LEF+inhibitor组 3.25±0.18# 4.13±0.54# inhibitor组 2.48±0.15* 3.11±0.39* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
LEF组和inhibitor组的p-JNK/JNK水平高于对照组,mimic组的p-JNK/JNK水平显著低于对照组(P<0.05),并且LEF+mimic组中p-JNK/JNK水平显著低于LEF组(P<0.05),LEF+inhibitor组中p-JNK/JNK水平显著高于LEF组(P<0.05)。过表达miR-449a可逆转LEF促进JNK蛋白磷酸化的作用,见表5。
表 5 各组p-JNK/JNK相对水平比较
组别 p-JNK JNK p-JNK/JNK 对照组 2.04±0.18 2.16±0.16 0.94±0.09 LEF组 2.87±0.31 1.05±0.10 2.73±0.18* LEF+mimic组 1.67±0.19 2.24±0.21 0.75±0.07# mimic组 0.96±0.11 3.11±0.28 0.31±0.04* LEF+inhibitor组 3.04±0.24 1.10±0.10 2.76±0.25# inhibitor组 3.78±0.34 1.02±0.09 3.71±0.31* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
肺纤维化是一种慢性进行性肺部疾病,但是临床上尚无治疗肺纤维化的特效方法和药物,目前用于进行性肺纤维化的唯一有效治疗方法是肺移植[7],若患者未接受肺移植,通常在诊断后的3至5年内出现肺功能丧失导致呼吸衰竭和死亡。肺纤维化的病理特征包括纤维增生和ECM沉积过多,但是这个过程较为漫长,并且在早期症状不明显,也缺乏相应的诊断手段,在患者确诊为肺纤维化时再采取治疗效果有限。因此虽然LEF是否会引起肺纤维化尚无定论,但是由于肺纤维化的恶性预后和致死率,LEF治疗过程中的肺纤维化风险仍是临床重点关注的问题。研究LEF促进肺纤维化的机制是寻找诊断和治疗肺纤维化新方法的重要途径。
LEF是一种调节免疫的药物,其作用机制通过抑制二氢乳清酸脱氢酶来抑制T淋巴细胞和其他类型细胞的细胞周期进程[8]。LEF引起的肺纤维化并导致患者死亡的病例随着LEF使用时间的增加而升高[9]。一项长期的调查随访报告指出,在5911例使用LEF治疗的患者中,共出现了80例间质性肺病,其中有27例患者死亡,并且结果判定其中有18例患者的死亡是由于LEF直接导致[10-11]。在肺纤维化的过程中,成纤维细胞向成肌纤维细胞转化和ECM的累积是两大特点[12]。因此本文主要分析了LEF对人肺成纤维细胞的影响,结果显示LEF可显著促进成纤维细胞的细胞活力和增殖,抑制其凋亡,并诱导细胞表达大量的α-SMA蛋白和ECM累积。α-SMA是上皮细胞向间质细胞转化的检测指标之一,也是体外研究肺纤维化的最常用指标,而Col I是ECM的主要成分[13]。作者提示了LEF可通过活化成纤维细胞和促进其增殖参与肺纤维化。
为进一步分析LEF调节肺成纤维细胞增殖和表达α-SMA的机制,我们检测了miR-449a在其中的作用。miR-449a是近年来新发现的一种miRNA,研究已经证实了其可通过靶向并诱导靶基因mRNA降解,抑制肺癌细胞的增殖、上皮间充质转化[14-15]。本次研究结果显示LEF可抑制miR-449a的表达水平,并且过表达miR-449a可抑制成纤维细胞的细胞活力、细胞增殖能力,抑制α-SMA和Col I蛋白的表达,并促进其凋亡。过表达miR-449a会逆转由LEF引起的细胞活化、增殖以及α-SMA和Col I蛋白的表达,而抑制miR-449a的水平会进一步加剧LEF的促纤维化作用。Zhang等[16]的研究结果也显示miR-449a具有调节α-SMA蛋白表达的作用。通过进一步的研究我们还发现LEF可促进JNK的磷酸化,过表达miR-449a会抑制JNK磷酸化水平并显著逆转LEF促进JNK磷酸化的作用。JNK的活化在促进肺癌发生和发展中的作用已经被广泛证实,此外,JNK可活化可能通过活化肝星状细胞引起肝纤维化[17]。Yang等[18]的研究结果显示阻断JNK途径可抑制成纤维细胞样滑膜细胞的活性,并抑制迁移和侵袭。Shingyochi等[19]的研究结果也显示了激活JNK通路会促进成纤维细胞的增殖和迁移。这提示LEF可能通过miR-499a促进JNK蛋白的磷酸化,从而促进肺成纤维细胞的活化和增殖,并促进细胞向肌纤维细胞转化和ECM的累积,进而引起肺纤维化。
综上所述,LEF可能通过抑制肺成纤维细胞中miR-449a的表达激活JNK途径,促进α-SMA的表达和ECM的累积,从而诱导成纤维细胞的活化和增殖,抑制其凋亡,从而引起肺纤维化。但是,关于LEF调节miR-449a的机制和miR-449a在JNK途径中的作用仍需要进一步的研究。
Mechanism of leflunomide in regulating pulmonary fibrosis by regulating miR-449a
-
摘要:
目的 探究来氟米特(leflunomide,LEF)通过调节微小RNA(microRNA,miR)-449a在肺纤维化中的机制研究。 方法 将人肺成纤维细胞MRC-5分为6组,即对照组、LEF组、LEF+mimic组、mimic组、LEF+inhibitor组和inhibitor组。通过质粒转染miR-449a mimic或inhibitor来过表达或沉默miR-449a,在5 mg/L LEF的条件下培养48 h。分别通过CCK-8法、克隆形成实验和流式细胞术检测各组细胞活力、细胞增殖能力和凋亡率。使用免疫荧光染色检测α平滑肌肌动蛋白(α smooth muscle actin,α-SMA)胶质蛋白I(collagen I,col I)。分别使用qPCR和Western blot检测miRNA和蛋白的水平。 结果 mimic组miR-449a水平显著高于对照组(P<0.05)。LEF组和inhibitor组的miR-449a水平显著低于对照组(P<0.05)。LEF+mimic组的miR-449a的表达水平显著高于LEF组,LEF+inhibitor组的miR-449a水平显著低于LEF组(P<0.05)。LEF组和inhibitor组的细胞活力和细胞增殖能力显著高于对照组(P<0.05)。mimic组的细胞活力和细胞增殖能力显著低于对照组(P<0.05)。LEF+mimic组的细胞活力和细胞增殖能力显著低于LEF组而LEF+inhibitor组的细胞活力显著高于LEF组(P<0.05)。LEF组和inhibitor组的细胞凋亡率低于对照组(P<0.05),mimic组的细胞凋亡率显著高于对照组(P<0.05)。LEF+mimic组的细胞凋亡率显著高于LEF组而LEF+inhibitor组的凋亡率显著低于LEF组(P<0.05)。LEF组和inhibitor组的α-SMA和Col I蛋白的荧光强度显著高于对照组(P<0.05),mimic组的相对荧光强度低于对照组(P<0.05)。LEF+mimic组的α-SMA和Col I蛋白相对荧光强度显著低于LEF组,LEF+inhibitor组的α-SMA和Col I蛋白相对荧光强度显著高于LEF组(P<0.05)。LEF组和inhibitor组的p-JNK/JNK水平高于对照组(P<0.05),mimic组的p-JNK/JNK水平显著低于对照组(P<0.05),LEF+mimic组中p-JNK/JNK水平显著低于LEF组而LEF+inhibitor组的p-JNK/JNK水平显著高于LEF组(P<0.05)。 结论 LEF可能通过抑制肺成纤维细胞中miR-449a的表达激活JNK途径,从而诱导成纤维细胞的活化和增殖,抑制其凋亡,从而引起肺纤维化。 -
关键词:
- 来氟米特 /
- 肺纤维化 /
- 成纤维细胞 /
- α平滑肌肌动蛋白 /
- 微小RNA-449a /
- c-Jun氨基末端激酶
Abstract:Objective To investigate the mechanism of leflunomide (LEF) in regulating pulmonary fibrosis by regulating microRNA (miR)-449a. Methods Human lung fibroblasts MRC-5 were divided into 6 groups: control group, LEF group, LEF+mimic group, mimic group, LEF+inhibitor group and inhibitor group. MiR-449a was overexpressed or silenced by plasmid transfection with miR-449a mimic or inhibitor and ncubate for 48 h at 5 mg / L LEF. The cell viability, cell proliferation ability and apoptotic rate of each group were measured by CCK-8 method, clone formation experiment and flow cytometry. Immunofluorescent staining was used to detect α smooth muscle actin (α-SMA) and collagen I (col I). The levels of miRNA and protein were detected using qPCR and Western blot, respectively. Results The miR-449a level in the mimic group was significantly higher than that in the control group (P<0.05). The level of miR-449a in LEF group and inhibitor group was significantly lower than that in control group (P<0.05). The expression level of miR-449a in LEF+mimic group was significantly higher than that in LEF group, and the level of miR-449a in LEF+inhibitor group was significantly lower than that in LEF group (P<0.05). The cell viability and cell proliferation ability of the LEF group and inhibitor group were significantly higher than those of the control group (P<0.05). The cell viability and cell proliferation ability of the mimic group were significantly lower than those of the control group (P<0.05). The cell viability and cell proliferation ability of the LEF+mimic group were significantly lower than those of the LEF group, while the cell viability of the LEF+inhibitor group was significantly higher than that of the LEF group (P<0.05). The apoptosis rate of LEF group and inhibitor group was lower than that of control group (P<0.05). The apoptosis rate of mimic group was significantly higher than that of control group (P<0.05). The apoptosis rate of LEF+mimic group was significantly higher than that of LEF group, while the apoptosis rate of LEF+inhibitor group was significantly lower than that of LEF group (P<0.05). The fluorescence intensity of α-SMA and Col I proteins in LEF group and inhibitor group were significantly higher than those in control group (P<0.05). The relative fluorescence intensity of mimic group was lower than that of control group (P<0.05). The relative fluorescence intensities of α-SMA and Col I proteins in LEF+mimic group were significantly lower than those in LEF group, while the relative fluorescence intensities of α-SMA and Col I protein in LEF+inhibitor group were significantly higher than those in LEF group (P<0.05). The levels of p-JNK / JNK in LEF group and inhibitor group were higher than those in control group (P<0.05). The p-JNK / JNK level in the mimic group was significantly lower than that in the control group (P<0.05). The level of p-JNK / JNK in LEF+mimic group was significantly lower than that in LEF group, while the level of p-JNK / JNK in LEF+inhibitor group was significantly higher than that in LEF group (P<0.05). Conclusion LEF may activate the JNK pathway by inhibiting the expression of miR-449a in lung fibroblasts, thereby inducing fibroblast activation and proliferation, inhibiting apoptosis, and causing pulmonary fibrosis. -
Key words:
- leflunomide /
- pulmonary fibrosis /
- fibroblasts /
- alpha smooth muscle actin /
- microRNA-449a /
- c-Jun N-terminal kinase
-
嘧啶类化疗药物在肿瘤治疗中的地位越来越重要,其代表药物5-氟尿嘧啶及其口服前药卡培他滨更受到了广泛关注,体内二氢尿嘧啶脱氢酶(DPD)是此类药物代谢的限速酶之一[1],前瞻性评价DPD的总体活性有利于提高药物疗效及减少患者的毒副反应,对临床具有重要意义。内源性物质尿嘧啶(U)是体内DPD的天然底物,在此酶的催化下生成二氢尿嘧啶(UH2),并最终通过尿液排出体外。测定血浆中U和UH2的含量,并通过(UH2)/(U)比值计算,可从代谢物的角度评价DPD的活性[2]。临床上常用评价DPD酶活性的方法是测定患者的基因表型,DPD的编码基因DPYD序列中包含了多达7 600个多态位点,使得DPD酶的活性在人群中是高度可变的[3]。不同的突变位点及不同位点的组合给临床检测带来了极大的困难。到目前为止,也只有DPYD*2A的多态性被用于临床实践,用来筛选出5-氟尿嘧啶代谢严重不良的患者,避免严重的毒副反应[4]。单一应用基因的多态性来评价DPD酶的活性在临床上存在一定的困难,基因的多态性并不能直接同下游的酶的活性联系起来,两者并没有完全对等的关系。基因需通过转录、翻译和蛋白的修饰之后才能发挥作用。基因多态联合下游代谢物的含量测定更能准确的评价DPD酶的活性[5]。目前常应用液相色谱-串联质谱联用法对人血浆或干燥唾液中U和UH2浓度进行检测[6-11],但所报道的方法均有一些复杂或难以重现。本研究成功的建立了一种灵敏、高效、准确、重现性好,且能同时测定人血浆中U和UH2浓度的UHPLC-MS/MS方法,为体内DPD总体活性提供更客观有效的评价途径。
1. 材料与方法
1.1 仪器与耗材
1290-6460A超高效液相色谱-串联质谱仪,包含G4220A二元泵、G4226A自动进样器、G1316C柱温箱、MassHunter数据处理工作站(美国Agilent);调速涡旋混合器(美国Labnet);SK7200H超声仪(上海科导超声仪器有限公司);BSA124S-CW分析天平(德国赛多利斯);5810R型低温高速离心机、移液器(德国Eppendorf公司)。
1.2 药品与试剂
尿嘧啶、二氢尿嘧啶和氯尿嘧啶(内标)对照品(纯度>99%,大连美仑生物有限公司);乙酸铵(美国赛默飞世尔科技);甲醇、乙腈、乙酸乙酯、异丙醇(色谱纯,德国默克公司);屈臣氏蒸馏水(广州屈臣氏食品饮料有限公司);牛血清白蛋白(BSA)(上海博光生物科技有限公司);生理盐水(长征医院药学部自制)。
1.3 色谱分离条件
色谱柱为Agilent poroshell 120 SB-Aq-柱(2.1 mm×100 mm,2.7 μm),流动相为5 mmol/L乙酸铵水溶液(A)和乙腈(B),流速为0.3 ml/min,梯度洗脱:0~0.3 min,100% A;0.3~1.0 min,100%~10% A;1.0~2.5 min,10% A;柱温为30 ℃,洗脱时间2.5 min,进样量5 μl。
1.4 质谱分离条件
采用ESI离子源,多重反应监测(MRM)进行一/二级质谱分析,用于定量分析的检测离子为:U[M+H]+ m/z 113.0→40.1,检测模式为正离子模式;UH2[M+H]+ m/z 115.0→55.1,检测模式为正离子模式;氯尿嘧啶(IS)[M-H]- m/z 145.0→42.1,检测模式为负离子模式。雾化温度为300 ℃,雾化气压力为40 psi,干燥气流速为10 L/min,鞘气温度300 ℃,鞘气流速12 L/min,解离电压为4 000 V。
1.5 样本采集
选取8名血浆样品指标正常的成年人,于当日清晨8时空腹状态下静脉采血3 ml, EDTA-3K管抗凝,离心后分离上层血浆, 于−80 ℃冰箱冻存。
1.6 样本预处理
取100 μl样本,加10 μg/ml氯尿嘧啶(IS)10 μl,加乙酸乙酯3 ml,涡旋5 min,1710×g离心10 min,取上层有机相2.7 ml,45 ℃氮气挥干仪挥干,用10%甲醇溶液100 μl复溶,涡旋1 min,取上清液进样分析。
1.7 标准溶液配制
用含有3 %牛血清白蛋白作为空白基质代替血浆配置标准曲线样品。取100 μg/ml的尿嘧啶和二氢尿嘧啶各100 μl,加800 μl水,制成10 μg/ml标准混合液,置于−20 ℃备用。取10 μg/ml标准混合液适量,用3 %牛血清白蛋白稀释制成10、20、50、100、200、500、1000、1500 ng/ml系列浓度样品, 然后按照上述“1.6”项下样品的处理方法配制。
2. 结果
2.1 专属性考察
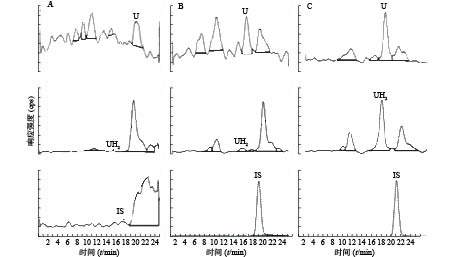
U和UH2的出峰时间以及峰型良好,代替血浆经过前处理后,对待测组分的测定没有干扰,内标对分析物的测定也没有干扰,且能很好分离,结果见图1。
2.2 标准曲线和线性范围
U和UH2的线性范围是10.0~1 500.0 ng/ml,以空白BAS中U和UH2的浓度为横坐标(X),U和UH2与内标化合物氯尿嘧啶的峰面积比为纵坐标(Y),进行最小二乘法加权(权重系数为1/χ2),U和UH2的线性回归方程分别是Y=0.27X+0.0022、Y=0.58X+0.0380,r均>0.990,表明线性关系良好。
2.3 精密度和准确度
取定量下限、低、中、高标准添加血浆样本按照前处理方法进行处理,每个浓度样品平行制备5份进行分析,连续3 d重复操作,根据当天的标准曲线计算当天实测样本浓度,计算样本在低、中和高浓度下的日内、日间精密度和准确度,结果显示,精密度和准确度的偏差均在15%左右。准确度相对偏差在20%范围内时,最低定量下限精密度偏差不大于20%,结果见表1。
表 1 尿嘧啶和二氢尿嘧啶的精密度 (n=5)分析物 标示浓度 (ng/ml) 日内 日间 测定浓度 (ng/ml) 精密度(CV%) 准确性(RE%) 测定浓度 (ng/ml) 精密度(CV%) 准确性(RE%) 尿嘧啶 10 10.2±0.38 3.74 2.58 10.12±0.78 7.70 1.18 20 20.63±1.21 5.87 3.15 19.97±1.35 6.74 −0.16 500 529.73±4.64 0.88 5.95 484.32±35.72 7.37 −3.12 1000 1093.33±25.10 2.30 9.33 1098.25±25.16 2.29 9.82 二氢尿嘧啶 10 10.32±0.71 6.86 3.18 10.28±0.65 6.37 2.77 20 19.98±2.19 10.95 −0.12 19.86±1.85 9.31 −0.72 500 517.51±10.69 2.07 3.50 515.66±10.36 2.01 3.13 1000 1079.83±17.91 1.66 7.98 1080.11±24.50 2.27 8.01 2.4 基质效应和提取回收率
取低、高2个浓度的样本进行基质效应和提取回收率考察,结果显示,U、UH2及内标氯尿嘧啶的基质效应和提取回收率良好,结果均较稳定,结果见表2。
表 2 尿嘧啶和二氢尿嘧啶的基质效应和提取回收率分析物 标识浓度(ng/ml) 基质效应 提取回收率 平均基质效应 CV(%) 平均回收率 CV(%) 尿嘧啶 1000 101.00 6.15 94.98 9.01 20 99.99 3.63 100.01 7.64 二氢尿嘧啶 1000 85.72 2.07 106.47 1.58 20 93.58 4.53 99.54 9.77 2.5 样品稳定性
考察低、高2个浓度的血浆样品经历3次冷冻与解冻循环的稳定性、血浆样品在室温(25 ºC)放置6 h后经样品处理后稳定性和血浆样品经样品处理后室温放置24 h的稳定性,结果显示,3次冻融、6 h室温(25 ºC)条件下和24 h放置自动进样器中的稳定性均符合要求,结果见表3。
表 3 样品的稳定性(RE%)分析物 冻融3次 室温放置6 h 置自动进样器24 h 低 高 低 高 低 高 尿嘧啶 100.71 98.34 93.49 106.60 108.20 107.99 二氢尿嘧啶 92.67 92.64 93.61 107.26 106.97 107.15 2.6 样本检测
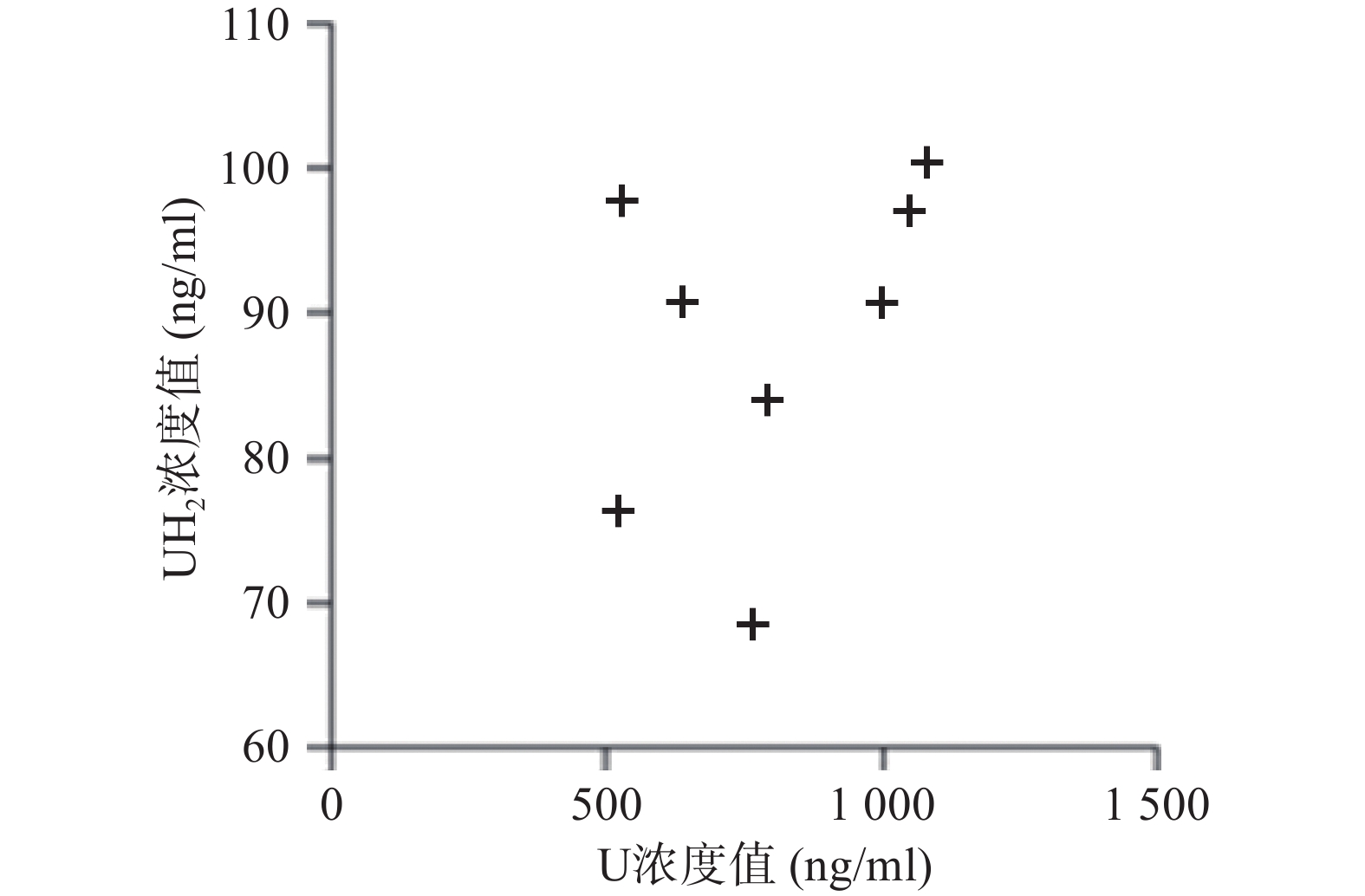
应用本研究所建立的方法,对8名健康成人的血浆样本测定分析,在样本实测过程中, 同时插入已知浓度的随行质控样本(QC样本), 随时监控样本测定的准确度。U和 UH2 浓度测定结果见图2。
3. 讨论
3.1 空白基质的选择
U和UH2是人体内常见的两种物质,且同核酸的代谢密切相关,由于U和UH2均为人体内源性物质,故不能采用人源的基质进行方法学的开发及验证,通过查阅资料,选择了不含U和UH2的3%牛血清蛋白作为基质进行方法学的开发[12]。也有文献报道采用去除U和UH2的人源血浆基质进行方法学实验[9],但基质的来源较珍贵,不适合方法的普及,所以选用3%牛血清蛋白作为替代基质。
3.2 色谱柱的选择
U因其特殊的化学性质,在大部分的色谱柱上均没有保留。U和UH2的LogP值分别为−0.707和−0.840,有较强的亲水性,决定了其不保留的性质。在定量方法的开发过程中,先后采用了Agilent Zorbax SB-C18色谱柱,Agilent Zorbax Eclipse-C18色谱柱,Waters Atlantis T3色谱柱,Waters Xselect色谱柱,Waters Xbridge等色谱柱来进行条件摸索,但上述色谱柱对U和UH2均没有保留。最后,采用Agilent Zorbax SB-Aq对U和UH2进行定量分析,该色谱柱对强极性的化合物有较好的保留效果,同时,兼容100%的起始流动相也对保留产生了良好的结果。
3.3 样本预处理的优化
本研究还分别考察了几种常见的处理方法,包括甲醇和乙腈的蛋白沉淀、Waters Oasis HLB萃取板的固相萃取以及乙酸乙酯,甲基叔丁基醚,二氯甲烷/三氯甲烷,环己烷进行的液液萃取,结果发现乙酸乙酯对U和UH2的萃取效果较好,同时,还分别考察了5%、10%、20%、30%、40%、50%的异丙醇、乙酸乙酯溶液对U和UH2的萃取效果,结果发现,单纯的乙酸乙酯对待测化合物具有较好的提取效率。提取回收率均高于90%,且RSD<10%。另外对3%牛血清蛋白的基质效应进行了考察,结果发现平均基质效应在85%~101%之间,RSD<7%,说明该前处理方法对于基质的清除较为彻底,测定结果稳定,没有明显的基质干扰。
本研究虽重在方法开发,收集的样本数量较少,但从测定的U和UH2浓度分布来看DPD对内源性U的代谢存在个体差异,建议临床应用5-氟尿嘧啶及其卡培他滨筛查DPD总体活性[12-13],后续可进一步扩大样本数量进行深入研究。
4. 结论
本实验建立了一种快速,稳定,高灵敏度的UHPLC-MS/MS方法,可用于测定人体内源性物质U和UH2的含量,从代谢物的角度评价DPD酶的活性,从而协助临床医生制定化疗药物5-氟尿嘧啶及其口服前药卡培他滨合理的用量,以较低的毒副反应获得最大的临床疗效。
-
表 1 各组miR-449a表达水平比较
组别 miR-449a 对照组 1.16±0.08 LEF组 0.58±0.05* LEF+mimic组 2.04±0.16# mimic组 6.32±0.63* LEF+inhibitor组 0.41±0.06# inhibitor组 0.77±0.07* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 表 2 各组细胞的相对细胞活力比较(%)
组别 24 h 48 h 72 h 对照组 100.07±1.83 100.76±2.07 100.16±1.96 LEF组 103.67±2.06 110.83±2.15* 121.17±2.65* LEF+mimic组 99.98±2.14 98.57±2.11# 97.37±2.01# mimic组 97.54±1.97 91.79±2.35* 81.77±1.78* LEF+inhibitor组 107.68±2.08 118.67±3.07# 132.84±2.07# inhibitor组 104.31±1.79 111.38±2.67* 119.35±2.18* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 表 3 各组细胞增殖和凋亡情况比较
组别 克隆形成数目(个) 细胞凋亡率(%) 对照组 54.32±4.36 5.53±0.94 LEF组 87.66±7.24* 3.11±0.76* LEF+mimic组 60.82±6.06# 6.73±1.26# mimic组 31.12±3.78* 17.32±3.28* LEF+inhibitor组 119.35±5.08# 2.14±0.62# inhibitor组 92.71±7.89* 3.45±0.83* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 表 4 各组细胞α-SMA相对荧光强度比较
组别 α-SMA Col I 对照组 1.02±0.11 1.24±0.14 LEF组 2.36±0.47* 2.57±0.38* LEF+mimic组 1.53±0.34# 1.89±0.25# mimic组 0.47±0.05* 0.45±0.06* LEF+inhibitor组 3.25±0.18# 4.13±0.54# inhibitor组 2.48±0.15* 3.11±0.39* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 表 5 各组p-JNK/JNK相对水平比较
组别 p-JNK JNK p-JNK/JNK 对照组 2.04±0.18 2.16±0.16 0.94±0.09 LEF组 2.87±0.31 1.05±0.10 2.73±0.18* LEF+mimic组 1.67±0.19 2.24±0.21 0.75±0.07# mimic组 0.96±0.11 3.11±0.28 0.31±0.04* LEF+inhibitor组 3.04±0.24 1.10±0.10 2.76±0.25# inhibitor组 3.78±0.34 1.02±0.09 3.71±0.31* *P<0.05,与对照组比较;#P<0.05,与LEF组比较 -
[1] JOSHI S, SINGH A R, WONG S S, et al. Rac2 is required for alternative macrophage activation and bleomycin induced pulmonary fibrosis; a macrophage autonomous phenotype[J]. PLoS One,2017,12(8):e0182851-e0182856. doi: 10.1371/journal.pone.0182851 [2] REN L M, LI R, CHEN L N, et al. Efficacy and safety of weekly leflunomide for the treatment of early rheumatoid arthritis: a randomized, multi-center study[J]. Int J Rheum Dis,2016,19(7):651-657. doi: 10.1111/1756-185X.12677 [3] BOCKHORN J, DALTON R, NWACHUKWU C, et al. MicroRNA-30c inhibits human breast tumour chemotherapy resistance by regulating TWF1 and IL-11[J]. Nat Commun,2013,4: 4(1):1393-1398. [4] LI J, LU M J, JIN J, et al. MiR-449a suppresses tamoxifen resistance in human breast cancer cells by targeting ADAM22[J]. Cell Physiol Biochem,2018,50(1):136-149. doi: 10.1159/000493964 [5] HAN R H, JI X M, RONG R, et al. MiR-449a regulates autophagy to inhibit silica-induced pulmonary fibrosis through targeting Bcl2[J]. J Mol Med,2016,94(11):1267-1279. doi: 10.1007/s00109-016-1441-0 [6] TANG Y N, GENG Q, CHEN D, et al. Germline proliferation is regulated by somatic endocytic genes via JNK and BMP signaling in Drosophila[J]. Genetics,2017,206(1):189-197. doi: 10.1534/genetics.116.196535 [7] HUANG Y, MA S F, ESPINDOLA M S, et al. Microbes are associated with host innate immune response in idiopathic pulmonary fibrosis[J]. Am J Respir Crit Care Med,2017,196(2):208-219. doi: 10.1164/rccm.201607-1525OC [8] DENG F, ZHANG P, FENG J, et al. Effect of leflunomideon inflammatory factors and immune function in rats with chronic glomerulonephritis[J]. J Sichuan Univ Med Sci Ed,2016,47(2):217-221. [9] PATEL A, ZHANG S J, PARAMAHAMSA M, et al. Leflunomide induces pulmonary and hepatic CYP1A enzymes via aryl hydrocarbon receptor[J]. Drug Metab Dispos,2015,43(12):1966-1970. doi: 10.1124/dmd.115.066084 [10] SCOTT D L. Interstitial lung disease and disease modifying anti-rheumatic drugs[J]. Lancet,2004,363(9416):1239-1240. [11] SAKAI F, NOMA S, KURIHARA Y, et al. Leflunomide-related lung injury in patients with rheumatoid arthritis: imaging features[J]. Mod Rheumatol,2005,15(3):173-179. doi: 10.3109/s10165-005-0387-9 [12] RYU C, SUN H X, GULATI M, et al. Extracellular mitochondrial DNA is generated by fibroblasts and predicts death in idiopathic pulmonary fibrosis[J]. Am J Respir Crit Care Med,2017,196(12):1571-1581. doi: 10.1164/rccm.201612-2480OC [13] ISHIDA Y, KIMURA A, NOSAKA M, et al. Essential involvement of the CX3CL1-CX3CR1 axis in bleomycin-induced pulmonary fibrosis via regulation of fibrocyte and M2 macrophage migration[J]. Sci Rep,2017,7(1):16833-16837. doi: 10.1038/s41598-017-17007-8 [14] LIANG L, HUIJUAN L, LIANJIANG D, et al. MiR-449a suppresses LDHA-mediated glycolysis to enhance the sensitivity of non-small cell lung cancer cells to ionizing radiation[J]. Oncol Res Feat Preclin Clin Cancer Therap,2017,26(4):547-556. [15] WU D D, LIU J, CHEN J L, et al. MiR-449a suppresses tumor growth, migration, and invasion in non-small cell lung cancer by targeting a HMGB1-mediated NF-κB signaling pathway[J]. Oncol Res,2019,27(2):227-235. doi: 10.3727/096504018X15213089759999 [16] ZHANG J, GAO F D, NI T J, et al. Linc-POU3F3 is overexpressed in in-stent restenosis patients and induces VSMC phenotypic transformation via POU3F3/miR-449a/KLF4 signaling pathway[J]. Am J Transl Res,2019,11(7):4481-4490. [17] SATO-MATSUBARA M, MATSUBARA T, DAIKOKU A, et al. Fibroblast growth factor 2(FGF2) regulates cytoglobin expression and activation of human hepatic stellate cells via JNK signaling[J]. J Biol Chem,2017,292(46):18961-18972. doi: 10.1074/jbc.M117.793794 [18] YANG Y L, YE Y J, QIU Q, et al. Triptolide inhibits the migration and invasion of rheumatoid fibroblast-like synoviocytes by blocking the activation of the JNK MAPK pathway[J]. Int Immunopharmacol,2016,41:8-16. doi: 10.1016/j.intimp.2016.10.005 [19] SHINGYOCHI Y, KANAZAWA S, TAJIMA S, et al. A low-level carbon dioxide laser promotes fibroblast proliferation and migration through activation of akt, ERK, and JNK[J]. PLoS One,2017,12(1):e0168937-e0168937. doi: 10.1371/journal.pone.0168937 -





 下载:
下载:
 下载:
下载: