-
糖尿病是临床常见的慢性疾病[1-5]。临床中,约30%糖尿病患者共病抑郁,其中10%患者将进展为中重度抑郁[6-8],加重患者身心负担,严重影响其治疗及预后。目前临床主要通过汉密顿抑郁(HAMD)量表、ICD-10诊断标准和临床表现诊断抑郁。然而,仅通过量表和临床观察,不能及早发现抑郁并给予干预[9]。近年来,挥发性有机化合物(VOCs)作为研究热点,在多种疾病中均存在特征信号[10-13]。挥发性有机化合物是一组小分子代谢物,通过气相的形式在呼吸、汗液、血液、尿液和粪便中释放和被检测到,并且携带着人体生理和代谢状态的有用信息,其作为人体"气味指纹"常用于评估健康状况,以及疾病的筛查、诊断和治疗。普通意义上的VOCs主要是一类熔点低于室温而沸点在50~260 ℃之间的挥发性有机化合物,如烃类、卤代烃、氧烃和氮烃,它包括:苯系物、有机氯化物、氟里昂系列、有机酮、胺、醇、醚、酯和酸等。尿中VOCs主要有2-氧丙醛、2,5,8-三甲基丙酮-1,2,3,4-四氢萘-1-醇、苯酚、癸醛、壬醛、1,6-二氧杂环十二烷-7,12-二酮、1- 溴-1-(3-甲基-1-戊烯基)-2,2,3,3-四甲基环丙烷、异长叶烯-5-醇、3-乙基-3-甲基庚烷、正十四烷、苯胺、 2,5-环己二烯-1,4-二酮、苯乙烯、4-庚酮、二甲基硅烷二醇、己酸、2-庚酮、辛醇、环己酮等多种有机物。但目前为止,VOCs在糖尿病共病抑郁方面的相关研究尚未开展。本文以2型糖尿病患者为研究样本,利用微型气体测试装置检测分析患者尿液VOCs,旨在探讨糖尿病共病抑郁患者尿液VOCs是否存在特征信号,以期及早筛查发现能早期预测抑郁的有效分子标志物,为对糖尿病患者进行治疗干预提供实验依据。
-
选择2019年11月−2020年11月在上海交通大学附属第六人民医院南院住院治疗,并符合防治指南诊断标准的2型糖尿病患者,年龄25~75岁,无意识障碍,住院前及住院期间未接受任何抗抑郁药物治疗。
-
纳入本研究的患者均签署知情同意书,并由医院伦理委员会审核批准。
-
利用医院病历系统收集患者的年龄、性别、体重指数(BMI)、空腹血糖、糖化血红蛋白、谷草转氨酶(AST)、谷丙转氨酶(ALT)等基线资料。
-
患者住院期间,利用病人健康量表-9(Patient Health Questionnaire-9, PHQ9)对纳入研究的糖尿病患者进行抑郁症筛查。PHQ9量表是一个国际上通用的简便、有效的抑郁症障碍自评量表,内容如表1所示。
表 1 PHQ9抑郁症筛查量表
序号 项 目 完全没有 有几天 一半以上天数 几乎每天 1 做事时提不起劲或没有兴趣 0 1 2 3 2 感到心情低落, 沮丧或绝望 0 1 2 3 3 入睡困难、睡不安或睡得过多 0 1 2 3 4 感觉疲倦或没有活力 0 1 2 3 5 食欲不振或吃太多 0 1 2 3 6 觉得自己很糟或很失败,或让自己或家人失望 0 1 2 3 7 对事物专注有困难,例如看报纸或看电视时 0 1 2 3 8 动作或说话速度缓慢到别人已经察觉?或者变得烦躁或坐立不安,动来动去的情况更甚平常 0 1 2 3 9 有不如死掉或用某种方式伤害自己的念头 0 1 2 3 对纳入研究的患者,采用PHQ9量表内容对患者近两周生活情况进行提问,根据每项症状出现的频率与程度换算为对应的抑郁评分,其中0~4分表示没有抑郁,5~9分提示可能患者存在轻微抑郁症,10~14分提示可能有中度抑郁症,15~19分提示可能有中重度抑郁症,20~27分提示可能有重度抑郁症。根据抑郁评分将患者分为糖尿病组(抑郁评分≤4)及糖尿病共病抑郁组(抑郁评分≥5)。
-
用无菌尿液收集管采集尿液样本10 ml,样本颠倒混匀,分装5 ml尿液样本于15 ml离心管内,−80 ℃保存备用,用于尿液VOCs检测。
-
将尿液样本用针式过滤器(0.22 μm聚醚砜)进行过滤,取5 ml 过滤后液体加入20 ml螺口顶空瓶中,拧紧瓶口后放入20 ℃水浴中孵育10 min,用于测试。
-
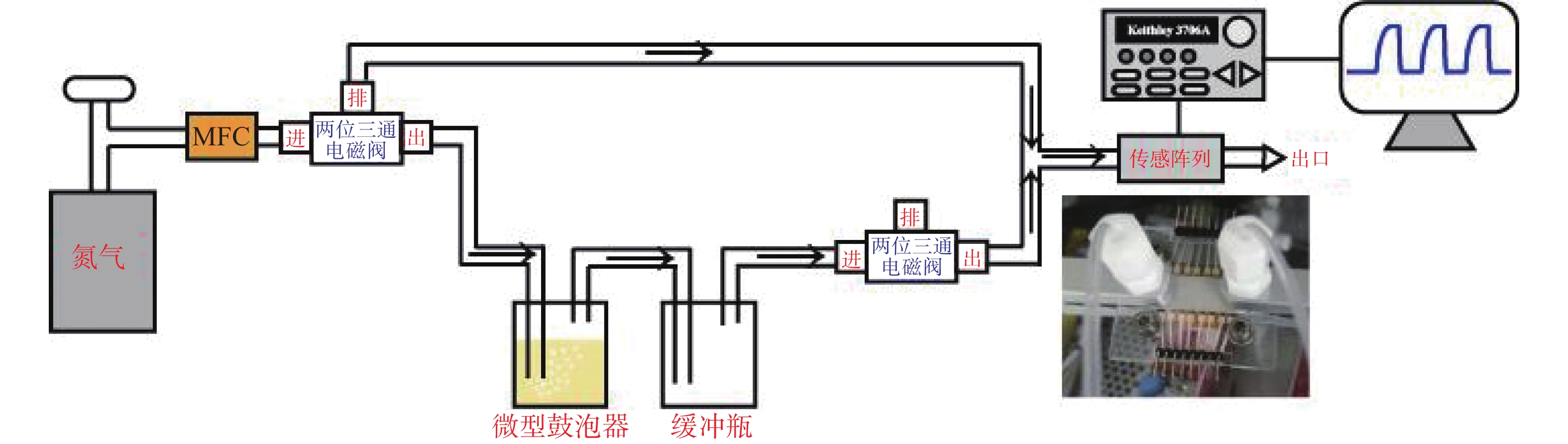
使用内径2 mm四氟乙烯管分别连接两种长度的金属不锈钢针头(18 g, 80 mm和18 g, 35 mm)。将80 mm的针头完全插入待测尿液底部,35 mm针头插入待测尿液上部(即微型鼓泡器),将微型鼓泡器与微型气体测试装置连接,如图1。
-
保持两个电磁阀断电状态,通过流量计控制300 sccm N2进入微型集成式传感阵列获取稳定的基线(即稳定阶段),如图2。然后将两个两位三通电磁阀同时开启,通过微型鼓泡器获取尿液中VOCs,鼓泡1 min,即测试阶段。最后再同时断电,N2冲洗2 min,即恢复阶段。更换金属不锈钢针头和尿液样本继续测试。
-
在完成尿液挥发性有机化合物测试后,对方法的灵敏度、特异性、准确性进行分析,灵敏度为被正确识别为糖尿病共病抑郁人数占被正确识别为糖尿病共病抑郁人数及被错误认定为糖尿病人数之和的百分比,特异性为被正确识别为糖尿病人数占被正确识别为糖尿病人数及被误诊为糖尿病共病抑郁人数之和的百分比,准确性为被正确识别为糖尿病共病抑郁人数及被正确识别为糖尿病人数之和占样本总数的百分比,具体计算公式如下:
$$\text{灵敏度} =\frac{\mathrm{T}\mathrm{P}}{\mathrm{T}\mathrm{P}+\mathrm{F}\mathrm{N}} $$ (1) $$\text{特异性} =\frac{\mathrm{T}\mathrm{N}}{\mathrm{T}\mathrm{N}+\mathrm{F}\mathrm{P}} $$ (2) $$ \text{准确性}=\frac{\mathrm{T}\mathrm{P}+\mathrm{T}\mathrm{N}}{\mathrm{T}\mathrm{o}\mathrm{t}\mathrm{a}\mathrm{l}} $$ (3) 式中:TP(真阳性)测量被正确识别为糖尿病+抑郁症患者数量;TN(真阴性)测量被正确识别为糖尿病患者的数量;FP(假阳性)测量被误诊为糖尿病+抑郁症患者的数量;FN(假阴性)测量被错误认定为糖尿病患者数量;Total是样本的总数。
-
数据采用SPSS 19.0和GraphPad Prism 8软件进行统计分析,患者基线特征采用两独立样本T检验分析,尿液特征VOCs采用主成分分析进行降维处理。在本研究中,P<0.05被认为差异有统计学意义。
-
本次研究纳入糖尿病患者共161例,其中单纯糖尿病组患者141例,占87.58%;糖尿病共病抑郁组患者20例,占12.42%,患者具体情况如表2和表3所示。
表 2 两组患者基线特征
组别 例数[n(%)] 抑郁评分 性别[n(%)] 年龄 BMI 男 女 单纯糖尿病组 141(87.58) 0.45±0.96 93(65.96) 48(34.04) 52.12±12.45 25.93±4.59 糖尿病共病抑郁组 20(12.42) 7.85±5.10** 13(65) 7(35) 59.20±11.55* 24.22±4.13 注: *P<0.05;**P<0.01,与糖尿病组相比。 表 3 两组患者空腹血糖、糖化血红蛋白、肝功能比较
组别 例数[n(%)] 空腹血糖 糖化血红蛋白 AST ALT 单纯糖尿病组 141(87.58) 10.61±4.98 10.33±2.43 24.59±16.26 32.12±29.85 糖尿病共病抑郁组 20(12.42) 10.16±5.48 10.04±2.47 22.65±12.86 31.10±21.43 结果显示,糖尿病共病抑郁组患者抑郁评分显著高于单纯糖尿病组患者(P<0.01),同时发现,糖尿病共病抑郁组患者年龄显著高于单纯糖尿病组患者(P<0.05)。此外,两组患者的性别组成、BMI无统计学差异(P>0.05)。
结果显示,单纯糖尿病组、糖尿病共病抑郁组患者空腹血糖、糖化血红蛋白、AST、ALT无统计学差异。
-
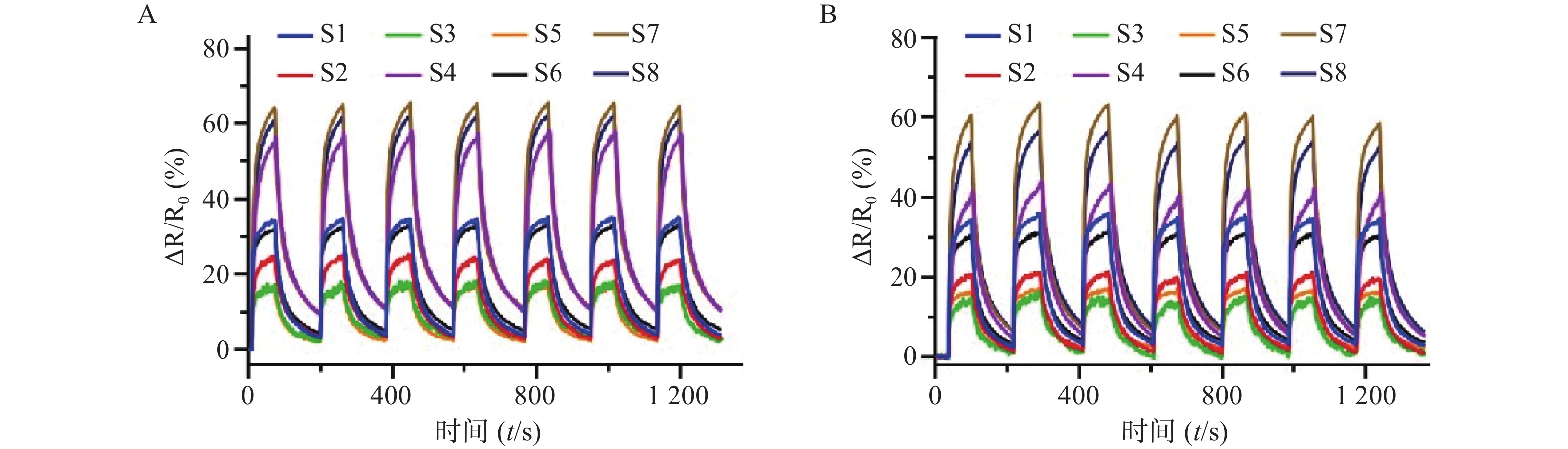
从141例单纯糖尿病患者中随机选取50份尿液,糖尿病共病抑郁组样本20份全部纳入,样本合计70份进行VOCs检测,获取糖尿病组患者和糖尿病共病抑郁组患者的尿液VOCs信号。部分尿液样本动态信号响应数据如图3所示。由图3得知,气路微型化装置中的8个传感器对于尿液VOCs具有响应差异性,两组患者对应的所有传感器电阻变化率具有差异,说明两组患者的尿液VOCs组成存在差异,由于传感器电阻变化率体现的是所有传感器数据,未能明显呈现两组患者的尿液VOCs差异,因此需要进一步通过主成分分析对患者尿液VOCs进行可视化。
-
将获取的原始数据先基线归零(图2B),按公式(4)计算电阻变化率特征值F:
$$ \mathrm{F}=\frac{\mathrm{R}\mathrm{b}-\mathrm{R}\mathrm{a}}{\mathrm{R}\mathrm{a}}\times 100 \% $$ (4) 通过上述方法得到8个传感器采集的8个特征值,使用SPSS软件将获取的8个特征值和70组样本数据(8×70)进行主成分分析(PCA),并将分析数据应用GraphPad Prism 8软件处理。通过传感阵列的交叉响应,两组患者的尿液特征VOCs主成分分析如图4所示。
主成分分析结果显示,单纯糖尿病组和糖尿病共病抑郁组对应散点在组成上相互聚集,表明组内样本相似性高,同时两组散点呈现分散状态,提示两组患者的尿液VOCs基本分开,两组患者尿液VOCs存在组成差异。
通过公式(1)~(3)计算微腔集成式传感阵列对70份样品中糖尿病和糖尿病加抑郁症患者识别计算,测量被正确识别为糖尿病+抑郁症患者数量为16,测量被正确识别为糖尿病的数量为49,测量被误诊为糖尿病+抑郁症患者的人数为1,测量被错误认定为糖尿病数量为4,样本总数为70,得出该方法灵敏度为80%,特异性为98%,准确性为92.8%。
-
糖尿病是临床常见的慢性病,由于需要终身服药、额外的医疗支出、严格的饮食限制和潜在的并发症,给患者带来沉重的身体和心理负担[14]。研究发现,约30%糖尿病患者共病抑郁,其中10%进展为中重度抑郁[6-8]。共病抑郁后,患者生活质量受到进一步影响,血糖控制效果变差,大大影响其治疗与预后[15]。此外,与糖尿病患者相比,糖尿病共病抑郁患者的死亡率显著上升[16]。然而,在临床工作中,糖尿病共病抑郁与糖尿病心理痛苦容易混淆,仅靠现有的临床量表未能有效、及早地确诊抑郁,同时临床缺乏糖尿病共病抑郁的特征性代谢分子辅助诊断,使得糖尿病共病抑郁早期诊断尤为困难。尿液VOCs是近年来的研究热点,其成分和浓度反映机体的病理生理情况。由于尿液中的代谢物浓度较高,同时可通过无创手段获得,在减轻患者身体负担的同时,为多种疾病的诊断、治疗创造条件。已有研究发现,糖尿病、肿瘤等疾病可以在VOCs中找到对应的特征信号[17-20],为临床诊断提供新思路。但目前为止,VOCs在糖尿病共病抑郁方面的相关研究尚未开展。因此,探索尿液VOCs在糖尿病共病抑郁领域具有积极的临床意义。
在本研究中,我们纳入161例符合糖尿病诊断标准的2型糖尿病患者进行分析。PHQ9量表作为识别、评估抑郁程度的简便、有效工具,条目简单,操作性强,其检测抑郁的灵敏度与HAMD量表评分显著相关,故在本研究中采用PHQ9量表对入组患者进行抑郁评估。经PHQ9量表筛查后,糖尿病患者141例,糖尿病共病抑郁患者20例,糖尿病共病抑郁组患者占比12.42%。结果显示,糖尿病共病抑郁组患者抑郁评分、年龄显著高于糖尿病组患者(P<0.05),但两组的BMI、空腹血糖、糖化血红蛋白、AST、ALT无统计学意义。提示临床,对于老年糖尿病患者,应更关注其心理状态,及时开展积极的心理治疗。
接着,我们采集了两组患者的晨尿,并建立了微型气路测试装置,通过测试装置中的8个传感器对两组患者尿液中VOCs进行特征检测。结果显示,两组患者尿液VOCs对应的传感器电阻变化率有差异,提示两组患者尿液VOCs组成存在差异。在主成分分析中,我们发现,单纯糖尿病组患者和糖尿病共病抑郁组患者的尿液VOCs基本分开,进一步证明两组患者的尿液VOCs存在组成差异。经计算,气路微型化装置检测VOCs方法的灵敏度、特异性、准确性良好,表明该方法在检测尿液VOCs时具有可行性。以上结果说明,在糖尿病共病抑郁患者尿液中可能存在特征VOCs。糖尿病共病抑郁后,患者尿液VOCs发生改变,表明抑郁可能扰动糖尿病患者机体中的物质代谢,使体内代谢物发生复杂改变,可表现在尿液VOCs中。
除气路微型化测试装置外,国外学者还利用电子鼻设备通过尿液VOCs成功区分糖尿病组患者与健康对照组[20],提示尿液VOCs作为新型的非入侵性诊断标志物,具有非常重要的研究潜力。尿液VOCs作为一种新颖的临床筛查指标,对患者基本无创伤,依从性高,同时通过气路微型化测试装置建立的检测方法灵敏度、特异性和准确性高,对临床早期发现和干预糖尿病共病抑郁具有实际应用价值。但目前建立的测试装置未能对VOCs种类进行区分,VOCs中的具体成分和浓度仍然未知。因此,需要完善测试装置及检测方法,继续探索糖尿病共病抑郁患者体内特征VOCs成分及浓度,以期发现糖尿病共病抑郁患者体内特征VOCs,为临床早期诊断提供实验参考。
Analysis of volatile organic compounds in urine of diabetic patients comorbid with depression
-
摘要:
目的 比较糖尿病患者与糖尿病共病抑郁患者尿液挥发性有机化合物(VOCs)的差别。 方法 纳入2019年11月至2020年11月在上海交通大学附属第六人民医院南院住院治疗,并符合防治指南诊断标准的2型糖尿病患者,利用PHQ9量表进行抑郁症筛查,根据评分将纳入研究的患者分为两组,分别为单纯糖尿病组和糖尿病共病抑郁组。采集患者晨尿,利用微型气体测试装置检测尿液中的挥发性有机化合物。 结果 纳入研究患者合计161例,其中单纯糖尿病组141例,糖尿病共病抑郁组20例。微型气体测试装置灵敏度为80%,特异性为98%,准确性为92.8%。两组患者的尿液挥发性有机化合物存在差异。 结论 糖尿病共病抑郁患者与糖尿病患者相比,尿液中的挥发性有机化合物组成可能发生改变,可为临床早期诊断抑郁症提供实验参考。 Abstract:Objective To compare the difference of volatile organic compounds (VOCs) in the urine of diabetic patients comorbid with or without depression. Methods Patients with type 2 diabetes who met the diagnostic criteria of prevention and treatment guidelines and were treated in inpatient department of Sixth People’s Hospital South Campus, Shanghai Jiaotong University, from November 2019 to November 2020 were included in the study. Depression screening was performed using PHQ9 scale. According to the scores, the patients were divided into two groups: diabetic patient group and diabetic patient comorbidity depression group. The morning urine was collected and VOCs in urine were detected using a miniature gas tester. Results A total of 161 patients with diabetes mellitus, including 141 patients in the diabetic group and 20 patients in the diabetic comorbidity depression group. The results indicated that the sensitivity, specificity and accuracy of the method are 80%, 98% and 92.8% respectively. There were differences in urine volatile organic compounds between the two groups. Conclusions Compared with diabetic patients, the composition of volatile organic compounds in urine may change after diabetic comorbidity depression, which can provide experimental reference for early clinical diagnosis of depression. -
Key words:
- diabetic /
- depression /
- urine /
- volatile organic compounds
-
表 1 PHQ9抑郁症筛查量表
序号 项 目 完全没有 有几天 一半以上天数 几乎每天 1 做事时提不起劲或没有兴趣 0 1 2 3 2 感到心情低落, 沮丧或绝望 0 1 2 3 3 入睡困难、睡不安或睡得过多 0 1 2 3 4 感觉疲倦或没有活力 0 1 2 3 5 食欲不振或吃太多 0 1 2 3 6 觉得自己很糟或很失败,或让自己或家人失望 0 1 2 3 7 对事物专注有困难,例如看报纸或看电视时 0 1 2 3 8 动作或说话速度缓慢到别人已经察觉?或者变得烦躁或坐立不安,动来动去的情况更甚平常 0 1 2 3 9 有不如死掉或用某种方式伤害自己的念头 0 1 2 3 表 2 两组患者基线特征
组别 例数[n(%)] 抑郁评分 性别[n(%)] 年龄 BMI 男 女 单纯糖尿病组 141(87.58) 0.45±0.96 93(65.96) 48(34.04) 52.12±12.45 25.93±4.59 糖尿病共病抑郁组 20(12.42) 7.85±5.10** 13(65) 7(35) 59.20±11.55* 24.22±4.13 注: *P<0.05;**P<0.01,与糖尿病组相比。 表 3 两组患者空腹血糖、糖化血红蛋白、肝功能比较
组别 例数[n(%)] 空腹血糖 糖化血红蛋白 AST ALT 单纯糖尿病组 141(87.58) 10.61±4.98 10.33±2.43 24.59±16.26 32.12±29.85 糖尿病共病抑郁组 20(12.42) 10.16±5.48 10.04±2.47 22.65±12.86 31.10±21.43 -
[1] TIAN C J, ZHEN Z. Reactive carbonyl species: diabetic complication in the heart and lungs[J]. Trends Endocrinol Metab,2019,30(8):546-556. doi: 10.1016/j.tem.2019.05.005 [2] KOPF S, KUMAR V, KENDER Z, et al. Diabetic pneumopathy-A new diabetes-associated complication: mechanisms, consequences and treatment considerations[J]. Front Endocrinol (Lausanne),2021,12:765201. doi: 10.3389/fendo.2021.765201 [3] MOZZANICA F, FERRULLI A, VUJOSEVIC S, et al. Olfactory disfunction and diabetic complications in type 2 diabetic patients: a pilot study[J]. Endocrine,2022,75(3):760-767. doi: 10.1007/s12020-021-02897-6 [4] WU L, LIU C J, CHANG D Y, et al. Annexin A1 alleviates kidney injury by promoting the resolution of inflammation in diabetic nephropathy[J]. Kidney Int,2021,100(1):107-121. doi: 10.1016/j.kint.2021.02.025 [5] KAZAMEL M, STINO A M, SMITH A G. Metabolic syndrome and peripheral neuropathy[J]. Muscle Nerve,2021,63(3):285-293. doi: 10.1002/mus.27086 [6] HASHIM N A, ARIARATNAM S, SALLEH M R, et al. Depression and associated factors in patients with type 2 diabetes mellitus[J]. East Asian Arch Psychiatry,2016,26(2):77-82. [7] SEMENKOVICH K, BROWN M E, SVRAKIC D M, et al. Depression in type 2 diabetes mellitus: prevalence, impact, and treatment[J]. Drugs,2015,75(6):577-587. doi: 10.1007/s40265-015-0347-4 [8] CAMPAYO A, DE JONGE P, ROY J F, et al. Depressive disorder and incident diabetes mellitus: the effect of characteristics of depression[J]. Am J Psychiatry,2010,167(5):580-588. doi: 10.1176/appi.ajp.2009.09010038 [9] ZHANG J T, WU C C, SHENG J Y, et al. Molecular basis of 5-hydroxytryptophan synthesis in Saccharomyces cerevisiae[J]. Mol Biosyst,2016,12(5):1432-1435. doi: 10.1039/C5MB00888C [10] NAKHLEH M K, AMAL H, JERIES R, et al. Diagnosis and classification of 17 diseases from 1404 subjects via pattern analysis of exhaled molecules[J]. ACS Nano,2017,11(1):112-125. doi: 10.1021/acsnano.6b04930 [11] BROZA Y Y, VISHINKIN R, BARASH O, et al. Synergy between nanomaterials and volatile organic compounds for non-invasive medical evaluation[J]. Chem Soc Rev,2018,47(13):4781-4859. doi: 10.1039/C8CS00317C [12] DIETER T, LAUERER J. Depression or diabetes distress? Perspect Psychiatr Care,2018,54(1):84-87. doi: 10.1111/ppc.12203 [13] WU W W, HAICK H. Materials and wearable devices for autonomous monitoring of physiological markers[J]. Adv Mater,2018,30(41):e1705024. doi: 10.1002/adma.201705024 [14] BOGNER H R, MCCLINTOCK H F. Costs of coexisting depression and diabetes[J]. J Gen Intern Med,2016,31(6):594-595. doi: 10.1007/s11606-016-3675-5 [15] CHEN S G, ZHANG Q, DAI G X, et al. Association of depression with pre-diabetes, undiagnosed diabetes, and previously diagnosed diabetes: a meta-analysis[J]. Endocrine,2016,53(1):35-46. doi: 10.1007/s12020-016-0869-x [16] BOT M, POUWER F, ZUIDERSMA M, et al. Association of coexisting diabetes and depression with mortality after myocardial infarction[J]. Diabetes Care,2012,35(3):503-509. doi: 10.2337/dc11-1749 [17] WOOLLAM M, TELI M, ANGARITA-RIVERA P, et al. Detection of volatile organic compounds (VOCs) in urine via gas chromatography-mass spectrometry QTOF to differentiate between localized and metastatic models of breast cancer[J]. Sci Rep,2019,9(1):2526. doi: 10.1038/s41598-019-38920-0 [18] DA COSTA B R B, DE MARTINIS B S. Analysis of urinary VOCs using mass spectrometric methods to diagnose cancer: a review[J]. Clin Mass Spectrom,2020,18:27-37. doi: 10.1016/j.clinms.2020.10.004 [19] DAULTON E, WICAKSONO A N, TIELE A, et al. Volatile organic compounds (VOCs) for the non-invasive detection of pancreatic cancer from urine[J]. Talanta,2021,221:121604. doi: 10.1016/j.talanta.2020.121604 [20] ESFAHANI S, WICAKSONO A, MOZDIAK E, et al. Non-invasive diagnosis of diabetes by volatile organic compounds in urine using FAIMS and Fox4000 electronic nose[J]. Biosensors (Basel),2018,8(4):E121. -





 下载:
下载: