-
环孢素(cyclosporine A, CsA)是肾移植术后三联免疫抑制方案中的基础用药之一。环孢素个体差异大、治疗窗窄,静脉给药虽能更快达到目标浓度,但也更容易使血药浓度偏离治疗窗。研究表明,环孢素血药浓度的个体间差异受患者生理、病理、遗传等因素的影响[1],尤其是与其体内过程相关的基因多态性,如CYP3A4*18B、CYP3A5*3、ABCB1(C1236T、G2677T/A、C3435T)、POR*28、PXR(C5705T、C39823T)和NFKB1-94 ins/del ATTG等。然而,目前如何根据基因型调整用药尚不明确,且针对环孢素注射液基因多态性的研究尚未见报道。因此,探究基因多态性对环孢素注射液血药浓度的影响,尝试建立以基因多态性为基础的个体化给药方案对优化临床用药具有一定的意义。
-
回顾性收集了某三甲医院泌尿外科收住的行肾移植术的患者144例。纳入标准:①患者年龄≥18岁;②住院期间使用环孢素注射液联合霉酚酸类药物和糖皮质激素。排除标准:①严重肝功能不全者(ALT或AST值≥3倍正常上限);②无法获取病案资料的患者;③同时服用显著影响环孢素血药浓度的药物,如氟康唑、伏立康唑、伊曲康唑及地尔硫䓬。
-
环孢素注射液连续多次给药后应用酶增强免疫分析法(EMIT)测定全血谷浓度,取稳态时的浓度作为最终的谷浓度(C0)。将剂量以体表面积进行校正,计算剂量校正谷浓度(C0/D′),即环孢素血药谷浓度/剂量×体表面积。
-
采用离心柱型全血DNA快速提取试剂盒提取全血样本中的基因组DNA,获得DNA样本浓度为10~60 ng/ml。基因分型采用Sequenom Mass ARRAY®SNP检测系统进行检测,由上海吉凯基因化学技术公司完成。
-
采用SPSS 24.0软件进行统计分析。计量资料以(
$\bar x \pm s$ )或Me(IQR)表示。采用独立样本t检验,比较单独使用环孢素注射液和联合使用环孢素注射液及糖皮质激素冲击治疗患者的C0及降低幅度的差异;采用χ2检验对各基因型分布进行Hardy-Weinberg平衡(HWE)检验;采用在线软件SHEsis(http://analysis.bio-x.cn/myAnalysis.php)分析各SNP位点间连锁不平衡(linkage disequilibrium,LD)状况;采用方差分析来计算各位点不同基因型患者间C0/D′的差异;采用Spearman相关性分析及多重线性回归分析建立基于基因多态性的个体化给药模型。 -
入组患者共144例,其中男性109例,女性35例,患者基本信息见表1。
表 1 研究对象的一般临床资料(n=144)
指标 统计描述 百分率(%) 年龄(岁) 37.5(15) 性别(男/女,例) 109/35 75.7/24.3 体重(kg) 59.46±10.47 体表面积(m2) 1.65(0.28) BMI(kg/ m2) 21.21±3.14 血红蛋白(g/L) 101.56±24.05 血细胞比容(%) 30.84±7.16 供体类型(尸体/亲属,例) 122/22 84.7/15.3 环孢素使用天数(d) 11(7) 是否激素冲击(是/否,例) 80/64 55.6/44.4 血肌酐是否降低(是/否,例) 112/32 77.7/22.3 注:数据以($\bar x \pm s$)或Me(IQR)表示 对患者环孢素注射液C0及用药后的血肌酐降低幅度进行统计分析。结果显示,单独使用环孢素注射液(单独用药组)后肌酐降低的患者比例为68.8%;联合使用环孢素注射液和糖皮质激素冲击治疗(联合用药组)后肌酐降低的患者比例为85.0%。单独用药组比联合用药组具有更高的C0〔(189.50±38.56)ng/ml vs(172.87±44.27)ng/ml〕,经独立样本T检验,两组患者C0的差异具有统计学意义(P<0.05)。然而,对两组患者的肌酐降低幅度进行Mann-Whitney U检验发现,单独用药组患者的肌酐降低幅度显著低于联合用药组〔19.27(22.84)% vs 45.25(50.38)%;P<0.01〕(见表2)。
表 2 单独用药与联合用药方案的血肌酐降低幅度差异
用药方案 例数及比例(N/%) 肌酐降低例数及比例(N/%) C0(ng/ml) 肌酐降低幅度(%) 环孢素注射液 64(44.4) 44(68.8) 189.50±38.56 19.27(22.84) 环孢素注射液+糖皮质激素 80(55.6) 68(85.0) 172.87±44.27* 45.25(50.38)** 注:*P<0.05,**P<0.01,与单用环孢素注射液比较 -
入组患者的CYP3A4*18B、CYP3A5*3、ABCB1 C1236T、ABCB1 G2677T/A、ABCB1 C3435T、PXR C5705T、PXR C25385T、NFKB1 -94 ins /del ATTG及POR*28(仅64例患者)等9个SNPs的基因型频率分布及HWE遗传平衡吻合度计算见表3。9个SNPs均符合HWE(P>0.05),说明研究对象来自同一孟德尔群体,具有良好的群体代表性。
表 3 肾移植患者中9个SNPs基因分型以及等位基因频率(n=144)
SNP(ID) 基因型频率(%) 等位基因频率(%) χ2 P 野生/野生 野生/突变 突变/突变 野生 突变 CYP3A4*18B GG(*1*1) GA(*1*18B) AA(*18B*18B) G A 0.046 0.830 rs2242480 80(55.6%) 54(37.5%) 10(6.9%) 74.3% 25.7% CYP3A5*3 AA(*1*1) AG(*1*3) GG(*3*3) A G 0.005 0.945 rs776746 11(7.6%) 57(39.6%) 76(52.8%) 27.4% 72.6% ABCB1 C1236T CC CT TT C T 0.985 0.321 rs1128503 14(9.7%) 70(48.6%) 60(41.7%) 34.0% 66.0% ABCB1G 2677T/A GG GT+GA TT+TA+AA G T+A 0.070 0.791 rs2032582 23(16.0%) 71(49.3%) 50(34.7%) 40.6% 59.4% ABCB1 C3435T CC CT TT C T 1.249 0.264 rs1045642 54(37.5%) 63(43.8%) 27(18.7%) 59.4% 40.6% PXR C5705T CC CT TT C T 2.918 0.088 rs3814055 87(60.4%) 45(31.3%) 12(8.3%) 76.0% 24.0% PXR C39823T CC CT TT C T 2.250 0.134 rs2276707 40(27.8%) 80(55.6%) 24(16.6%) 55.6% 44.4% NFKB1-94 ins /delATTG II ① ID ② DD ③ I D 0.036 0.849 rs28362491 45(31.3%) 72(50.0%) 27(18.7%) 56.3% 43.7% POR*28 CC CT TT C T 2.193 0.139 rs1057868 26(40.6%) 25(39.1%) 13(20.3%) 60.2% 39.8% 注:①. 指插入突变纯合子;②. 指插入突变杂合子;③. 指缺失突变纯合子。 -
各位点不同基因型患者之间使用环孢素注射液的C0/D′的差异见表4。在9个SNPs中,CYP3A4*18B基因多态性与环孢素注射液的C0/D′具有显著相关性,*1/*1基因型患者的C0/D′显著高于*18B/*18B基因型患者(P<0.05);CYP3A5*3、ABCB1 C1236T、ABCB1 G2677T/A、ABCB1 C3435T、PXR C5705T、PXR C39823T、NFKB1-94 ins/del ATTG及POR*28基因多态性均与肾移植患者环孢素注射液的C0/D′无显著相关性(P>0.05)。
表 4 各位点不同基因型对环孢素C0/D′的影响
位点(ID) 基因型 例数/占比[n,(%)] C0/D′[(ng/ml)/(mg/kg)] P CYP3A4*18B
rs2242480*1/*1 80(55.6) 1.52±0.42 0.044 *1/*18B 54(37.5) 1.42±0.42 *18B/*18B 10(6.9) 1.19±0.26* CYP3A5*3
rs776746*1/*1 11(7.6) 1.36±0.46 0.647 *1/*3 57(39.6) 1.45±0.37 *3/*3 76(52.8) 1.48±0.45 ABCB1 C1236T
rs1128503CC 14(9.70) 1.43±0.48 0.486 CT 70(48.6) 1.50±0.41 TT 60(41.7) 1.41±0.42 ABCB1 G2677T/A
rs2032582GG 23(16.0) 1.40±0.41 0.674 GA+GT 71(49.3) 1.49±0.40 AA+AT+TT 50(34.7) 1.44±0.46 ABCB1 C3435T
rs1045642CC 54(37.5) 1.46±0.41 0.596 CT 63(43.8) 1.43±0.43 TT 27(18.7) 1.53±0.43 PXR C5705T
rs3814055CC 87(60.4) 1.43±0.41 0.442 CT 45(31.3) 1.48±0.45 TT 12(8.30) 1.58±0.36 PXR C39823T
rs2276707CC 40(27.8) 1.55±0.49 0.262 CT 80(55.6) 1.43±0.40 TT 24(16.6) 1.38±0.35 NFKB1(-94 ins/del ATTG)
rs28362491II 45(31.3) 1.49±0.46 0.300 ID 72(50.0) 1.41±0.41 DD 27(19.7) 1.54±0.39 POR*28
rs1057868*1/*1 26(40.6) 1.63±0.45 0.491 *1/*28 25(39.1) 1.48±0.43 *28/*28 13(20.3) 1.54±0.38 注:*P<0.05,与*1/*1型比较。 -
参考单因素和多因素分析方法,将3个人口统计学指标(性别、年龄、体重)、3个临床指标(血红蛋白、血细胞比容、供体类型)和上述9个SNPs基因多态性定义为自变量,与环孢素注射液的C0/D′进行单因素相关分析。结果显示,在以上指标中,血红蛋白、血细胞比容和CYP3A4*18B基因多态性与环孢素注射液的C0/D′呈正相关,CYP3A4*18B与环孢素注射液的C0/D′呈负相关。其他12个指标与环孢素注射液C0/D′均没有显著相关性,详见表5。
表 5 各观察指标与环孢素注射液C0/D′的相关性
指标 相关系数(r) 决定系数(R2) P 年龄 0.114 0.013 0.175 性别 −0.071 0.005 0.400 体重 0.140 0.020 0.094 血红蛋白 0.463 0.214 0.000* 血细胞比容 0.454 0.206 0.000* 供体类型 0.112 0.013 0.180 CYP3A4*18B −0.176 0.031 0.035 CYP3A5*3 0.043 0.002 0.610 ABCB1 C1236T −0.056 0.003 0.504 ABCB1 G2677T/A 0.006 0.000 0.943 ABCB1 C3435T 0.022 0.000 0.798 PXR C5705T 0.100 0.010 0.235 PXR C39823T −0.136 0.018 0.103 NFKB1(-94 ins/del ATTG) 0.003 0.000 0.971 POR*28 −0.130 0.017 0.305 对上述3个相关因素与环孢素注射液C0/D′进行的初步多重逐步回归分析,排除存在共线性问题的因素,得到最佳模型。在最佳回归模型中,血红蛋白和CYP3A4*18B基因多态性对环孢素注射液C0/D′均有统计学意义(P值分别为0.000和0.024)。根据最佳回归模型得到的回归方程即环孢素注射液C0/D′的预测算法,方程式如下:
Y=0.695+0.008X1−0.112X2,
式中因变量Y为环孢素注射液C0/D′,因此,应用环孢素注射液的肾移植患者环孢素注射液维持剂量预测模型为:
D′(mg/m2)=C/(0.695+0.008X1−0.112X2)
公式中:X1代表用药前患者的血红蛋白含量,X2代表CYP3A4*18B基因多态性;CYP3A4 *1/*1型患者X2=0,CYP3A4*1/*18B型患者X2=1,CYP3A4*18B/*18B型患者X2=2;C为临床TDM目标谷浓度值。
-
糖皮质激素冲击治疗是肾移植术后发生急性排斥反应的一线治疗方案。然而,由于糖皮质激素冲击治疗不良反应多且发生率高,对于临床上仅发生或疑似发生亚临床或临界排斥反应的患者可能并不是最佳用药。蔡治涛等[2]收录在《2012年中国器官移植大会论文汇编》中的研究指出以静脉环孢素为基础的免疫抑制治疗方案是一种安全、有效的治疗手段。为探究环孢素注射液在临床上的疗效,本研究对两种治疗方案(环孢素注射液单药vs环孢素注射液和糖皮质激素联合用药)对肾移植术后发生亚临床或临界排斥反应的临床疗效进行研究,结果发现,环孢素注射液单药组在降低患者肌酐水平方面的疗效不及环孢素注射液和糖皮质激素联合用药组〔肌酐降低比例:68.8% vs 85.0%;肌酐降低幅度:19.27(22.84)% vs 45.25(50.38)%;P<0.01〕,但单药组具有更高的稳态谷浓度C0〔(189.50±38.56)ng/ml vs (172.87±44.27)ng/ml〕。该研究结果表明对于肾移植术后发生亚临床或临界排斥反应的患者,单用环孢素注射液仍然具有较好的临床疗效,且血药浓度处于比较安全的剂量范围,可能是比较适合该类患者的治疗方案。
大量研究表明,遗传因素如编码药物转运体、代谢酶、作用靶点和核受体的基因多态性[3]是引起药物在人体内的处置和药物反应的个体性差异的主要原因,其中CYP3A4*18B、CYP3A5*3、ABCB1(C1236T、G2677T/A、C3435T)、POR*28、PXR(C5705T、C39823T)以及NFKB1-94 ins/del ATTG对环孢素药动学的影响较为重要。
CYP3A4和CYP3A5是环孢素的主要代谢酶,其编码基因的多态性可能影响酶的表达,进而影响环孢素的药动学。研究表明,CYP3A4*18B(或称CYP3A4*1G,82266G>A;rs2242480),是与环孢素的体内代谢相关的SNPs之一,在中国人群中突变频率为29.5%[4],该位点的突变可能会提高CYP3A4的活性[5],增加环孢素的代谢从而降低其血药浓度。Li等[6]研究发现,携带CYP3A4*18B/*18B基因型患者的环孢素血药浓度显著低于*1/*1及*1/*18B基因型患者,但*1/*1与*1/*18B基因型患者间差异无统计学意义。本研究结果显示,*1/*1基因型患者的环孢素注射液的C0/D′显著高于*18B/* 18B基因型患者(P<0.05),但*1/*1与*1/*18B基因型患者间差异无统计学意义。该结果与文献报道一致。CYP3A5*3(6986A>G;rs776746)是另一个与环孢素的体内代谢相关的SNP,在中国人群中的突变频率高达75.4%[7]。当*1突变为*3时可导致mRNA剪接发生改变和蛋白质截断,使CYP3A5酶活性降低或消失,减少环孢素经CYP3A5酶的代谢,从而使环孢素血药浓度升高。目前该位点基因多态性与环孢素血药浓度相关性的研究结论尚不统一[8-11]。本研究结果显示,CYP3A5*3基因多态性均与环孢素注射液的C0/D′无相关性。出现这一结果可能主要是环孢素由CYP3A酶系中的CYP3A4代谢,其对环孢素的清除率是CYP3A5的2.3倍[12]所导致。
P糖蛋白(P-gp)在环孢素的转运中发挥着重要作用,静脉给药可被肝脏P-gp将药物转移至胆道使药物胆汁排泄增加,从而使血药浓度降低。P-gp是多重耐药基因ABCB1编码的产物,因此ABCB1基因多态性可影响P-gp的表达从而影响环孢素的血药浓度。本研究结果显示,ABCB1 C1236T、ABCB1 C3435T和ABCB1 G2677T/A基因多态性与环孢素注射液的C0/D′无相关性,分析原因可能是由于P-gp主要位于小肠黏膜成熟上皮细胞的刷状缘上,只有小部分分布于肝细胞,因此,由ABCB1基因多态性导致的P-gp表达和活性的改变对环孢素注射液血药浓度的影响较小。
孕烷X受体(PXR)编码基因多态性很可能会影响PXR表达或功能,进而影响CYP3A酶及P-gp的表达,从而影响环孢素的药动学。研究报道[13-14],C5705T(rs3814055)、C39823T(rs2276707)与CYP3A4表型、活性和含量有关,且二者在中国人群中的突变频率分别是38.06%和78.95%[15]。但截至目前,PXR基因多态性是否与环孢素药动学具有相关性尚存在争议。本研究结果显示,PXR C5705T及C39823T基因多态性与环孢素注射液血药浓度无相关性。
NFKB1-94 ins/del ATTG中ATTG 4个碱基的缺失(deletion)引起启动子活性的降低,进而降低NF-κB的表达和功能,较少炎症反应的发生,从而减少对环孢素代谢的影响。Zhang等[10]研究发现,NFKB1 -94ATTG插入突变的纯合子个体(-94ATTG ins/ins)环孢素的C0/D'显著高于缺失突变(-94ATTG del/del)的个体〔(75.9±32.9)vs.(55.1±15.1)ng/ml per mg/kg,P=0.026〕。然而,本研究却发现缺失突变纯合子患者的C0/D′高于插入突变纯合子患者,但差异无统计学意义(P>0.05)。出现此结果的原因可能是该基因对环孢素的血药浓度的影响主要是通过受NF-κB的炎症反应而实现的,属于间接作用,所以可能对环孢素注射液的C0/D′影响较小,在其他主要影响因素的作用下导致缺失突变纯合子患者的C0/D′高于插入突变纯合子患者。
POR*28在中国人群中突变率为29.6%[16]。有研究报道,POR*28能够增加CYP3A的活性,从而增加环孢素经CYP3A的代谢使得其血药浓度降低。Elens等[17]分析了174例肾移植患者的POR*28的基因型及环孢素的部分药动学参数,结果发现,POR*28/*28患者的C0/D'较POR*1/*28和*1/*1患者低15.1%(CI 95%=224.8~24.2%;P=0.03),但POR*1/*28型和POR*1/*1型间无显著性差异。然而,本研究结果显示,POR*28/*28基因型患者环孢素的C0/D′与POR*1/*28和*1/*1基因型患者间并无显著性差异。
本研究所建立的给药剂量模型,只纳入血红蛋白和CYP3A4*18B基因多态性两个因素,经检验模型是有意义的(F=23.85,P<0.001),但该模型只能解释25.3%(R2=0.253)的个体差异,可能存在其他的对环孢素注射液C0/D′具有显著影响的因素,如药物相互作用(保肝药物、胃黏膜保护药物以及活血药物等)、患者术后内环境变化等,这些都可能影响环孢素注射液的体内药动学过程。这也是本研究存在的不足之处。
综上所述,本研究首次研究了基因多态性与环孢素注射液血药浓度的相关性并发现只有CYP3A4*18B基因多态性与环孢素注射液C0/D′呈显著相关,而其他8个SNPs基因多态性对环孢素注射液C0/D′无影响。但由于目前国内外关于环孢素注射液的相关研究几乎空白,现有参考资料较少,本研究作为初探,其结果仍需进一步进行大样本量的临床验证,对模型进行优化。
Study on correlation between plasma concentration of cyclosporine injection and gene polymorphism in renal transplant patients
-
摘要:
目的 观察环孢素注射液在肾移植患者亚临床或临界排斥反应治疗中的临床疗效,研究与环孢素药动学相关的9个单核苷酸多态性(SNPs)和环孢素注射液剂量校正谷浓度(C0/D′)的相关性,建立环孢素注射液的个体化给药模型。 方法 收集并记录144例使用环孢素注射液的成年肾移植患者的血液样本及临床资料,对患者的CYP3A4*18B、CYP3A5*3、ABCB1(C1236T、G2677T/A、C3435T)、POR*28、PXR(C5705T、C39823T)以及NFKB1-94 ins/del ATTG等9个SNPs进行基因分型,比较不同基因型患者之间C0/D′的差异,并应用多重回归分析方法建立基于基因多态性的个体化给药方案。 结果 环孢素注射液可使68.8%发生亚临床或临界排斥反应的肾移植患者血肌酐水平得到改善,稳态血药浓度为(189.50±38.56)ng/ml。CYP3A4*18B基因多态性与环孢素注射液的C0/D′具有显著相关性,*1/*1基因型患者的C0/D′显著高于*18B/*18B基因型患者;CYP3A5*3、ABCB1 (C1236T、G2677T/A、C3435T)、PXR(C5705T、C39823T)、NFKB1-94 ins/del ATTG及POR*28基因多态性均与环孢素注射液的C0/D′无显著相关性。在最终回归模型中,血红蛋白和CYP3A4*18B基因多态性与环孢素注射液C0/D′显著相关。 结论 环孢素注射液可有效改善发生亚临床或临界排斥反应的肾移植患者的血肌酐水平;CYP3A4*18B基因多态性与环孢素注射液的C0/D′显著相关。 Abstract:Objective To investigate the clinical efficacy of cyclosporine injection in subclinical or critical treatment of renal transplant patients, and to establish an individualized dosage regimen of cyclosporine injection by studying the effects of nine single nucleotide polymorphisms related to the pharmacokinetics of cyclosporine on the dose-adjusted trough concentration (C0/D′) of cyclosporine injection. Methods Blood samples and clinical data of 144 adult renal transplant patients who used cyclosporine injection were collected and recorded, then, their genotypes of CYP3A4*18B, CYP3A5*3, ABCB1 (C1236T, G2677T/A, C3435T), POR*28, PXR (C5705T, C39823T) and NFKB1-94 ins/del ATTG were determined by Sequenom MassARRAY® SNP methods. Then, the discrepancies of cyclosporine injection’s C0/D′ among the patients with different genotypes was compared and an individualized dosage regimen based on gene polymorphism of cyclosporine injection was established by using multivariate regression analysis. Results Cyclosporine injection improved serum creatinine level by 68.8% in renal transplant patients with subclinical or critical rejection, and the steady-state plasma concentration was (189.50±38.56) ng/ml. The CYP3A4*18B gene polymorphism was significantly correlated to C0/D' of cyclosporine injection, and the C0/D' of patients with *1/*1 genotype was significantly higher than patients of *18B/*18B genotype; but CYP3A5*3, ABCB1(C1236T, G2677T/A, C3435T), PXR C5705T, PXR C39823T, NFKB1-94 ins/del ATTG and POR*28 gene polymorphisms were not significantly correlated to C0/D' of cyclosporine injection. In the final regression model, hemoglobin and CYP3A4*18B gene polymorphisms were significantly correlated to C0/D' of cyclosporine injection. Conclusion Cyclosporine injection can effectively improve the serum creatinine level in patients with subclinical or critical rejection; CYP3A4*18B gene polymorphism is significantly correlated to C0/D' of cyclosporine injection. -
Key words:
- renal transplant /
- cyclosporine injection /
- gene polymorphisms /
- CYP3A4 /
- individualized medication
-
氯新酮乳膏为解放军联勤保障部队第九八三医院的特色制剂,处方由酮康唑、哈西奈德和硫酸新霉素等组成,具有抗真菌、细菌感染及抗炎作用[1-2]。酮康唑为咪唑类抗真菌药,能降低真菌细胞色素 P450 的活性,妨碍真菌细胞膜合成类固醇,从而破坏真菌细胞膜结构,导致细胞内物质外泄;硫酸新霉素为氨基糖苷类抗生素;哈西奈德为皮质激素类药物,具有高效的抗炎作用。该药主要用于体癣、股癣、手足癣、皮肤念珠菌病、接触性皮炎、虫咬皮炎、神经性皮炎、湿疹及脓疱疮等皮肤病[2-4],在临床应用多年,疗效确切。为了很好的控制该药质量,我们对其质量标准进行了完善和修订,重新建立了硫酸新霉素的含量测定方法,现报道如下。
1. 仪器与试药
Agilent 1260高效液相色谱仪,OpenLAB CDS色谱工作站,ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱;酮康唑对照品(含量99.0%,批号:100296-201302)、哈西奈德对照品(含量99.2%,批号:100146-201504)、新霉素标准品(652单位/mg,批号:130309-201512)均购自中国食品药品检定所;甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。氯新酮乳膏[批号:20190620,20190624,20190628,规格:10 g/支,其中:酮康唑1%(g/g),哈西奈德0.1%(g/g),硫酸新霉素5 000单位/g]由本院制剂室提供。
2. 方法与结果
2.1 TLC鉴别
2.1.1 氯新酮乳膏中哈西奈德、酮康唑的TLC鉴别
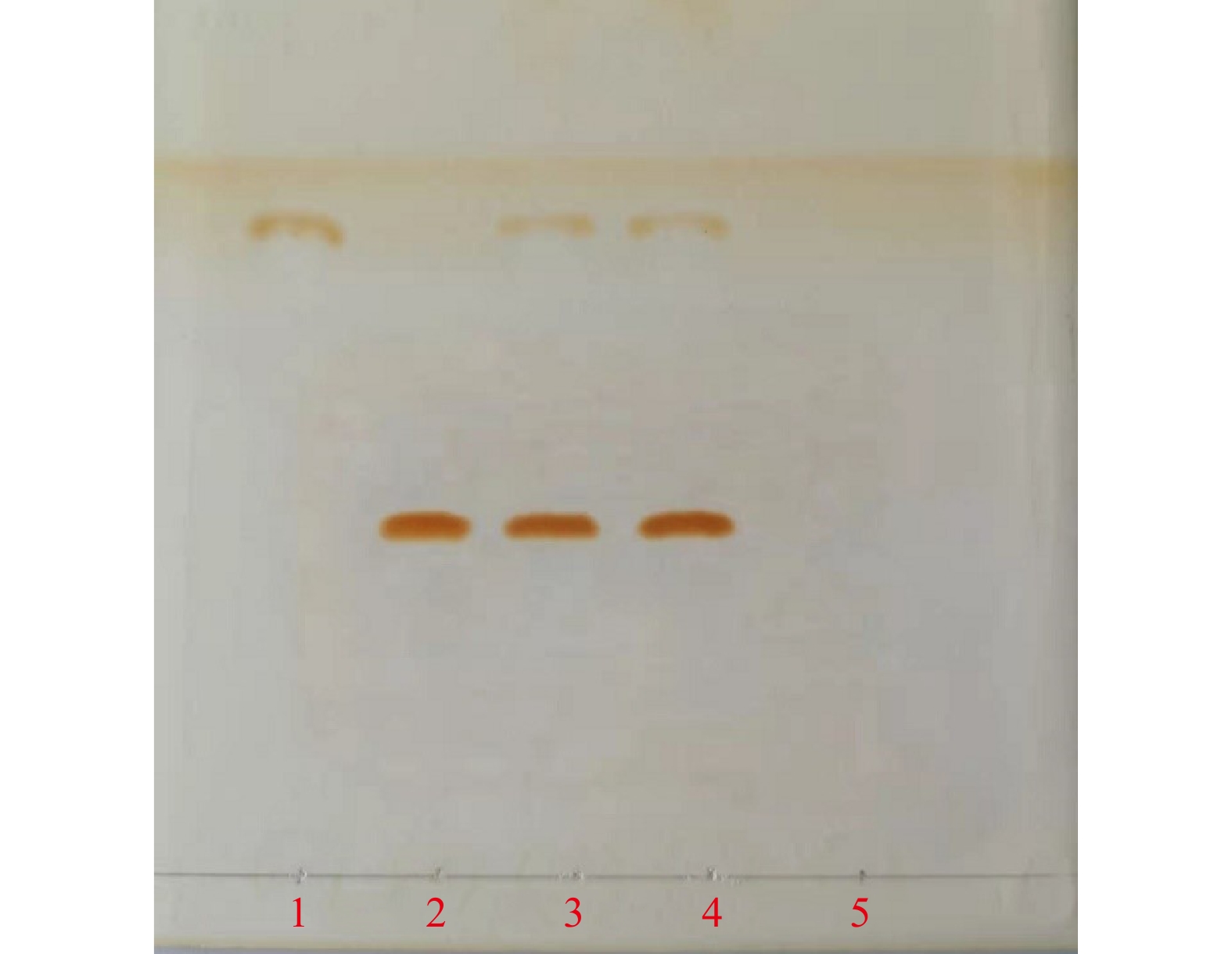
取本品1.0 g,加甲醇3 ml,搅拌2 min,分取甲醇溶液并过滤,于水浴上蒸发至干,向残渣加入甲醇0.5 ml,搅拌1 min,置离心管中,于冰水浴中冷却1 h,取出后迅速离心,取上清液作为供试品溶液。另取哈西奈德对照品1 mg、酮康唑10 mg分别加甲醇0.5 ml,振摇使溶解(必要时超声),作为对照品溶液。照薄层色谱法(《中国药典》2020版四部通则0502)试验,吸取供试品溶液、对照品溶液各10 µl,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇(3∶1∶0.5)为展开剂,展开,以碘蒸汽显色,供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,阴性样品未见干扰(见图1)。
2.1.2 氯新酮乳膏中硫酸新霉素的TLC鉴别
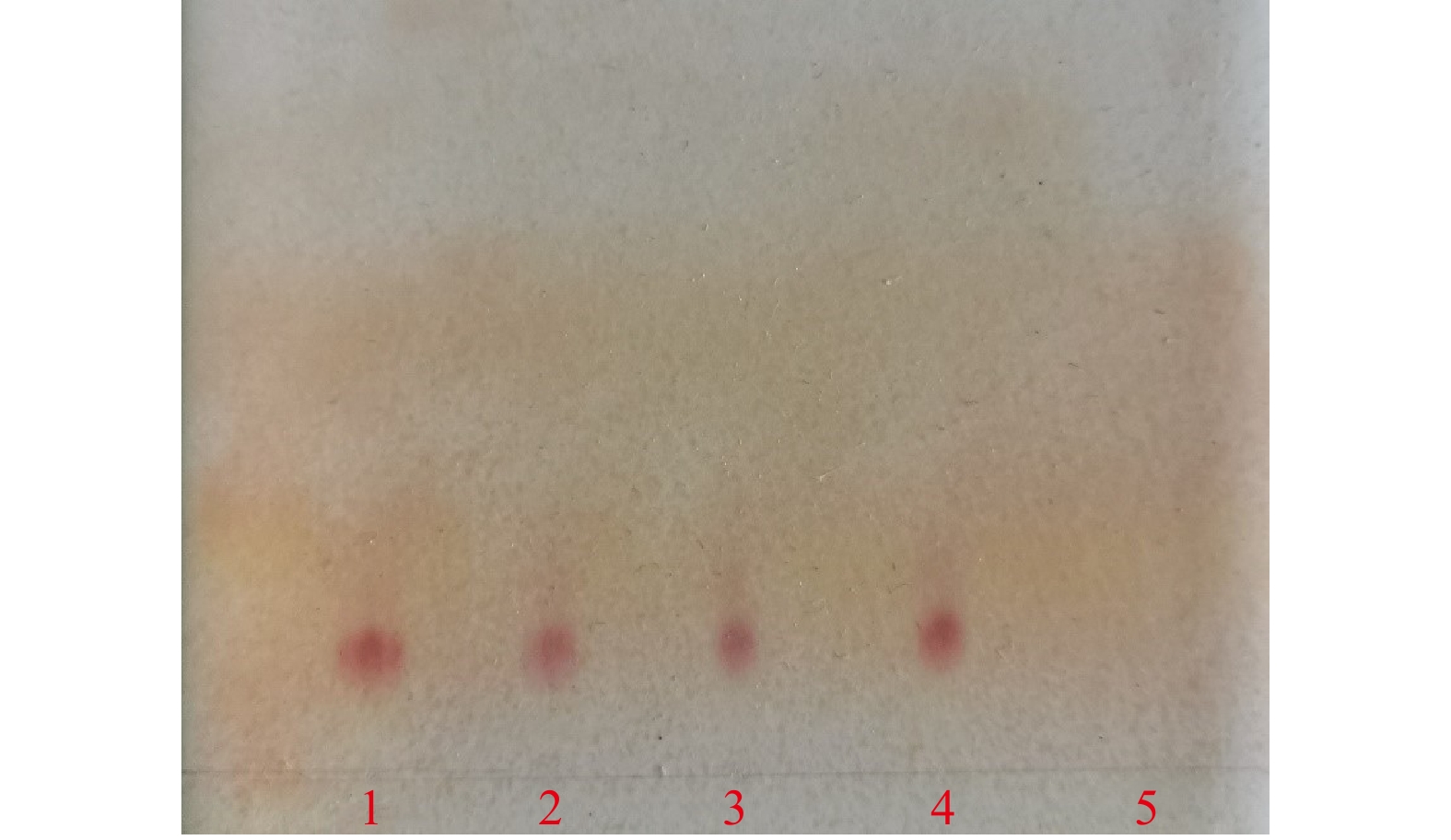
取本品约1.5 g(相当于硫酸新霉素7 500单位),置具塞离心管中,加三氯甲烷10 ml与水15 ml,强烈振摇,离心,取上层清液,作为供试品溶液。另取硫酸新霉素标准品,加水制成每1 ml约含2 mg的溶液作为标准品溶液。照薄层色谱法(《中国药典》2020版四部通则0502)试验,吸取上述两种溶液各10 µl,分别点于同一硅胶G薄层板上,以甲醇-三氯甲烷-氨水(13.5 mol/L)(60∶20∶40)为展开剂,展开,晾干,喷以1%茚三酮正丁醇溶液,在105 ℃加热2 min,供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点,阴性样品未见干扰(见图2)。
2.2 含量测定
2.2.1 溶液的配制
2.2.1.1 对照品溶液的制备
哈西奈德和酮康唑对照品溶液:精密称取酮康唑对照品49.98 mg,哈西奈德对照品10.02 mg,置25 ml量瓶中,用甲醇稀释至刻度,制备对照品溶液(酮康唑为1.999 mg/ml,哈西奈德为0.400 8 mg/ml)。
新霉素标准品溶液:精密称取新霉素标准品约250.08 mg于25 ml的量瓶中,加水适量溶解并定容至刻度,摇匀,即为新霉素储备液10.00 mg/ml,相当于6 520单位/ml。精密量取储备液0.5、1.0、2.0、3.0、5.0、10.0 ml,置25 ml量瓶中,用水稀释至刻度,摇匀,获得浓度分别为130.4、260.8、521.6、782.4、1 304、2 608单位/ml的标准品溶液。
2.2.1.2 供试品溶液的制备
哈西奈德和酮康唑供试品:取本品约2.5 g,精密称定,置50 ml量瓶中,加90%甲醇30 ml至80 ℃水浴中加热2 min,振摇使溶解,放冷至室温,加水8.3 ml,再加90%甲醇至刻度,摇匀,于冰水浴中冷却2 h,取出后迅速滤过,弃去初滤液,取续滤液,离心,放至室温,即得。
硫酸新霉素供试品:精密称取本品约7.0 g于锥形瓶中,加三氯甲烷10 ml,振摇使基质分散,加3%盐水10 ml振摇后转移至100 ml分液漏斗中,强力振摇后,静置分层,分取水层置25 ml量瓶中,同法用水提取2次,每次5 ml,合并水层,用水定容至刻度,摇匀,取适量于离心管中,4 000 r/min离心15 min,取上清液,即得。
2.2.1.3 阴性对照溶液的制备
酮康唑和哈西奈德的阴性对照溶液:按照样品制备方法制备缺酮康唑和哈西奈德乳膏,按照2.2.1.2方法制备阴性对照溶液。
硫酸新霉素的阴性对照溶液:按照样品制备方法制备缺硫酸新霉素的乳膏,按照2.2.1.2方法制备阴性对照溶液。
2.2.2 酮康唑和哈西奈德的含量测定
2.2.2.1 色谱条件
色谱条件与系统适用性试验:ZORBAX SB-C18(4.6 mm×250 mm,5 μm)色谱柱;以甲醇-磷酸盐缓冲液(pH=7.40)75∶25为流动相,检测波长235 nm,流速1.0 ml/min。
2.2.2.2 专属性试验
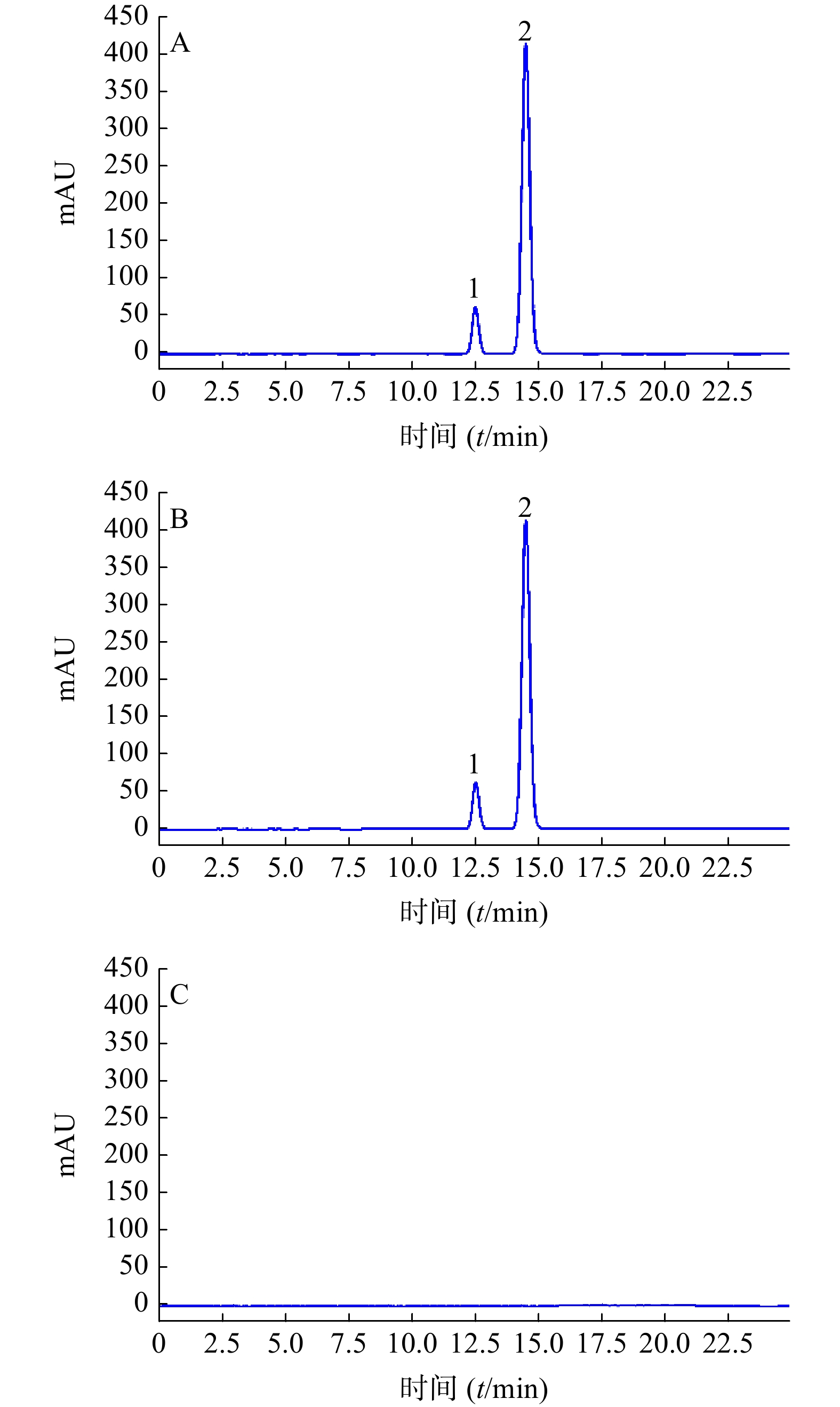
分别精密吸取对照品溶液、供试品溶液及阴性对照溶液各10 μl,注入高效液相色谱仪,结果见图3,供试品溶液中特征峰与对照品峰具有相同保留时间,阴性对照对应位置无干扰。
2.2.2.3 标准曲线的制备
分别精密吸取对照品溶液1、2、4、5、6、8、10和20 μl,依次进样,测定峰面积,以峰面积(Y)为纵坐标,浓度(X)为横坐标,绘制标准曲线,并进行线性回归得,酮康唑:Y=78 309X−180.73,r=0.999 9(n=8);哈西奈德: Y=18 716X−50.475,r=0.999 9(n=8)。结果表明,酮康唑在1.999~39.98 μg的范围内, 哈西奈德在0.400 8~8.016 μg的范围内呈良好的线性关系。
2.2.2.4 精密度试验
精密吸取同一混合对照品溶液10 μl,按2.2.2.1项下色谱条件连续进样6次,按峰面积计算,结果哈西奈德和酮康唑的日内精密度RSD值分别为1.1%和0.7%(n=6);连续进样5 d,记录峰面积,得哈西奈德和酮康唑的日间精密度RSD值为1.2%和0.8%(n=5),表明仪器精密度良好。
2.2.2.5 稳定性试验
取同一批样品溶液(批号:20190620),分别于0、1、2、3、4、5、7和10 h测定,记录峰面积,哈西奈德和酮康唑的RSD为2.1%和1.8%(n=6),表明供试品溶液在10 h内稳定。
2.2.2.6 重复性试验
取同一批样品6份(批号:20190620),按供试品溶液制备方法项下制备,依法测定,记录色谱图并计算含量。酮康唑和哈西奈德的平均标示百分含量分别为98.21%、103.0%,RSD为1.3%和1.1%,表明方法的重复性良好。
2.2.2.7 回收率试验
精密称取9份不含酮康唑和哈西奈德的阴性乳膏样品2.5 g,分别按照标示量的80%、100%、120%加入酮康唑(约20、25、30 mg)和哈西奈德(约2、2.5、3 mg)对照品适量,测定含量,计算样品回收率。结果酮康唑的平均回收率为97.75%,RSD为0.77%(n=9),哈西奈德的平均回收率为97.57%,RSD为0.84%(n=9),具体见表1。
表 1 氯新酮乳膏中酮康唑和哈西奈德回收率试验结果(n=9)待测物 样品量
(g)加入量
(μg/ml)测得量
(μg/ml)回收率
(%)平均值
(%)RSD
(%)酮康唑 2.501 2 399.6 395.6 99.00 97.75 0.77 2.498 2 399.6 392.2 98.15 2.483 3 399.6 391.5 97.97 2.510 6 503.1 486.1 96.62 2.508 7 503.1 489.6 97.32 2.496 4 503.1 488.8 97.16 2.501 2 591.3 578.4 97.82 2.486 9 591.3 583.2 98.63 2.993 7 591.3 574.3 97.12 哈西奈德 2.501 2 40.12 38.78 96.66 97.57 0.84 2.498 2 40.12 39.12 97.51 2.483 3 40.12 39.15 97.58 2.510 6 49.53 48.78 98.49 2.508 7 49.53 48.36 97.64 2.496 4 49.53 49.12 99.17 2.501 2 59.77 57.97 96.99 2.486 9 59.77 57.74 96.60 2.993 7 59.77 58.26 97.47 2.2.2.8 含量测定
3批样品(20190620、20190624、20190628),按供试品溶液制备方法项下制备,依法测定,记录色谱图。结果3批样品哈西奈德的标示量百分含量分别为102.2%、104.5%、99.8%(n=3),酮康唑的标示量百分含量分别为99.2%、98.6%、102.5%(n=3)。
2.2.3 硫酸新霉素的含量测定
2.2.3.1 方法专属性
用旋光法对阴性对照溶液进行测定,旋光度为0,表明样品中其他成分和辅料不干扰硫酸新霉素的测定。
2.2.3.2 线性考察
取不同浓度的标准品溶液分别测定,以旋光度(Y)为纵坐标,浓度(单位/ml)为横坐标(X),绘制标准曲线,并进行线性回归,得:Y = 8.60E-05 X,r=0.999 8(n=6)。结果表明,新霉素在130.4~2 608单位/ml的范围内呈良好的线性关系。
2.2.3.3 精密度试验
对同一标准品溶液连续测定6次,旋光度值分别为0.109 6、0.109 8、0.109 2、0.109 5、0.109 5、0.109 8,RSD为1.1%(n=6),表明方法精密度良好。
2.2.3.4 重复性试验
取同一批样品6份(批号:20190620),按供试品溶液制备方法项下制备,依法测定。计算得到硫酸新霉素平均含量为4 525.7单位/g,RSD为1.6%(n=6),表明方法重复性良好。
2.2.3.5 稳定性试验
取同一批样品溶液(批号:20190620),分别于0、0.5、1、1.5、2、4、6 h测定,计算得到旋光度的RSD为1.1%(n=7),表明在6 h内方法稳定性良好。
2.2.3.6 加样回收率
取氯新酮乳膏(批号:20190620)约3.5 g,共9份,分别加入新霉素标准品20、25、30 mg,每个浓度制备3份,按照规定制备样品溶液,以标准曲线计算得到的新霉素加标量和实际加入新霉素的量的比值作为回收率,结果见表2。测得百分回收率平均值为98.8%,RSD为2.6%。表明该方法准确率可达到要求。
表 2 新霉素回收率试验结果(n=9)序号 样品重(g) 已知量(单位) 加入量
(单位)测得量
(单位)回收率
(%)平均值
(%)RSD
(%)1 3.549 16 628.6 13 437.7 29 644.1 96.9 98.8 2.6 2 3.526 16 520.9 13 659.4 30 504.0 102.3 3 3.519 16 488.1 13 059.6 28 987.1 97.4 4 3.498 16 389.7 16 586.9 32 649.1 98.0 5 3.618 16 951.9 16 860.7 33 412.4 97.6 6 3.529 16 534.9 16 345.6 32 639.4 98.5 7 3.511 16 450.6 19 644.8 35 547.8 97.2 8 3.546 16 614.6 20 114.2 36 040.6 97.2 9 3.489 16 347.5 19 696.9 36 736.3 104.3 2.2.3.7 含量测定
3批样品,按供试品溶液制备方法项下制备,依法测定,结果见表3。
表 3 3批样品硫酸新霉素含量测定结果(n=3)批号 含量(单位/g) 标示量(%) 20190620 4 685.4 93.7 20190624 4 617.1 95.3 20190628 4 604.3 92.1 3. 讨论
3.1 酮康唑、哈西奈德和硫酸新霉素鉴别方法的建立
参照药典及文献[3-4],对处方中的酮康唑、哈西奈德和硫酸新霉素分别进行了TLC鉴别研究,对样品的前处理方法、展开剂的比例等因素分别进行了考察,确立了最终的TLC方法。结果显示,斑点显色清晰稳定,专属性强,准确性好,基质和溶剂均无干扰,可用于氯新酮乳膏鉴别项下质量控制。
3.2 酮康唑、哈西奈德含量测定方法的建立
参考药典和文献[5-9],经紫外扫描,酮康唑和哈西奈德在235 nm处均有最大吸收,故选235 nm作为检测波长。酮康唑和哈西奈德均不溶于水,溶于甲醇、氯仿等,本实验采用甲醇提取,水浴加热,冰浴冷却的方法,可有效除去乳膏剂中的杂质并提取完全。对于流动相的选择,考察了甲醇-水和甲醇-磷酸盐缓冲液为流动相,发现选用甲醇-磷酸盐缓冲液(pH=7.40)75∶25为流动相时,峰形较好,无拖尾。流动相pH值对于两峰的分离度影响较大,如果处理不好会造成峰的重叠,经研究发现甲醇-磷酸盐缓冲液(pH=7.40)为流动相时,可以达到分离效果,且峰形较好。
3.3 硫酸新霉素含量测定方法的摸索和建立
据文献报道,硫酸新霉素的测定方法主要有微生物法、免疫分析法、色谱法、分光光度法、荧光分析法、电化学分析法、共振散射色谱法和比色法等[9-15]。药典采用微生物鉴定法,该法操作繁琐,时间较长,重现性很差。硫酸新霉素在紫外区无特征吸收,采用色谱法和分光光度法时,需先进行衍生化处理,但衍生化试剂存在吸收峰,干扰严重,很难分离测定,而HPLC-ELSD法对检测器要求较高。硫酸新霉素具有旋光性,采用旋光法对硫酸新霉素含量进行测定,简单灵便。采用旋光法测定乳膏剂时,将待测药品从基质中提取出来,且保证其他药物无干扰是关键。实验研究发现,在提取过程中加入少量的氯仿溶液强力振摇破乳,使乳膏基质充分分散,有利于药物提取完全;同时,利用三种药物在水中溶解度的区别,硫酸新霉素极易溶于水,酮康唑和哈西奈德几乎不溶于水,采用水提取,4 000 r/min离心15 min,进行样品溶液的制备,可将硫酸新霉素充分分离提取。用旋光法对缺硫酸新霉素的阴性样品溶液进行测定,旋光度为0,验证了样品中的其他成分对硫酸新霉素的测定无干扰,可达到检测目的。经方法学考察,本方法操作简单、结果准确、重复性好、专属性强,可作为氯新酮乳膏中硫酸新霉素的质量控制方法。分别对3批样品的含量进行了测定,3批样品均能达到要求,但含量相对偏低,考虑可能因素是提取过程造成部分损失,以及硫酸新霉素的稳定性等因素造成,需要我们进一步考察研究。
-
表 1 研究对象的一般临床资料(n=144)
指标 统计描述 百分率(%) 年龄(岁) 37.5(15) 性别(男/女,例) 109/35 75.7/24.3 体重(kg) 59.46±10.47 体表面积(m2) 1.65(0.28) BMI(kg/ m2) 21.21±3.14 血红蛋白(g/L) 101.56±24.05 血细胞比容(%) 30.84±7.16 供体类型(尸体/亲属,例) 122/22 84.7/15.3 环孢素使用天数(d) 11(7) 是否激素冲击(是/否,例) 80/64 55.6/44.4 血肌酐是否降低(是/否,例) 112/32 77.7/22.3 注:数据以( $\bar x \pm s$ )或Me(IQR)表示表 2 单独用药与联合用药方案的血肌酐降低幅度差异
用药方案 例数及比例(N/%) 肌酐降低例数及比例(N/%) C0(ng/ml) 肌酐降低幅度(%) 环孢素注射液 64(44.4) 44(68.8) 189.50±38.56 19.27(22.84) 环孢素注射液+糖皮质激素 80(55.6) 68(85.0) 172.87±44.27* 45.25(50.38)** 注:*P<0.05,**P<0.01,与单用环孢素注射液比较 表 3 肾移植患者中9个SNPs基因分型以及等位基因频率(n=144)
SNP(ID) 基因型频率(%) 等位基因频率(%) χ2 P 野生/野生 野生/突变 突变/突变 野生 突变 CYP3A4*18B GG(*1*1) GA(*1*18B) AA(*18B*18B) G A 0.046 0.830 rs2242480 80(55.6%) 54(37.5%) 10(6.9%) 74.3% 25.7% CYP3A5*3 AA(*1*1) AG(*1*3) GG(*3*3) A G 0.005 0.945 rs776746 11(7.6%) 57(39.6%) 76(52.8%) 27.4% 72.6% ABCB1 C1236T CC CT TT C T 0.985 0.321 rs1128503 14(9.7%) 70(48.6%) 60(41.7%) 34.0% 66.0% ABCB1G 2677T/A GG GT+GA TT+TA+AA G T+A 0.070 0.791 rs2032582 23(16.0%) 71(49.3%) 50(34.7%) 40.6% 59.4% ABCB1 C3435T CC CT TT C T 1.249 0.264 rs1045642 54(37.5%) 63(43.8%) 27(18.7%) 59.4% 40.6% PXR C5705T CC CT TT C T 2.918 0.088 rs3814055 87(60.4%) 45(31.3%) 12(8.3%) 76.0% 24.0% PXR C39823T CC CT TT C T 2.250 0.134 rs2276707 40(27.8%) 80(55.6%) 24(16.6%) 55.6% 44.4% NFKB1-94 ins /delATTG II ① ID ② DD ③ I D 0.036 0.849 rs28362491 45(31.3%) 72(50.0%) 27(18.7%) 56.3% 43.7% POR*28 CC CT TT C T 2.193 0.139 rs1057868 26(40.6%) 25(39.1%) 13(20.3%) 60.2% 39.8% 注:①. 指插入突变纯合子;②. 指插入突变杂合子;③. 指缺失突变纯合子。 表 4 各位点不同基因型对环孢素C0/D′的影响
位点(ID) 基因型 例数/占比[n,(%)] C0/D′[(ng/ml)/(mg/kg)] P CYP3A4*18B
rs2242480*1/*1 80(55.6) 1.52±0.42 0.044 *1/*18B 54(37.5) 1.42±0.42 *18B/*18B 10(6.9) 1.19±0.26* CYP3A5*3
rs776746*1/*1 11(7.6) 1.36±0.46 0.647 *1/*3 57(39.6) 1.45±0.37 *3/*3 76(52.8) 1.48±0.45 ABCB1 C1236T
rs1128503CC 14(9.70) 1.43±0.48 0.486 CT 70(48.6) 1.50±0.41 TT 60(41.7) 1.41±0.42 ABCB1 G2677T/A
rs2032582GG 23(16.0) 1.40±0.41 0.674 GA+GT 71(49.3) 1.49±0.40 AA+AT+TT 50(34.7) 1.44±0.46 ABCB1 C3435T
rs1045642CC 54(37.5) 1.46±0.41 0.596 CT 63(43.8) 1.43±0.43 TT 27(18.7) 1.53±0.43 PXR C5705T
rs3814055CC 87(60.4) 1.43±0.41 0.442 CT 45(31.3) 1.48±0.45 TT 12(8.30) 1.58±0.36 PXR C39823T
rs2276707CC 40(27.8) 1.55±0.49 0.262 CT 80(55.6) 1.43±0.40 TT 24(16.6) 1.38±0.35 NFKB1(-94 ins/del ATTG)
rs28362491II 45(31.3) 1.49±0.46 0.300 ID 72(50.0) 1.41±0.41 DD 27(19.7) 1.54±0.39 POR*28
rs1057868*1/*1 26(40.6) 1.63±0.45 0.491 *1/*28 25(39.1) 1.48±0.43 *28/*28 13(20.3) 1.54±0.38 注:*P<0.05,与*1/*1型比较。 表 5 各观察指标与环孢素注射液C0/D′的相关性
指标 相关系数(r) 决定系数(R2) P 年龄 0.114 0.013 0.175 性别 −0.071 0.005 0.400 体重 0.140 0.020 0.094 血红蛋白 0.463 0.214 0.000* 血细胞比容 0.454 0.206 0.000* 供体类型 0.112 0.013 0.180 CYP3A4*18B −0.176 0.031 0.035 CYP3A5*3 0.043 0.002 0.610 ABCB1 C1236T −0.056 0.003 0.504 ABCB1 G2677T/A 0.006 0.000 0.943 ABCB1 C3435T 0.022 0.000 0.798 PXR C5705T 0.100 0.010 0.235 PXR C39823T −0.136 0.018 0.103 NFKB1(-94 ins/del ATTG) 0.003 0.000 0.971 POR*28 −0.130 0.017 0.305 -
[1] SAINT-MARCOUX F, MARQUET P, JACQZ-AIGRAIN E, et al. Patient characteristics influencing ciclosporin pharmacokinetics and accurate Bayesian estimation of ciclosporin exposure in heart, lung and kidney transplant patients[J]. Clin Pharmacokinet,2006,45(9):905-922. doi: 10.2165/00003088-200645090-00003 [2] 蔡治涛, 刘宏, 朱方强, 等. 静脉用环孢素在肾移植中的应用[C]//2012中国器官移植大会论文集. 厦门, 2012: 99. [3] 胡永芳, 周宏灏. CYP3A4, CYP3A5和MDR1基因多态性对环孢素处置的影响[J]. 中国药理学通报, 2005, 21(3):257-261. doi: 10.3321/j.issn:1001-1978.2005.03.001 [4] 侯明明, 侯颖, 宋洪涛, 等. 肾移植患者CYP3A4基因多态性对他克莫司疗效和不良反应的影响[J]. 中国药房, 2010, 21(26):2427-2429. [5] QIU X Y, JIAO Z, ZHANG M, et al. Association of MDR1, CYP3A4*18B, and CYP3A5*3 polymorphisms with cyclosporine pharmacokinetics in Chinese renal transplant recipients[J]. Eur J Clin Pharmacol,2008,64(11):1069-1084. doi: 10.1007/s00228-008-0520-8 [6] LI D Y, TENG R C, ZHU H J, et al. CYP3A4/5 polymorphisms affect the blood level of cyclosporine and tacrolimus in Chinese renal transplant recipients[J]. Int J Clin Pharmacol Ther,2013,51(6):466-474. doi: 10.5414/CP201836 [7] 侯明明, 宋洪涛, 王庆华, 等. 肾移植患者CYP3A5*3基因多态性对他克莫司血药浓度/剂量比和疗效的影响[J]. 中国医院药学杂志, 2010, 30(4):313-316. [8] 谢宇, 宋洪涛, 王庆华, 等. CYP3A5* 3和MDR1 G2677T/A基因多态性对肾移植患者环孢素A血药浓度及疗效的影响[J]. 中国药学杂志, 2011, 46(20):1591-1596. [9] SUN B, GUO Y K, GAO J W, et al. Influence of CYP3A and ABCB1 polymorphisms on cyclosporine concentrations in renal transplant recipients[J]. Pharmacogenomics,2017,18(16):1503-1513. doi: 10.2217/pgs-2017-0127 [10] ZHANG Y, LI J L, FU Q, et al. Associations of ABCB1, NFKB1, CYP3A, and NR1I2 polymorphisms with cyclosporine trough concentrations in Chinese renal transplant recipients[J]. Acta Pharmacol Sin,2013,34(4):555-560. doi: 10.1038/aps.2012.200 [11] GARCÍA M, MACÍAS R M, CUBERO J J, et al. ABCB1 polymorphisms are associated with cyclosporine-induced nephroto-xicity and gingival hyperplasia in renal transplant recipients[J]. Eur J Clin Pharmacol,2013,69(3):385-393. doi: 10.1007/s00228-012-1355-x [12] DAI Y, IWANAGA K, LIN Y S, et al. In vitro metabolism of cyclosporine A by human kidney CYP3A5[J]. Biochem Pharmacol,2004,68(9):1889-1902. doi: 10.1016/j.bcp.2004.07.012 [13] LAMBA J, LAMBA V, STROM S, et al. Novel single nucleotide polymorphisms in the promoter and intron 1 of human pregnane X receptor/NR1I2 and their association with CYP3A4 expression[J]. Drug Metab Dispos,2008,36(1):169-181. doi: 10.1124/dmd.107.016600 [14] WANG X D, DENG X Y, CHEN J, et al. Single nucleotide polymorphisms of the pregnane x receptor gene in Han Chinese and a comparison with other ethnic populations[J]. Pharmacology,2008,81(4):350-354. doi: 10.1159/000123687 [15] 陈启晨, 胡正威, 王威, 等. 孕烷X受体基因多态性与中国肾移植受者他克莫司浓度/剂量比值的相关性[J]. 中国临床药理学杂志, 2016, 32(17):1557-1560. [16] HUANG N W, PANDEY A V, AGRAWAL V, et al. Diversity and function of mutations in p450 oxidoreductase in patients with Antley-Bixler syndrome and disordered steroidoge-nesis[J]. Am J Hum Genet,2005,76(5):729-749. doi: 10.1086/429417 [17] ELENS L, HESSELINK D A, BOUAMAR R, et al. Impact of POR*28 on the pharmacokinetics of tacrolimus and cyclospo-rine A in renal transplant patients[J]. Ther Drug Monit,2014,36(1):71-79. -





 下载:
下载:

 下载:
下载: 


