-
马齿苋(Portulaca oleracea L.)是一种药食两用植物,味酸、性寒,具有清热解毒、凉血消肿之功效。现代药理研究证实其有抗衰老、降血糖、降血脂、抗动脉粥样硬化,以及保肝护肝等方面的药理活性[1-2]。目前对马齿苋保肝护肝的有效成分还不甚了解。本研究进一步明确马齿苋提取物对四氯化碳致小鼠急性肝损伤具有保护作用,并通过超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF/MS)技术分析马齿苋提取物的主要成分,采用电喷雾电离源正离子模式和负离子模式对色谱流出物进行检测,通过高分辨质谱分析结合相关文献鉴定出苹果酸、柠檬酸、亮氨酸、异亮氨酸、腺苷、琥珀酸、染料木素、酪氨酸、苯丙氨酸等15种主要成分。
-
80只ICR雄性小鼠,体重18~20 g。来源:海军军医大学实验动物中心购买于上海斯莱克实验动物有限公司[生产许可SCXK(沪)2017-005,使用许可SYXK(沪)2017-0004]。
-
马齿苋干药材(上海雷允上中药饮片厂,产品批号:2012110235);CCl4溶液、乙醇、NaOH(分析纯,国药集团化学试剂有限公司);橄榄油(益海嘉里食品营销有限公司);甲醇、乙腈(色谱纯,美国默克公司);甲酸(色谱纯,美国Sigma-Aldrich公司);实验用水(屈臣氏蒸馏水);Agilent 1290 Infinity型超高效液相色谱仪、Agilent 6538 UHD、Accurate-Mass Q-TOF/MS(美国安捷伦公司)。
-
马齿苋药材加15倍80%乙醇,煎煮1 h。提取液滤过,滤液减压浓缩至无醇味,加水调节浓度为2 g/ml。以10% NaOH溶液调节pH至中性,记为A液。5000 r/min,离心10 min,上清液记为B液,沉淀记为C液。A、B液分别减压浓缩至半干状态,与C液分别转移至60 ℃真空干燥,粉碎过120目筛,即得马齿苋全草、上清、沉淀提取物。用去离子水分别配制不同浓度的马齿苋提取物混悬液,超声过夜,4 ℃储存,备用。
-
ICR雄性小鼠80只,根据体重随机分为8组,分别为对照组、CCl4急性化学性肝损伤模型组(模型组)、全草提取物低剂量(12.5 mg)组(全草低剂量组)、全草提取物高剂量(50 mg)组(全草高剂量组)、上清提取物低剂量(12.5 mg)组(上清低剂量组)、上清提取物高剂量(50 mg)组(上清高剂量组)、沉淀提取物低剂量(12.5 mg)组(沉淀低剂量组)和沉淀提取物高剂量(50 mg)组(沉淀高剂量组)。适应性喂养一周后,对照组和模型组小鼠分别经口灌胃0.5 ml去离子水,3种提取物的低剂量组和高剂量组小鼠分别以0.5 ml对应浓度的马齿苋提取物混悬液连续灌胃7 d,并监测体重。7 d后,模型组、马齿苋提取物干预组小鼠按照3 ml/(kg·BW)分别腹腔注射10% CCl4橄榄油溶液,对照组小鼠注射等量橄榄油。实验期禁食不禁水,16 h后,腹腔注射10%水合氯醛麻醉,摘眼球取血,将血液2 000 r/min离心15 min得血清,于长海医院检验科检测谷丙转氨酶(ALT)、谷草转氨酶(AST),ELISA试剂盒检测血清IL-6。
-
首先,检索马齿苋及其相关种属药材化学成分相关的文献,根据文献报道,收集马齿苋中可能的化学成分信息;其次,通过Agilent提供的“Formula-Database-Generator”软件建立马齿苋中已知化学成分的数据库。
-
取马齿苋适量,加入5 ml 80%甲醇超声15 min,13000 r/min离心10 min,取上清液供超高效液相色谱仪检测用。
-
色谱柱:Waters XSELECTTM HSS T3(100 mm×2.1 mm,2.5 μm);流动相:0.1%甲酸(A)和0.1%甲酸乙腈(B)流动相体系。梯度洗脱程序如下:0~2 min,5%B;2~13 min,5%→95%B;13~15 min,95%B;分析时间15 min;流速为0.4 ml/min,进样量为3 μl。
-
离子源:电喷雾离子化(ESI)正、负离子模式;雾化气压力:50 psi;干燥气流速:11 L/min;干燥气温度:350 ºC;毛细管电压:4000V(+)/3500V(−);去簇电压:120 V;Mass扫描范围:m/z 50~1000。
-
采用SPSS 20.0统计分析软件处理,结果以均值 ± 标准差(
$ \bar x \pm s $ )表示,多组间比较采用单向方差分析检验,组间两两比较,方差齐时采用LSD法,方差不齐时采用Dunnett's T3法,P<0.05为差异有统计学意义。 -
各组小鼠体重均呈上升趋势,各组体重差异无统计学意义(见图1),初步说明马齿苋提取物对小鼠生长没有明显的毒副作用。
-
由图2可见,与对照组相比,CCl4急性化学性肝损伤模型组血清ALT、AST水平显著升高(P<0.001),说明造模成功。与模型组相比,全草高剂量组小鼠血清AST、ALT水平显著降低(P<0.05,P<0.01);沉淀高剂量组小鼠血清ALT显著降低(P<0.05),AST水平有降低趋势但不具有统计学意义。
-
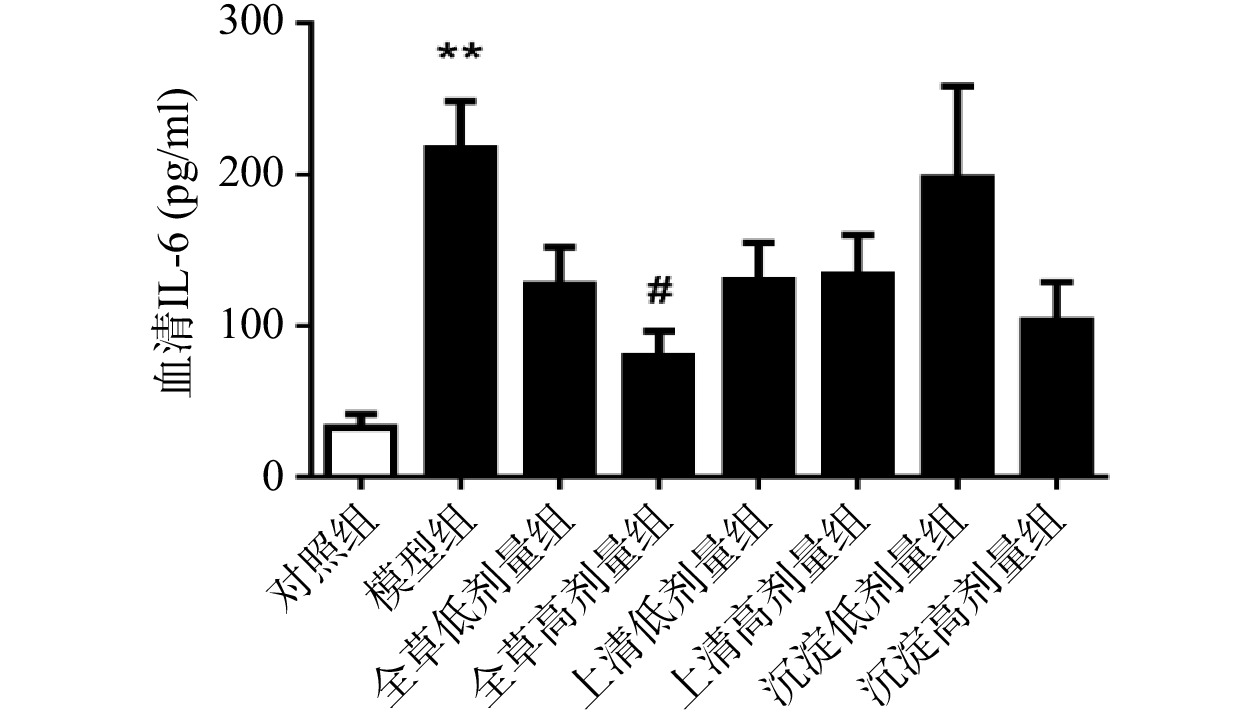
由图3可见,与对照组相比,CCl4急性化学性肝损伤模型组血清IL-6水平显著升高(P<0.01)。与模型组相比,全草高剂量组小鼠血清IL-6水平显著降低(P<0.05),沉淀高剂量组小鼠血清IL-6水平有降低趋势但不具有统计学意义。
-
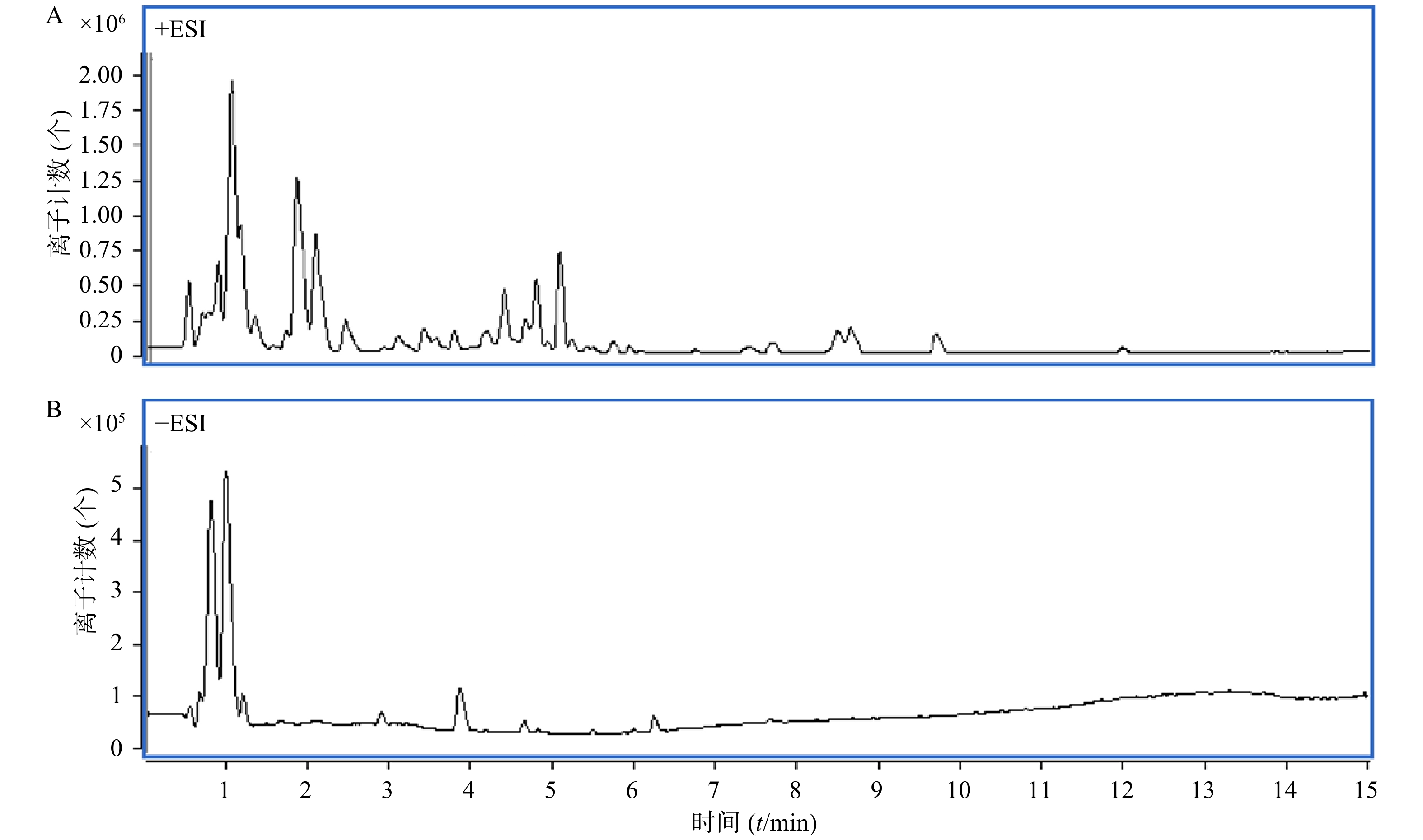
取马齿苋样品溶液,按照“1.4.3”项下进样分析,全扫描总离子流图如图4所示。
-
将“Formula-Database-Generator”软件建立的马齿苋已知化学成分的数据库导入“Masshunter Qualitative Analysis”软件系统,依据数据库对马齿苋提取物总离子流质谱图进行鉴定和确证,将检索到的化学成分信息按照保留时间、质荷比、加合离子情况等进行分类整理。并将化合物按其质荷比在原质谱数据中进行反向提取,对提取到的质谱信息进行质量准确度的验证并根据同位素峰比例等信息进行元素组成分析。推测出15种化合物为马齿苋80%乙醇提取物的主要成分,按照保留时间顺序依次为:苹果酸、柠檬酸、亮氨酸、异亮氨酸、腺苷、琥珀酸、染料木素、酪氨酸、苯丙氨酸、佛手苷内酯、金莲花碱、6,7-二羟基香豆素、芳樟醇、金色酰胺醇/橙黄胡椒酰胺、金色酰胺醇酯/咸南藤酰胺乙酸酯(见表1),另外还有多糖、黄酮等化学成分。
表 1 马齿苋提取物UPLC-Q-TOF/MS分析结果
时间
(tR/min)分子式 离子峰归属 质荷比 偏差 化合物 理论值 实测值 0.847 C4H6O5 [M-H]- 133.0142 133.0147 −0.49 苹果酸[3-4] 1.019 C6H8O7 [M-H]- 191.0197 191.0198 −0.62 柠檬酸[3] 1.097 C6H13NO2 [M+H]+ 132.1019 132.1014 3.91 亮氨酸[5] 1.203 C6H13NO2 [M+H]+ 132.1019 132.1015 2.72 异亮氨酸[4] 1.293 C10H13N5O4 [M+H]+ 268.104 268.1047 −2.55 腺苷[6] 1.305 C4H6O4 [M-H]- 117.0193 117.0197 −3.23 琥珀酸[3] 1.555 C15H10O5 [M+NH4]+ 288.0866 288.0867 −0.21 染料木素[7] 2.053 C9H11NO3 [M+NH4]+ 199.1077 199.1074 1.69 酪氨酸[5] 2.168 C9H11NO2 [M+H]+ 166.0863 166.0859 2.03 苯丙氨酸[5] 3.567 C12H8O4 [M+NH4]+ 234.0761 234.0765 −1.81 佛手苷内酯[8] 4.638 C12H13NO3 [M+H]+ 220.0968 220.0967 0.61 金莲花碱[9] 4.929 C9H6O4 [M-H]- 177.0193 177.0192 0.98 6,7-二羟基香豆素[5] 7.301 C10H18O [M+COOH]- 199.034 199.1342 −1.21 芳樟醇[10] 8.646 C25H26N2O3 [M+H]+ 403.2016 403.2029 −3.12 金色酰胺醇/橙黄胡椒酰胺[9] 9.685 C27H28N2O4 [M+H]+ 445.2122 445.2128 −1.34 金色酰胺醇酯/咸南藤酰胺乙酸酯[9] -
马齿苋是一年生肉质草本植物,是常用的药食两用植物,已被列入“中国卫生部药食两用名单”,具有清热解毒、凉血消肿等功效,特别是在保肝抗炎方面具有较好的功效[2]。
CCl4是经典的化学性肝损伤动物模型的肝毒物,可破坏肝细胞膜,从而使胞浆内可溶性酶如ALT、AST等渗入血液中,并最终导致各种类型的肝细胞病变,甚至坏死[11]。正常肝内转氨酶的含量约为血中的100倍,1%的肝特异性细胞坏死即可使血清酶活性增加1倍。因此,转氨酶是肝细胞受损的敏感标志[12]。因而,血清中的ALT、AST水平的高低可以敏感地反映肝脏细胞膜的受损程度。
本研究以CCl4诱导的急性肝损伤小鼠模型为研究对象,考察了马齿苋乙醇提取物的保肝抗炎作用,结果显示,高剂量马齿苋全草提取物可以显著降低CCl4导致的肝损伤和炎症。马齿苋沉淀提取物能够显著降低CCl4诱导的急性肝损伤小鼠血清ALT水平,对血清AST和IL-6水平有降低趋势但不具有统计学意义。马齿苋沉淀提取物对降低CCl4导致的肝损伤和炎症有一定效果,但效果不及全草提取物,说明马齿苋上清提取物可能也含有效成分,与沉淀提取物共同发挥保肝作用。因此,从本研究可以看出,马齿苋沉淀及上清中均存在保肝抗炎的有效成分,且沉淀提取物可能起主要作用,但马齿苋发挥保肝抗炎作用是沉淀与上清提取物中有效成分共同发挥的。中药是世界四大传统医药体系中理论最完整、医疗实践最丰富、疗效最确切的传统医药体系[13]。因为中药的复杂性,中药的药效机制研究一直是个难点。有学者归因于中药功效相关的多成分、多靶点、多环节之间组成的一个相互协同与制约的复杂网络[14]。笔者认为,与马齿苋全草提取物相比,沉淀提取物的抗炎保肝作用较差的原因可能是马齿苋的抗炎保肝作用是通过多成分、多靶点、多环节的相互协同作用实现的,且需维持一定的药物浓度才能显著性的发挥抗炎保肝作用。
为了进一步分析马齿苋抗炎保肝作用的有效成分,本研究通过UPLC-Q-TOF/MS技术对该全草提取物进行分析和鉴定,初步发现约有15种主要化学成分。已研究发现,苹果酸、柠檬酸、琥珀酸为小分子有机酸,具有抗肿瘤、抑菌、抗血栓、抗病毒等作用[15];亮氨酸、异亮氨酸、酪氨酸、苯丙氨酸等氨基酸为营养增补剂;6,7-二羟基香豆素等化合物是自然界重要的天然有机化合物,具有抗菌、抗病毒、抗肿瘤等多种功效[16]。因而,马齿苋提取物能够发挥抗炎护肝作用可能是由以上主要化学成分共同作用的结果,具体的作用机制有待深入研究。
Protective effect of Portulaca oleracea L. extract on acute liver injury induced by carbon tetrachloride in mice and its chemical composition analysis
-
摘要:
目的 探究马齿苋乙醇提取物对四氯化碳所致小鼠急性肝损伤的保护作用,并对其有效成分进行分析。 方法 将80%乙醇马齿苋提取物经离心、减压蒸馏、真空干燥为全草提取物、上清提取物和沉淀提取物。将80只ICR雄性小鼠随机分为8组:对照组、肝损伤模型组、马齿苋全草提取物低剂量组、高剂量组、马齿苋上清提取物低剂量组、高剂量组、马齿苋沉淀提取物低剂量组、高剂量组。经口灌胃去离子水或3种马齿苋提取物不同剂量混悬液1周后,分别皮下注射橄榄油或CCl4橄榄油溶液,16 h后收集血清,检测小鼠血清ALT、AST、IL-6水平,以评价马齿笕对肝损伤的保护作用。采用超高效液相色谱-四极杆-飞行时间质谱(UPLC-Q-TOF/MS)技术分析马齿苋的有效成分。 结果 与模型组相比,马齿苋全草提取物高剂量组小鼠血清AST、ALT、IL-6水平显著降低;沉淀高剂量组小鼠血清ALT显著降低(P<0.05),IL-6水平有所降低,但不具统计学意义;其他各干预组小鼠血清AST、ALT、IL-6水平没有显著性变化。应用UPLC-Q-TOF/MS法共鉴别出苹果酸、柠檬酸、亮氨酸、异亮氨酸、腺苷、琥珀酸、染料木素、酪氨酸、苯丙氨酸等15种主要成分。 结论 马齿苋乙醇全草提取物对CCl4急性肝损伤小鼠具有保肝抗炎作用,可能是15种有效成分发挥的联合作用。 -
关键词:
- 马齿苋 /
- 提取物 /
- CCl4急性化学性肝损伤 /
- 保护作用
Abstract:Objective To investigate the protective effect of the ethanol extract of Portulaca oleracea L. on acute liver injury induced by carbon tetrachloride in mice, and to analyze its effective components. Methods 80% ethanol purslane extract was centrifuged, vacuum distillated and vacuum dried into whole plant extract, supernatant extract and precipitated extract. Eighty ICR male mice were randomly divided into 8 groups: control group, liver injury model group, whole plant extract low-dose group, high-dose group, supernatant extract low-dose group, high-dose group, precipitation extract low-dose group, and high-dose group. After oral administration of distilled water or three kinds of purslane extract suspensions at different doses for 1 week, olive oil or CCl4 olive oil solution were injected subcutaneously respectively. After 16 hours, serum was collected to detect the levels of ALT, AST and IL-6 to evaluate the protective effect of purslane on acute liver injury. Ultra-high performance liquid chromatography quadrupole time of flight mass spectrometry (UPLC-Q-TOF/MS) was used to analyze the effective components of purslane extract. Results Compared with the model group, the levels of serum AST, ALT and IL-6 in high-dose whole plant extract group were significantly reduced. The serum ALT level of mice in the high-dose precipitation extract group was significantly reduced (P<0.05). The serum IL-6 level was decreased, but there was no significant difference. There were no significant changes in the levels of serum AST, ALT and IL-6 in the other intervention groups. 15 main components such as malic acid, citric acid, leucine, isoleucine, adenosine, succinic acid, genistein, tyrosine and phenylalanine were identified by UPLC-Q-TOF/MS. Conclusion Purslane whole plant ethanol extract has hepatoprotective and anti-inflammatory effects on CCl4 acute liver injury mice, which may be a combined effect of 15 active components. -
Key words:
- purslane /
- extract /
- acute chemical liver injury of CCl4 /
- protection
-
西红花为名贵药材,来源于鸢尾科植物番红花Crocus sativus L.的干燥柱头。原产于地中海地区、希腊、小亚细亚和伊朗,后经西藏传入国内,故又名藏红花[1]。《本草纲目》中记载番红花“主治心忧郁积、气闷不散,活血,亦治惊悸”[2]。2020版《中国药典》描述西红花具有活血化瘀、凉血解毒、解郁安神的功效[3]。越来越多的现代药理研究表明,西红花具有抗肿瘤、抗血小板聚集与凋亡、抗心血管细胞凋亡、降血脂和降血糖等活性[4–6],在健康和医疗领域具有重要作用。
世界卫生组织国际癌症研究机构(IARC)发布的最新数据,2020年全球癌症新发患者病例数超过1 930万例,癌症死亡患者接近1 000万例[7]。天然活性成分是抗肿瘤药物研发的重要来源[8]。有研究表明,西红花中特有的西红花酸、西红花苷等具有抗肿瘤活性[9],已有学者在西红花治疗结直肠癌、乳腺癌等的抗肿瘤作用方面进行了相关研究[10-11],但其主要活性成分及抗肿瘤作用机制仍需进一步探索。
网络药理学[12]将系统生物学、生物信息学、计算生物学、网络科学和靶向药理学相结合,从系统层次和生物网络的整体角度探讨成分—靶标—通路的相互作用关系,为中药多靶点、多成分、系统性、整体性的作用机制研究提供了有力的技术支撑,从而指导新药研发和临床诊疗。因此,本研究应用网络药理学结合反向分子对接的方法,对西红花的抗肿瘤作用成分及靶点机制进行研究,为深入探索西红花抗肿瘤药效物质基础及作用机制提供参考。
1. 方法
1.1 西红花化学成分获取
利用TCMSP平台获取西红花化学成分,口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL) 是药物筛选的关键参数,一般设置OB≥30%和DL≥0.18的化学成分作为候选药效成分,并结合文献报道[13–15]补充4个西红花化学成分。
1.2 西红花活性成分和肿瘤疾病相关靶点整理
应用TCMSP平台和PharmMapper[16]工具获取西红花活性成分的作用靶点,并借助UniProt数据库将靶点转换为对应基因。以“tumor”、“cancer”为关键词,在GeneCards(https://www.genecards.org/)、OMIM数据库(https://www.omim.org/)和TTD数据库(http://db.idrblab.net/ttd/)进行检索。将得到的疾病靶点和药物靶点取交集,作为药物作用于疾病的预测靶点。
1.3 “成分-靶点”网络的构建
根据预测的西红花药效成分、交集靶点,使用Cytoscape 3.9.1软件建立“成分-靶点”的网络图。
1.4 蛋白质相互作用网络(protein-protein interaction,PPI)的构建与分析
将药物疾病交集靶点输入String数据库构建PPI网络进行初步筛选,再将PPI网络导入Cytoscape 3.9.1中,以半数degree为参考标准,选取关键靶点。
1.5 基因功能注释和富集通路分析
将筛选获得的37个核心靶点录入Metascape平台(http://metascape.org/gp/index.html),物种设置为人,选择Custom Analysis,设置P<0.01,进行基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.6 分子对接
将筛选出的西红花主要活性成分通过PubChem下载SDF格式;利用RCSB PDB数据库下载关键蛋白靶点,优先选择有配体、结构相对完整的晶体结构,并采用AutoDock Tools对获取的PDB蛋白分子进行除水、加氢、计算电荷预处理;使用AutoDock Vina进行分子对接,计算结合能;选取最优构象,使用PyMOL软件做出3D结合模式图。
2. 结果
2.1 西红花化学成分获取
通过TCMSP获得70个西红花化学成分,设置OB≥30%且DL≥0.18进行筛选,再添加文献检索相关成分,共获得9个西红花活性成分,见表1。
表 1 西红花活性成分序号 化合物编号 化合物英文名 中文名 OB (%) DL 1 MOL001389 n-heptanal 庚醛 79.74 0.59 2 MOL001406 crocetin 西红花酸 35.3 0.26 3 MOL000354 isorhamnetin 异鼠李素 49.6 0.31 4 MOL000422 kaempferol 山柰酚 41.88 0.24 5 MOL000098 quercetin 槲皮素 46.43 0.28 6 MOL001405 crocin Ⅰ 西红花苷Ⅰ 2.54 0.12 7 MOL001407 crocin Ⅱ 西红花苷Ⅱ 1.65 0.21 8 MOL000720 safranal 藏红花醛 39.56 0.04 9 MOL001409 picrocrocin 苦番红花素 33.71 0.04 2.2 西红花活性成分和肿瘤疾病靶点
将TCMSP平台和PharmMapper获取结果进行整理,并借助UniProt数据库进行靶基因匹配,获得201个潜在靶点。以“tumor”和“cancer”为关键词,在GeneCards、OMIM和TTD数据库进行预测整理,剔除重复,筛选得到5896个潜在疾病靶点。将得到的疾病靶点和药物靶点取交集,共得到可作为药物作用于疾病的179个预测靶点。
2.3 “成分-靶点”网络的构建与分析
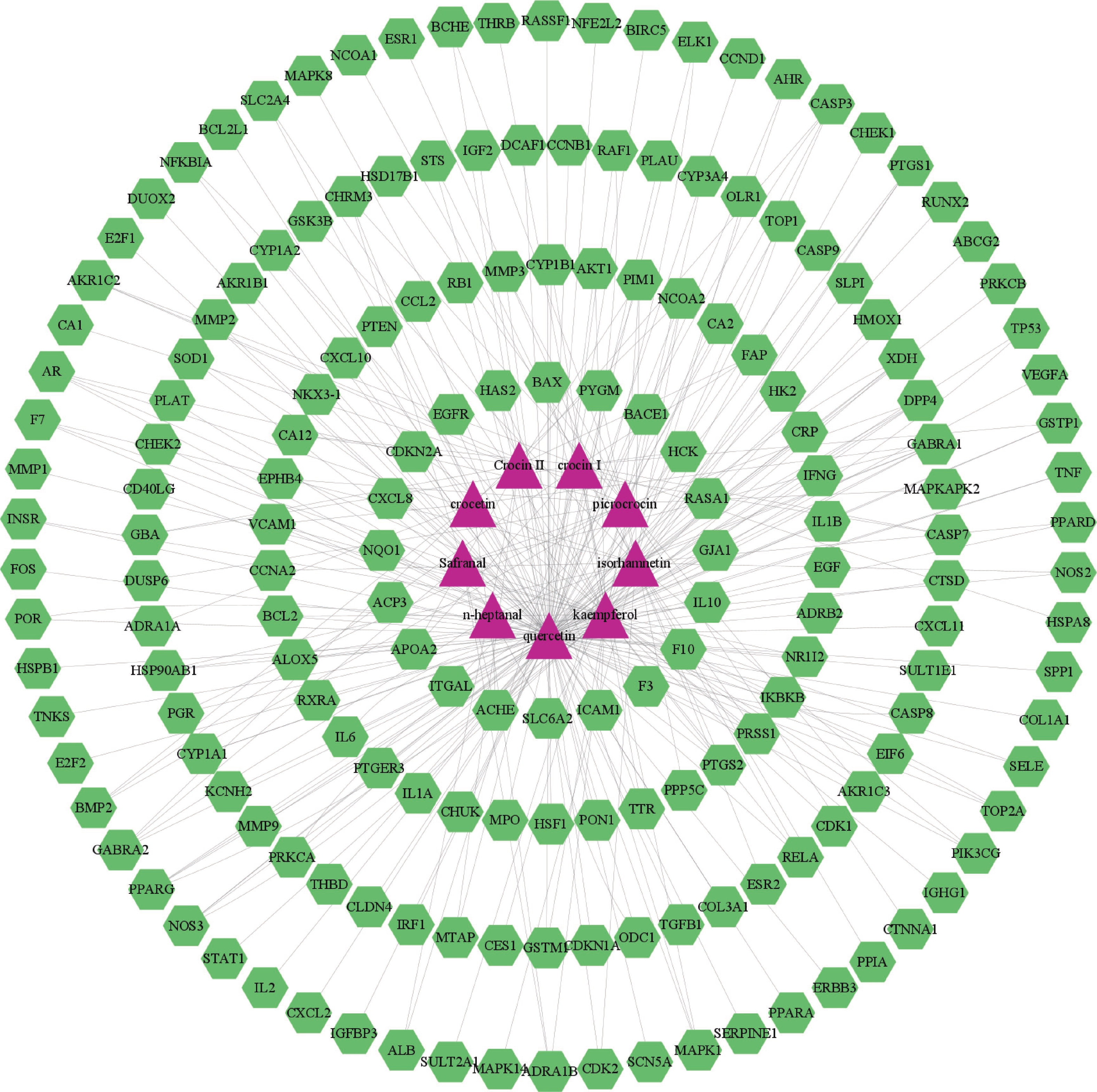
将西红花的9个活性成分与预测到的179个潜在靶点导入Cytoscape 3.9.1软件,构建“药物-活性成分-靶点”网络(图1),网络中绿色代表药物作用于疾病的靶点,蓝色代表西红花活性成分,全图包括189个节点、299条边,其中degree值排名靠前的活性成分为槲皮素、山柰酚、异鼠李素、苦番红花素和西红花苷Ⅰ,这些可能是西红花发挥抗肿瘤作用的潜在活性成分。
2.4 蛋白相互作用PPI的构建与分析
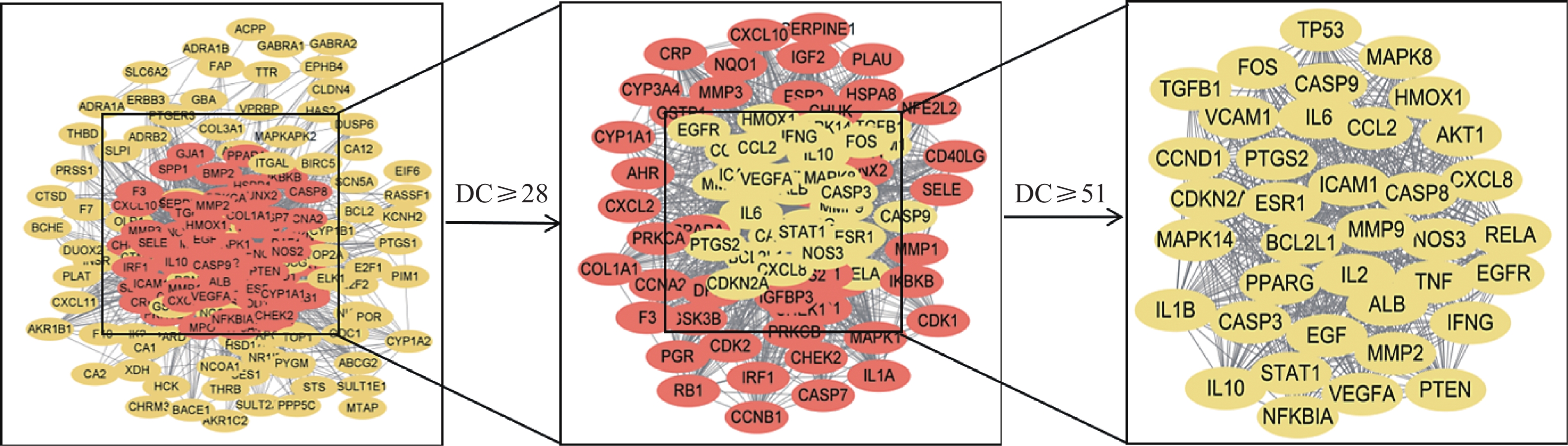
将疾病与活性成分的潜在靶点导入String数据库,采用Cytoscape 3.9.1软件绘制PPI网络图,依据degree值进行排序,以大于半数degree值为标准进行两次筛选,获取核心靶点37个(图2)。度值排名前5的靶点分别为EGF、MMP9、NFKBIA、IL-1B和IL-10,提示这些靶点可能是西红花发挥抗肿瘤作用的关键潜在靶点。
2.5 基因功能注释和富集通路分析
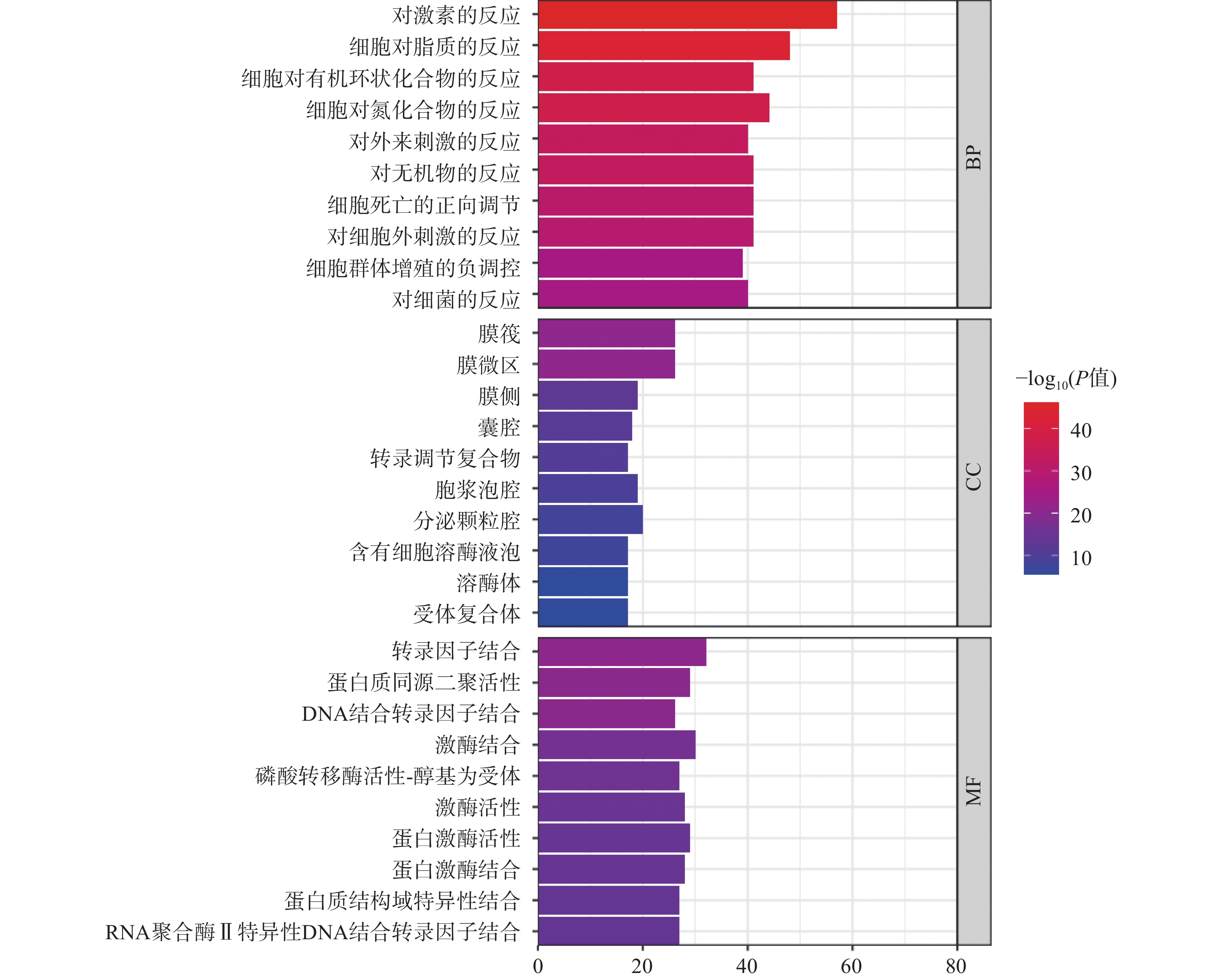
GO分析常用于注释基因和基因产物生物功能,分析包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)三部分。此次GO富集分析共得到BP富集结果193个、CC富集结果83个和MF富集结果123个,选取排名前10的条目绘制GO功能分析图(图3)。如图3所示,BP主要涉及对激素的反应、对脂质的反应、对异源刺激的反应等;CC主要涉及膜筏、膜微区、囊腔、细胞质囊泡腔等;MF主要涉及转录因子结合、DNA结合转录因子结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合等。通过比较发现,细胞生物过程富集的基因数较多,说明西红花可能主要通过调节生物过程发挥抗肿瘤作用。
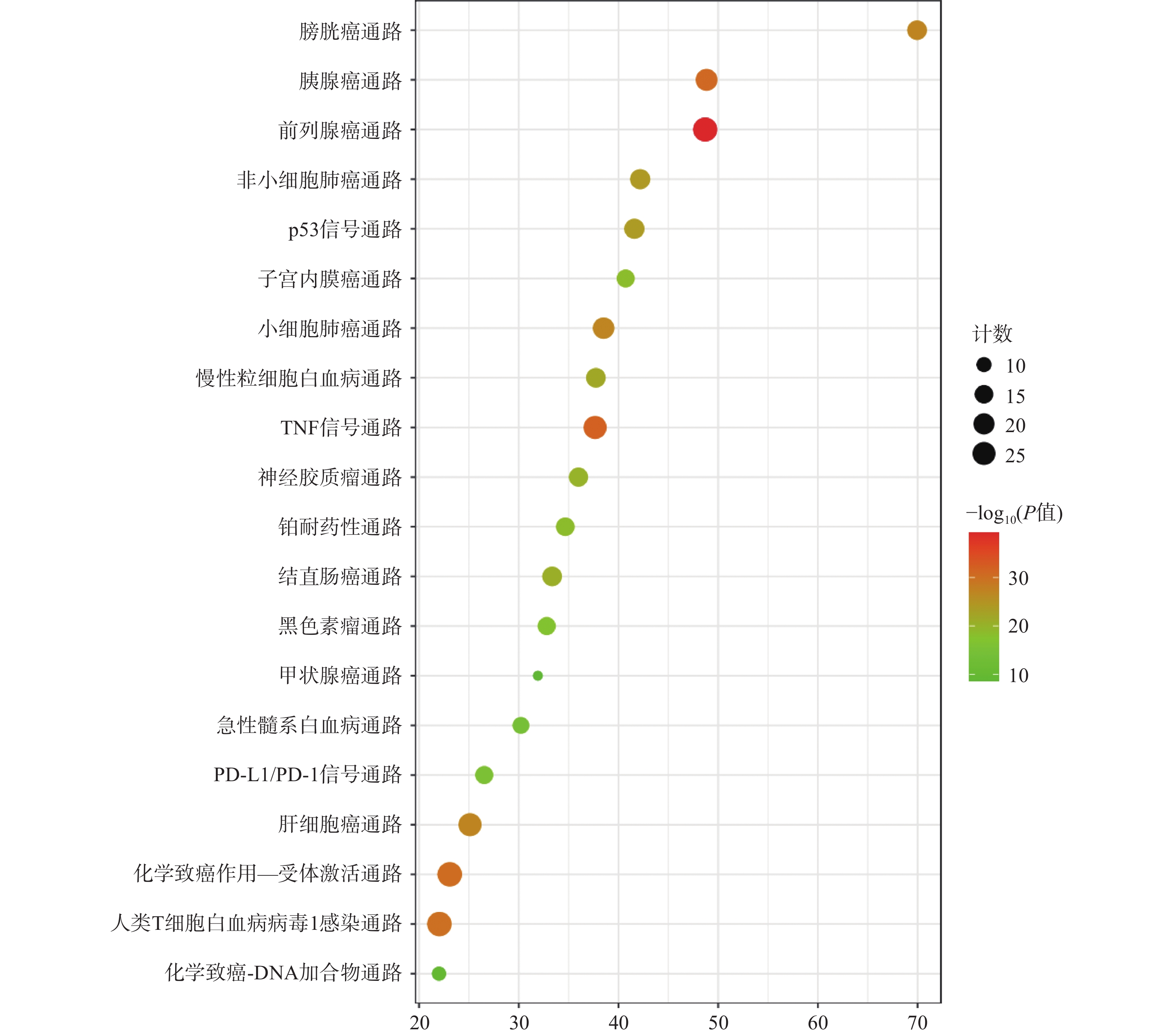
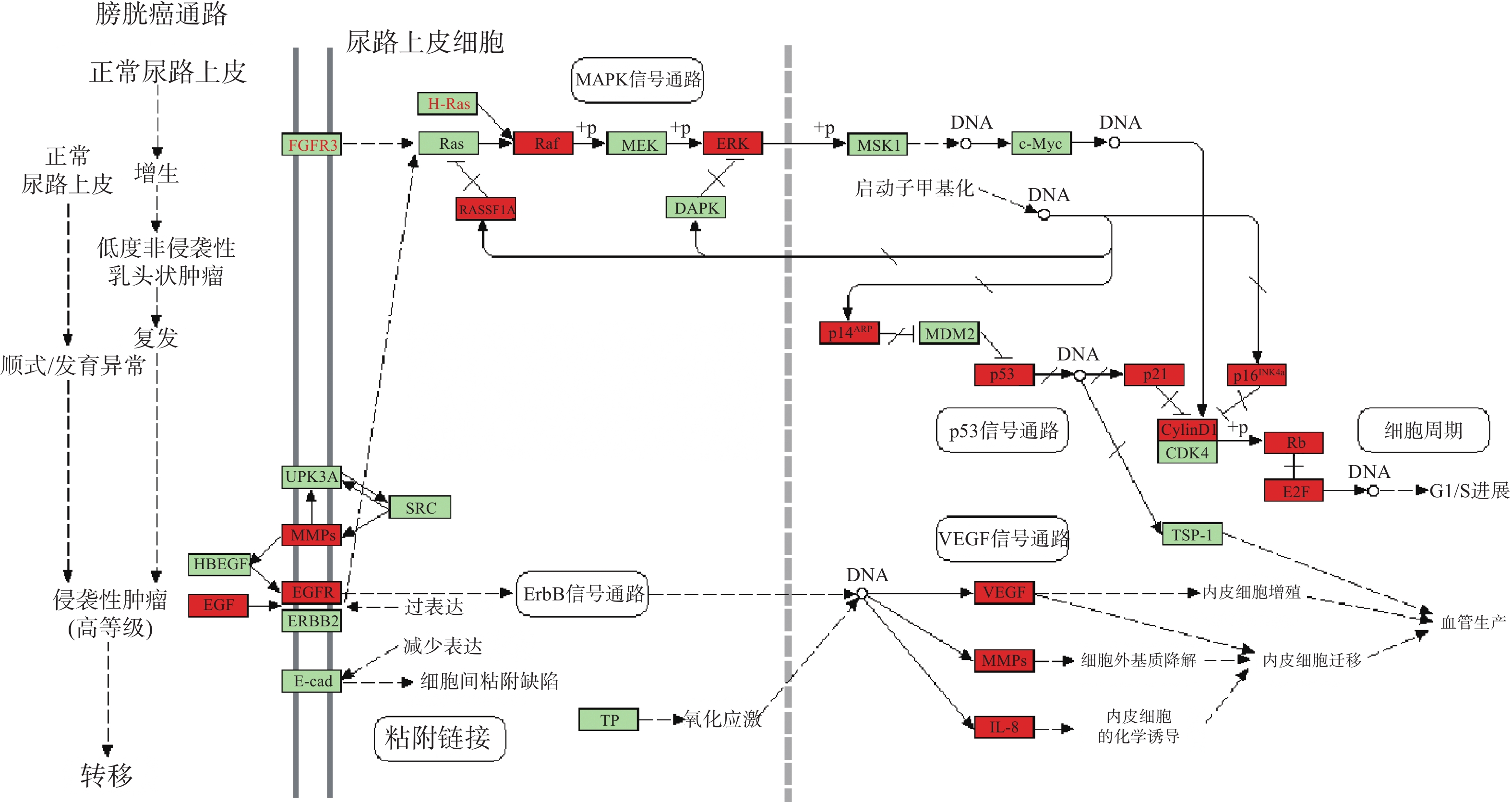
KEGG分析共富集到194条信号通路,其中34条癌症相关通路,并对前20条通路绘制气泡图(图4)。依据KEGG分析,西红花可能通过p53信号通路、TNF通路发挥抗肿瘤作用,可能对膀胱癌、胰腺癌、前列腺癌、非小细胞肺癌等肿瘤具有治疗作用,西红花靶点-通路相互作用网络见图5,红色三角形代表与肿瘤相关的信号通路,蓝色矩形代表关键靶点。其中,西红花通过膀胱癌信号通路调控EGF、MMPs、Raf、VEGF、ERK等基因发挥抗肿瘤作用(图6),红色矩形代表西红花可能干预的关键靶点。
2.6 分子对接
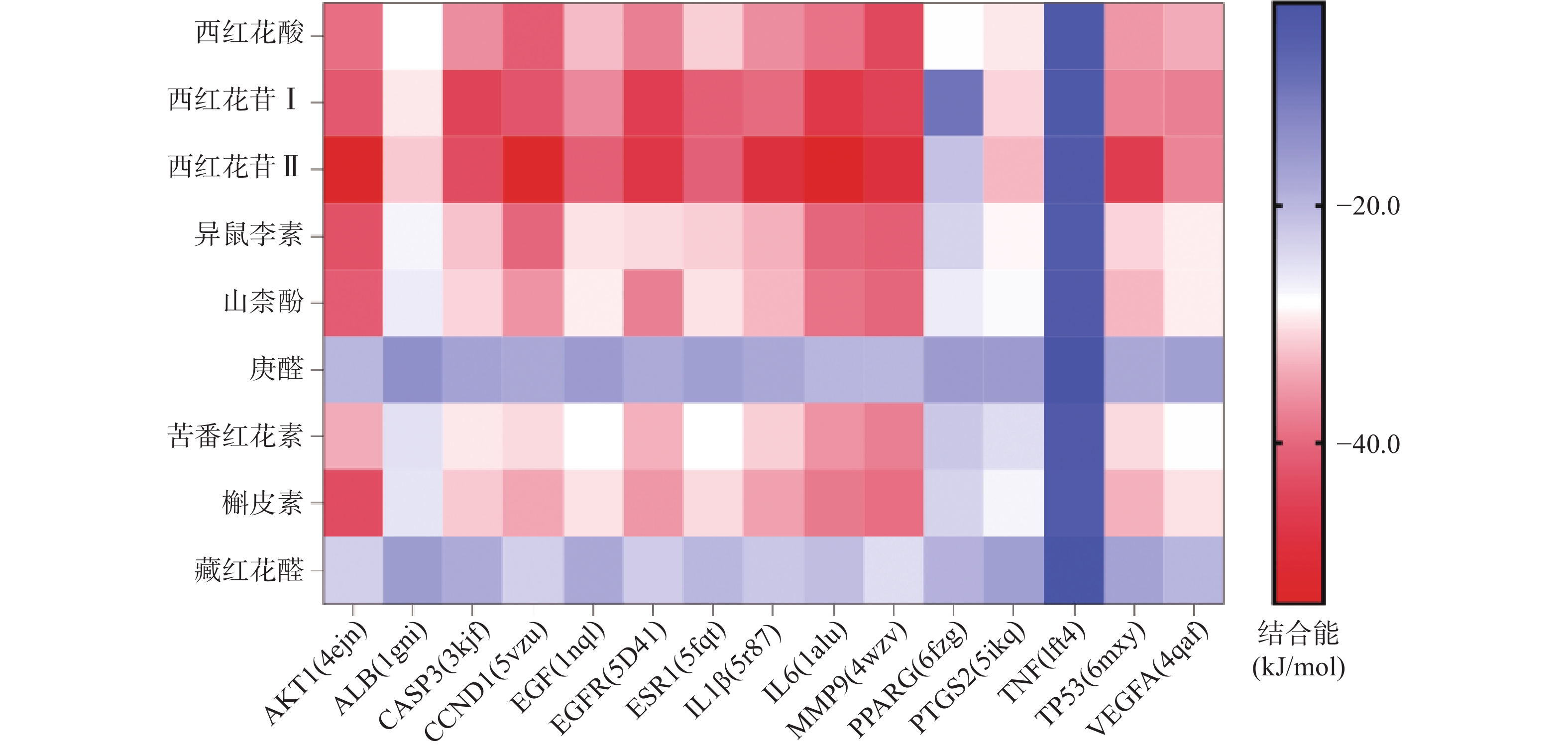
将前15个潜在核心靶点与西红花活性成分进行分子对接。结合能(affinity)<0表明配体分子能够与受体蛋白自发结合,结合能≤−17.78 kJ/mol表明配体与受体有一定的结合活性,结合能≤−20.92 kJ/mol 表明配体与受体有较好的结合活性,结合能≤−29.29 kJ/mol 表明配体与受体有强的结合活性[17],且结合能越低,表明对接的效果越好,结合的构象越稳定[18]。经AutoDock Vina对接,将得到的结合能数据使用热图展示(图7)。本研究结合自由能小于−20.92kJ/mol 的活性成分有102个,占75.6%;小于−29.29kJ/mol 的活性成分有73个,占54.1%,可见这些核心化合物与受体结合活性较高,结构相对稳定。选取结合能力最好的4个组合用Pymol软件进行可视化处理(图8)。
3. 讨论
肿瘤的发生和发展是多基因、多步骤的结果。中药多成分、多靶点的特点使其在肿瘤治疗方面有独特的优势。大量的临床实践表明,中药在治疗肿瘤中能够改善症状、提高患者生存质量、延长生存期等,有着其他治疗药物及手段不可替代的作用[19-20]。以中药黄芪为例,不仅可以通过Wnt5/β-catenin信号通路抑制肿瘤生长[21],同时具有通过PD-L1下调诱导耐药黑色素瘤的干性抑制和化疗敏感性增强的作用,可以减少化疗药物用量[22],还能充当免疫佐剂,提高患者免疫力,改善生存质量[23]。网络药理学最大的优势在于可以运用系统生物学的分析,为中药多成分、多靶点、多通路的机制研究提供有力的技术支撑[12],其分析理念和技术路径又与中医药治疗疾病的整体观相契合,已用于多种中药和中药复方作用机制的研究,如灯盏细辛、半枝莲等中药和茵陈蒿汤、桃红四物汤等中药复方,利用网络药理学的方法得到治疗机制的详细阐述和证明[24–27],为中药药理作用机制的探索提供了很好的参考。
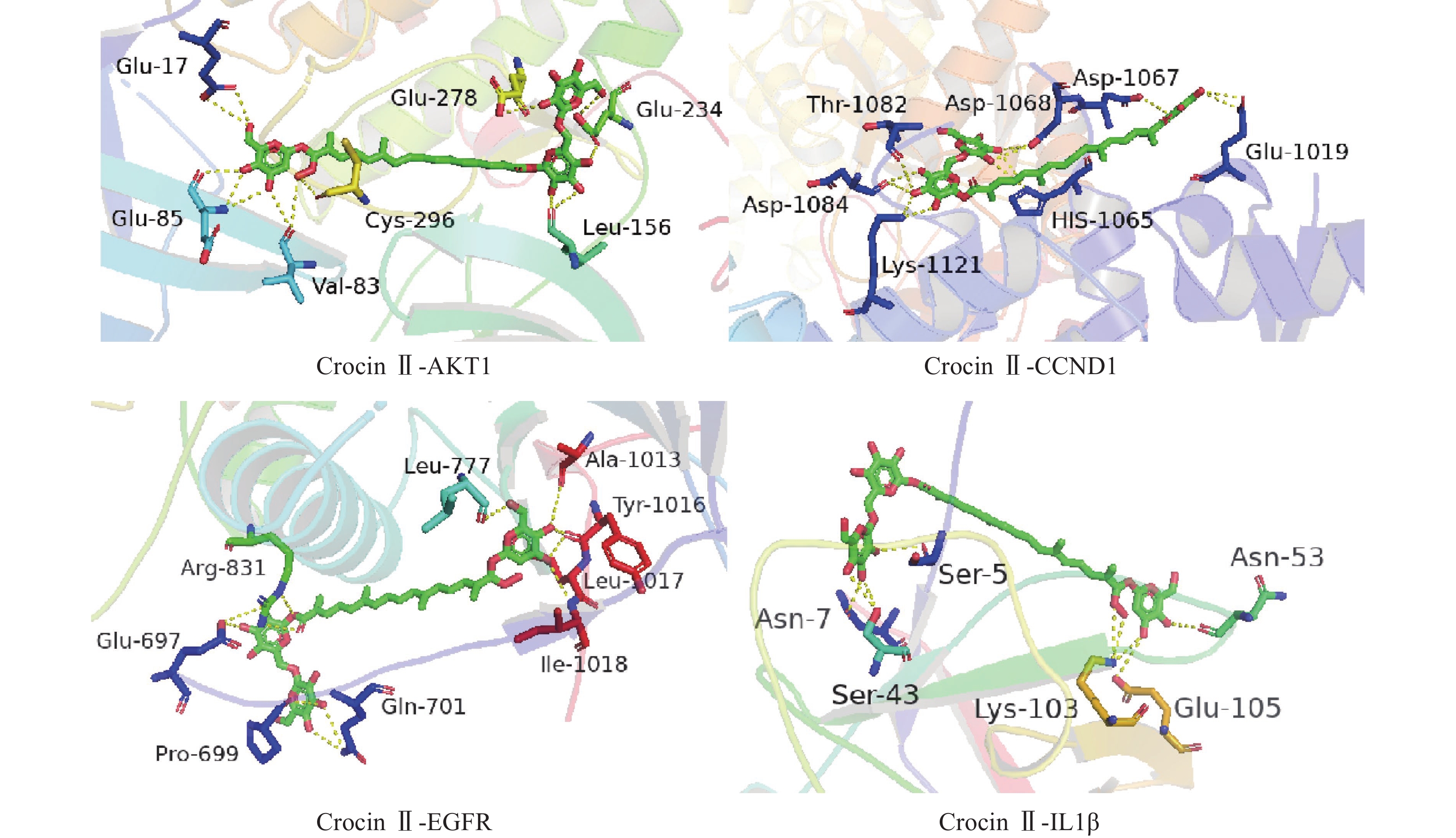
本研究发现西红花中多种成分,如西红花酸、西红花苷等可与IL-6、AKT1、CCND1、IL-1β、MMP9、EGFR、TP53靶点产生适度结合,提示这些靶点可能是西红花中活性成分发挥抗肿瘤作用的关键靶点。研究发现,AKT1是PI3K-AKT-mTOR信号通路中的重要靶点,被磷酸化激活后可以促进细胞的增殖与存活,与肿瘤细胞的生长密切相关[28]。多项研究表明,通过抑制AKT1可以治疗肺癌、结肠癌、卵巢癌等多种实体癌[29]。EGFR与一些全球发病率和致死率高的癌症发病机制直接或间接相关,包括肺癌、乳腺癌和结直肠癌等[30]。当EGFR过度表达时,细胞表面会出现过量的受体,诱导正常的细胞转化为癌细胞,并为癌细胞持续生存提供条件[31]。CCND1是细胞周期家族的一员[32],公认的原癌基因,在甲状旁腺瘤、乳腺癌、肝癌及食管、肺、头颈部鳞状细胞癌的发生、发展过程中均起着重要作用[33-34]。西红花苷是由西红花酸和龙胆二糖或葡萄糖结合形成的二萜苷类化合物,西红花苷Ⅰ和西红花苷Ⅱ的差别在于分子中糖苷基数目的多少 [35]。西红花酸已具有抗肿瘤作用,以其为苷元形成的西红花苷同样也表现出较好的抗肿瘤活性,其中西红花苷Ⅱ的表现最好。西红花苷可以通过P53途径下调细胞周期蛋白d1和p21的表达,诱导细胞凋亡和细胞周期停滞,从而抑制肿瘤生长[36]。分子对接的结果与GO富集分析、KEGG通路富集分析结果一致,验证了网络药理学分析结果的正确性。
Buyun等学者在肝癌Hep3B和HepG2细胞中使用西红花苷抑制了IL-6对STAT3以及细胞周期蛋白D1的激活,验证了西红花对肝癌细胞的抗增殖,凋亡和阻断入侵作用[37]。在转移性乳腺癌的研究中,Ali等研究人员在体内和体外实验中均证明了西红花苷可以通过VEGF和MMP9下调发挥抗肿瘤作用,而且对乳腺癌的转移扩散有较好的抑制作用[38]。这些研究成果在一定程度上验证了利用网络药理学探究发现的西红花抗肿瘤作用机制的可行性。
综上所述,本研究利用网络药理学结合分子对接技术,探究西红花抗肿瘤作用的活性成分、作用靶点及信号通路。发现西红花抗肿瘤的作用具有多成分、多靶点、多通路、多机制的特点,其中以西红花苷为代表的西红花特有化学成分显示出了良好的抗肿瘤活性,可以在多条肿瘤发生通路中发挥作用,为西红花治疗肿瘤的深入研究提供了理论基础。但这些结果受限于各个数据库信息的片面性,而且只关注了成分,没有考量到成分的含量及其之间是否存在相互作用,预测的结果存在一定的片面性和局限性,需要进一步进行体内、外实验验证。
-
表 1 马齿苋提取物UPLC-Q-TOF/MS分析结果
时间
(tR/min)分子式 离子峰归属 质荷比 偏差 化合物 理论值 实测值 0.847 C4H6O5 [M-H]- 133.0142 133.0147 −0.49 苹果酸[3-4] 1.019 C6H8O7 [M-H]- 191.0197 191.0198 −0.62 柠檬酸[3] 1.097 C6H13NO2 [M+H]+ 132.1019 132.1014 3.91 亮氨酸[5] 1.203 C6H13NO2 [M+H]+ 132.1019 132.1015 2.72 异亮氨酸[4] 1.293 C10H13N5O4 [M+H]+ 268.104 268.1047 −2.55 腺苷[6] 1.305 C4H6O4 [M-H]- 117.0193 117.0197 −3.23 琥珀酸[3] 1.555 C15H10O5 [M+NH4]+ 288.0866 288.0867 −0.21 染料木素[7] 2.053 C9H11NO3 [M+NH4]+ 199.1077 199.1074 1.69 酪氨酸[5] 2.168 C9H11NO2 [M+H]+ 166.0863 166.0859 2.03 苯丙氨酸[5] 3.567 C12H8O4 [M+NH4]+ 234.0761 234.0765 −1.81 佛手苷内酯[8] 4.638 C12H13NO3 [M+H]+ 220.0968 220.0967 0.61 金莲花碱[9] 4.929 C9H6O4 [M-H]- 177.0193 177.0192 0.98 6,7-二羟基香豆素[5] 7.301 C10H18O [M+COOH]- 199.034 199.1342 −1.21 芳樟醇[10] 8.646 C25H26N2O3 [M+H]+ 403.2016 403.2029 −3.12 金色酰胺醇/橙黄胡椒酰胺[9] 9.685 C27H28N2O4 [M+H]+ 445.2122 445.2128 −1.34 金色酰胺醇酯/咸南藤酰胺乙酸酯[9] -
[1] FARKHONDEH T, SAMARGHANDIAN S, AZIMI-NEZHAD M, et al. The hepato-protective effects of Portulaca oleracea L. extract: Review[J]. Curr Drug Discov Technol,2019,16(2):122-126. doi: 10.2174/1570163815666180330142724 [2] 施文彩, 薛凡, 李菊红, 等. 马齿苋的药理活性研究进展[J]. 药学服务与研究, 2016, 16(4):291-295. [3] 郭志峰, 刘鹏岩, 傅承光. 离子排斥色谱法测定马齿苋中低分子羧酸[J]. 色谱, 1996, 14(1):50-52. [4] 金天云, 沈涛, 周明星, 等. 马齿苋的化学成分及其生物活性研究[J]. 中国药学杂志(英文版), 2016, 25(12):898-905. [5] 丁怀伟, 姚佳琪, 宋少江. 马齿苋的化学成分和药理活性研究进展[J]. 沈阳药科大学学报, 2008, 25(10):831-838. [6] XIANG L, XING D M, WANG W, et al. Alkaloids from Portulaca oleracea L[J]. Phytochemistry,2005,66(21):2595-2601. doi: 10.1016/j.phytochem.2005.08.011 [7] ZHU H B, WANG Y Z, LIU Y X, et al. Analysis of flavonoids in Portulaca oleracea L. by UV-vis spectrophotometry with comparative study on different extraction technologies[J]. Food Anal Methods,2010,3(2):90-97. doi: 10.1007/s12161-009-9091-2 [8] 向兰, 邢东明, 王伟, 等. 马齿苋的化学成分研究进展[J]. 亚太传统医药, 2006, 2(7):64-68. [9] YANG Z J, LIU C J, XIANG L, et al. Phenolic alkaloids as a new class of antioxidants in Portulaca oleracea[J]. Phytother Res,2009,23(7):1032-1035. doi: 10.1002/ptr.2742 [10] 刘鹏岩, 靳伯礼, 郭志峰, 等. 马齿苋挥发油的GC-MS分析[J]. 河北大学学报:自然科学版, 1994, 14(3):72-74. [11] LIU X F, ZHENG C G, SHI H G, et al. Ethanol extract from Portulaca oleracea L. attenuated acetaminophen-induced mice liver injury[J]. Am J Transl Res,2015,7(2):309-318. [12] ZHOU Y X, XIN H L, RAHMAN K, et al. Portulaca oleracea L. : a review of phytochemistry and pharmacological effects[J]. Biomed Res Int,2015,2015:1-11. [13] JIN L. From mainstream to marginal? Trends in the use of Chinese medicine in China from 1991 to 2004[J]. Soc Sci Med,2010,71(6):1063-1067. doi: 10.1016/j.socscimed.2010.06.019 [14] 邓小敏, 郭超峰. 网络药理学背景下的中药药效机制及疗效评价研究[J]. 医学与哲学(A), 2012, 33(10):67-68. [15] 王媚, 吴皓. 中药有机酸类成分的提取分离及测定方法研究进展[J]. 南京中医药大学学报, 2004, 20(3):190-192. doi: 10.3969/j.issn.1000-5005.2004.03.025 [16] 张韶瑜, 孟林, 高文远, 等. 香豆素类化合物生物学活性研究进展[J]. 中国中药杂志, 2005, 30(6):410-414. doi: 10.3321/j.issn:1001-5302.2005.06.002 期刊类型引用(2)
1. 刘莲,孟宪群,包璇,黄梓萌,王丹. 白芍多糖对小鼠急性肝损伤的保护与机制研究. 中国临床药理学杂志. 2023(04): 518-522 .  百度学术
百度学术2. 李小花,曹性玲,刘四君,曹思,钟桂香,黎晓,吴丽珍. 马齿苋多糖抗CCl_4诱导的小鼠慢性肝纤维化作用. 赣南医学院学报. 2023(04): 365-370 .  百度学术
百度学术其他类型引用(1)
-





 下载:
下载:

 下载:
下载: